修回日期: 2007-10-03
接受日期: 2007-11-25
在线出版日期: 2008-01-08
目的: 探讨Dkk1 cDNA抗结肠癌的机制.
方法: 利用脂质体介导pcDNA3.1(+)Dkk1进行瞬时转染结肠癌细胞CT26和表达Dkk1的肝癌细胞HEPA1-6, 转染后的细胞为实验组, 转染空载体pcDNA3.1(+)的细胞和未转染的细胞分别为空载体组和未转染组, 用MTT法检测CT26增殖、免疫印迹法检测细胞Dkk1, p53, Bcl-2和Bax的表达量.
结果: MTT实验显示在570 nm的吸光度均值CT26实验组明显低于其空载体组和未转染组(0.779±0.025 vs 0.968±0.016, 0.973±0.016), P<0.05); 与CT26空载体组和未转染组相比, 实验组p53, Bcl-2的表达量降低、而Dkk1、Bax表达增高.
结论: 外源Dkk1可反馈抑制突变型p53的生成, 下调Bcl-2, 增加Bax因子表达而抑制结肠癌的增殖.
引文著录: 李甲初, 左渝平, 刘洋, 曾昭淳. Dickkopf-1克隆及其抗结肠癌作用. 世界华人消化杂志 2008; 16(1): 20-24
Revised: October 3, 2007
Accepted: November 25, 2007
Published online: January 8, 2008
AIM: To clone the cDNA of Dickkopf-1 (Dkk1) and to investigate its anti-colon carcinoma activity.
METHODS: Dkk1 cDNA was retrived from Mouse Embryo 9 dpc, DH10B cDNA library, and eukaryotic expression vector pcDNA3.1(+) Dkk1 was constructed. Transfected CT26 colon carcinoma cells served as the experimental group, transfection empty vector pcDNA3.1(+) cells served as the empty vector group, and non-transfected cells as the non-transfected group. Proliferation of the CT26 colon carcinoma cells was measured by MTT assay. Expression of Dkk1, p53, Bcl-2 and Bax was detected by Western blotting.
RESULTS: Absorbance at 570 nm in the experimental group was lower than that in the empty vector and non-transfected groups (0.779 ± 0.025 vs 0.968 ± 0.016 and 0.973 ± 0.016, P < 0.05). Compared with the empty vector and non-transfected groups, the level of p53 and Bcl-2 in CT26 cells was lower, and the level of Dkk1 and Bax was higher.
CONCLUSION: Inhibition of CT26 cell proliferation by Dkk1 expression may be mediated by Dkk1 blocking mutant p53, decreasing Bcl-2 and enhancing Bax expression.
- Citation: Li JC, Zuo YP, Liu Y, Zeng ZC. Anti-colon carcinoma mechanism of cloned Dickkopf-1. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 20-24
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/20.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.20
结肠癌是消化系统最常见的恶性肿瘤之一, 其发病机制并不完全清楚. Wnt信号的异常是导致恶性肿瘤的原因之一[1-2]. 脊椎动物的Dkk蛋白有Dkk1、Dkk2、Dkk3和Dkk4四种形式, 他们有较高同源性, 均抑制Wnt信号[3-4], 其中Dkk1作用最强[5], 在胚胎头颈形成起重要作用[6]. 哺乳动物的Dkk1含266个氨基酸残基, 在不同的肿瘤表达水平不同. 在人类胃肠道肿瘤中, DKK家族基因常常被后天灭活[7-8], Dkk1蛋白减少或缺失. Shou et al[9]在人胶质母细胞瘤U87MG细胞中, 也没有检测到Dkk1的表达. 而在肝癌[10-11]、黑色素瘤[12]、肺癌[13]Dkk1水平则增高. Mikheev et al[14]在HeLa细胞表达的外源Dkk1显著地抑制其在软琼脂上的生长, 其生长动力学参数在统计学上与HeLa细胞有显著差异. 如果将Dkk1基因转入U87MG细胞, 表达中等水平的Dkk1蛋白, 再用神经酰胺(ceramide)处理, 细胞则出现显著凋亡[9]. 两者均显示在Dkk1水平低下时, 表达外源性Dkk1可以抑制细胞生长, 促进细胞凋亡. 这可能是通过调节Wnt和p53信号而发挥作用的. p53能诱导Dkk1的表达[15-16], Dkk1蛋白能抑制Wnt信号, 增强p53对肿瘤生长的抑制作用. Gonzalez-Sancho et al[17]发现Dkk1启动子上有多个β-catenin/TCF4结合位点. 激活Wnt信号途径, 活性的β-catenin, TCF4或者LRP6突变体均可诱导人类Dkk1转录. 结肠癌细胞里缺失Dkk1或水平降低, Dkk1的表达起抑制肿瘤增殖的作用. 我们将考察Dkk1的抗结肠癌作用, 研究其可能的机制.
肝癌细胞HEPA1-6和结肠癌细胞CT26, 由重庆医科大学病理教研室惠赠, 用含100 mL/L小牛血清RPMI 1640(Gibco)培养基, 在37℃、50 mL/L CO2培养箱中传代培养. 利用脂质体介导pcDNA3.1(+)Dkk1进行瞬时转染结肠癌细胞CT26, 转染后的细胞为实验组, 转染空载体pcDNA3.1(+)的细胞和未转染的细胞作为对照组. mouse embryo 9 dpc, DH10B cDNA文库购自德国RZPD公司, 限制性内切酶BamHⅠ和HindⅢ, T4 DNA连接酶、高保真Taq DNA聚合酶(TaKaRa)、质粒提取试剂盒(上海生工)、PCR产物回收纯化试剂盒、DNA胶回收试剂盒、低分子量蛋白质标准、TMB显色液(Tiangen)、Transfection转染试剂(天为时代公司)、四甲基偶氮唑盐(MTT、百萃生物)、PVDF膜(北京中山). 一抗: 兔抗鼠、人的Dkk1, p53, Bcl-2, Bax(IgG Santa Clauz), 兔抗二抗(中杉金桥).
根据Dkk1的DNA序列, 设计PCR引物如下, 上游引物: 5'-CGCCAAGCTTTTAGTGTCTCTGGCAGGTGTGGAGCCTAGAA-3', 在5'端引入HindⅢ酶切位点. 下游引物: 5'-ATAAGGATCCATGATGGTTGTGTGTGCAGCGGCAGCT-3', 在5'端引入了BamHⅠ酶切位点. 菌落PCR, 用牙签在mouse embryo 9 dpc, DH10B cDNA培养面上蘸一下后丢入LA培养基5 mL中, 在37℃剧烈震荡培养12-16 h后, 培养液浑浊时, 用接种环在含Amp 100 mg/L的LB培养基上划线, 37℃倒置培养16 h以后, 在培养板上随机挑取9个克隆做PCR并设立阴性对照. PCR反应参数如下: 94℃变性1 min, 50℃复性2 min, 72℃延伸2 min, 共30个循环. PCR产物用凝胶回收试剂盒纯化、测序确认后, T-A克隆入pGM-T载体, Amp筛选, BamHⅠ和HindⅢ双酶切, 琼脂糖电泳回收850 bp左右的小片段DNA, 亚克隆入BamHⅠ和HindⅢ双酶切pcDNA3.1(+)真核表达质粒, 构成pcDNA3.1 Dkk1. 琼脂糖电泳, 回收重组载体pcDNA3.1 Dkk1, 酶切和PCR鉴定.
1.2.1 MTT实验: 用pcDNA3.1-Dkk1和pc DNA3.1(+)质粒在LipofectamineTM脂质体的介导下转染上述细胞. 以pEGFP-C1载体为报告基因监测转染结果. 取DNA 2 mg, Transfection 5 μL分别用无血清培养基稀释至250 μL. 用胰酶消化细胞, 取0.4×106细胞与上述2种液体混合, 培养, G418筛选, 6 d后, 取4×105细胞加入到96孔板中, 继续培养24 h后每孔加入MTT至终浓度50 mg/L, 37℃继续培养4 h, 吸出培养液, 每孔加入DMSO g/L 150 μL, 酶标仪上振荡10 min测定570 nm处吸光度. 细胞抑制率 = [pcDNA3.1(+)组A570-pcDNA3.1-Dkk1组A570]/pcDNA3.1(+)组A570×100%.
1.2.2 Western blot分析: 提取各组细胞总蛋白, Lowry法测定蛋白含量, 取等量蛋白进行12% SDS-PAGE, 转PVDF膜, 30 g/L BSA/TBS溶液8 mL封闭, 洗膜3次, 将一抗(兔抗鼠、人p53, Bcl-2, Bax, Dkk1)分别以1∶1000适当稀释于5 g/L BSA/TBS中37℃孵育至少1 h, 弃去一抗用TBS洗2次, 每次10 min; 弃去TBS, 加入适当稀释1∶500于5 g/L BSA/TBS的二抗, 37℃孵育2 h; 弃去二抗, 用TBS洗膜30 min, 共3次, 显色.
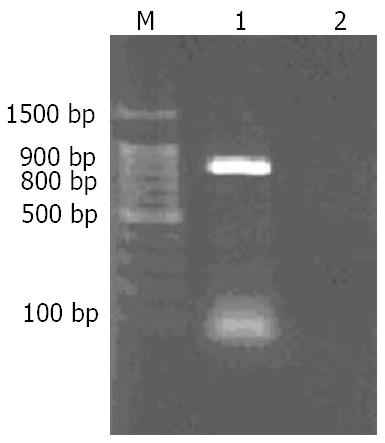
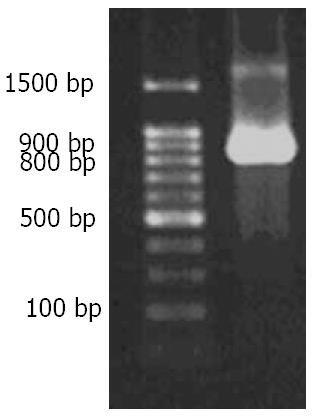
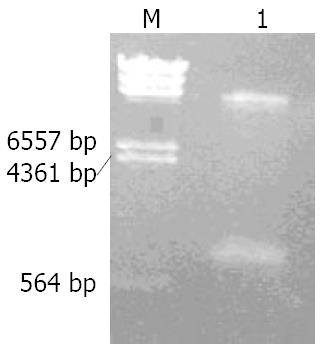
阴性对照管没有条带, 而1号管出现一条大小在800-900 bp间的条带, 符合Dkk1 cDNA大小, 测序后确认即为Dkk1 cDNA, 没有碱基突变(图1). 对pcDNA3.1(+) Dkk1进行PCR, 结果条带大小在800-900 bp之间, 与Dkk1 cDNA大小相符合(图2). HindⅢ和BamHⅠ双酶切pcDNA3.1(+) Dkk1载体, 产生两个片段. 大片段在4361-6557 bp之间, 与载体pcDNA3.1大小相符; 小片段与Dkk1 cDNA大小相符(图3).
用脂质体介导pcDNA 3.1(+) Dkk1瞬时转染结肠癌细胞CT26和表达Dkk1的肝癌细胞HEPA1-6(对照), MTT法检测细胞的增殖. CT26与对照组比较, 570 nm吸光度明显降低, 外源的Dkk1在CT26表达可以抑制其增殖, 抑制率约为20%. 而HEPA1-6细胞及其相应的对照在570 nm吸光度没有明显的变化(表1). t检验显示CT26实验组和对照组有显著性差异P<0.05, 其余各组间无显著性差异.
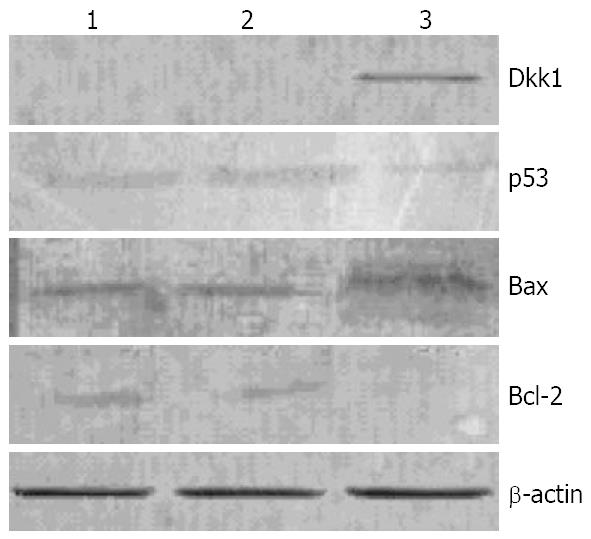
实验组3相对于对照组1和2, 蛋白质p53和Bcl-2的量是少的, 而蛋白质Bax的量, 实验组相对于对照组来说是多的(图4).
Dkk1在结肠癌细胞表达缺失, 是否起抑癌基因的作用尚待证实. 我们从mouse embryo 9 dpc, DH10B cDNA文库筛选出Dkk1 cDNA, 经测序确认后亚克隆入pcDNA3.1(+)构建了pcDNA3.1 Dkk1真核表达载体, 转染结肠癌细胞CT26, 用MTT法测570 nm吸光度, CT26pcDNA3.1 Dkk1组高于CT26pcDNA3.1(+)实验低于对照组, t检验有显著性差异. 表明外源的Dkk1在CT26表达可以抑制其增殖, 抑制率约为20%, 抑制率不太高, 可能与转染效率(约为28.3%)和抑制不具有放大作用有关. 而在肝癌细胞HEPA1-6, 表达外源的Dkk1不抑制其增殖. 免疫印吸分析细胞总蛋白中p53的含量, CT26、CT26pcDNA3.1(+)高于CT26pcDNA3.1 Dkk1(图4). Gonzalez-Sancho et al[17]发现在Dkk1启动子-2100位有一个p53响应元件, 野生p53蛋白与之特异结合, 促进Dkk1转录. 在CT26检测不到Dkk1, 可能是突变p53蛋白丧失诱导Dkk1转录的能力. 外源Dkk1基因在结肠癌细胞内的表达, 反馈抑制突变p53的表达, 致使其量减少, 肿瘤细胞的增殖受抑. 肿瘤既是细胞增殖和分化异常、也是细胞凋亡异常的疾病. Bcl-2家族基因参与细胞凋亡的调节, Bcl-2蛋白拮抗[18]、而Bax蛋白则促进细胞凋亡[19], 二者的作用相反. 细胞内的Bax和Bcl-2含量对比决定其生存与凋亡[20]. 我们发现CT26中Bax蛋白的量在pcDNA3.1(+)组要低于pcDNA3.1 Dkk1组, 而Bcl-2蛋白的量则是pcDNA3.1(+)组要高于pcDNA3.1 Dkk1组(图4), 表明在Dkk1抑制肿瘤细胞增殖时, 与Bax和Bcl-2蛋白作用有关. Dkk1蛋白在许多肿瘤中都存在. Wirths et al[11]指出, Dkk1在肝母细胞瘤(HBs)和Wilms瘤中表达升高, 这可能和Wnt信号失控有关, 高水平的Dkk1可作为HBs和Wilms瘤的一个标记. 在Dkk1表达降低或者缺失的肿瘤, 外源的Dkk1表达或许可以抑制肿瘤增殖. Suraweera et al[21]报道没有发现人结肠癌的Dkk1突变, 但Aguilera et al[7]发现Dkk1启动子的CpG岛甲基化导致转录沉默. 有趣的是Mueller et al[22]发现神经胶质瘤里Dkk1没有突变, 其转录也不受p53调节, 他不是该肿瘤的主要致病因素. 是否Dkk1蛋白也具有突变型和野生型? 如果有, 是否突变的蛋白具有致癌而野生型具有抑癌作用; Dkk1抑制结肠癌的机制以及Dkk1在胞内的作用等还有待于进一步的研究.
Wnt信号的转导由Wnt和Frizzled 受体结合引起, 需要低密度脂蛋白受体相关蛋白5/6(LRP5/60)的参与. Dickkopf1 (Dkk1)通过两种途径抑制Wnt信号转导: 与LRP5/ 6结合, 阻断 Wnt信号; 与另一类跨膜蛋白Kremen1/2结合, 刺激LRP5/6内吞, 减少细胞膜上的LRP5/6, 进一步调节Wnt信号. Dkk1蛋白通过调节Wnt和p53信号促进肿瘤细胞凋亡.
肿瘤的基因治疗是手术、放射、化疗之后的新疗法. Dkk1在某些肿瘤细胞的低表达, 为导入外源Dkk1治疗这些肿瘤提供了前提条件. 研究Dkk1的细胞内水平的调控, 与其他信号途径的相互作用, 对细胞增值影响的机制, 获得相关的信息是当前的热点. 这为肿瘤Dkk1的基因治疗、研发与Dkk1相关的肿瘤治疗药物打下坚实的基础.
本文介绍了用MTT法显示外源Dkk1基因在CT26细胞的表达对细胞的增殖具有一定的抑制作用, 免疫印吸方法显示了在结肠癌CT26细胞中的Dkk1、Bax表达低于、Bcl-2、p53表达高于pcDNA3.1 (+)Dkk1转染的CT26细胞. 转染Dkk1后, p53水平降低. 推测外源Dkk1表达可反馈抑制突变的p53生成, 抑制癌细胞的增殖. 最近也报道Dkk1在某些肿瘤细胞的表达是低下的, 这不是突变引起的, 而是表达受阻, 原因在转录水平. 而在翻译水平抑制尚未见报道.
Dkk1具有抑制肿瘤细胞增殖的作用, 但在某些肿瘤细胞的表达水平很低, 导入外源性Dkk1可以解决这一问题. 本课题已初步证实, Dkk1可以作为某些肿瘤基因治疗的目的基因.
本文设计合理, 方法全面, 结果可信, 具有一定的科学性和研究价值.
编辑: 何燕 电编:何基才
| 1. | Bafico A, Liu G, Goldin L, Harris V, Aaronson SA. An autocrine mechanism for constitutive Wnt pathway activation in human cancer cells. Cancer Cell. 2004;6:497-506. [PubMed] |
| 2. | Hadjihannas MV, Bruckner M, Jerchow B, Birchmeier W, Dietmaier W, Behrens J. Aberrant Wnt/beta-catenin signaling can induce chromosomal instability in colon cancer. Proc Natl Acad Sci U S A. 2006;103:10747-10752. [PubMed] |
| 3. | Bafico A, Liu G, Yaniv A, Gazit A, Aaronson SA. Novel mechanism of Wnt signalling inhibition mediated by Dickkopf-1 interaction with LRP6/Arrow. Nat Cell Biol. 2001;3:683-686. [PubMed] |
| 4. | Lee AY, He B, You L, Xu Z, Mazieres J, Reguart N, Mikami I, Batra S, Jablons DM. Dickkopf-1 antagonizes Wnt signaling independent of beta-catenin in human mesothelioma. Biochem Biophys Res Commun. 2004;323:1246-1250. [PubMed] |
| 5. | MacDonald BT, Adamska M, Meisler MH. Hypomorphic expression of Dkk1 in the double-ridge mouse: dose dependence and compensatory interactions with Lrp6. Development. 2004;131:2543-2552. [PubMed] |
| 6. | del Barco Barrantes I, Davidson G, Grone HJ, Westphal H, Niehrs C. Dkk1 and noggin cooperate in mammalian head induction. Genes Dev. 2003;17:2239-2244. [PubMed] |
| 7. | Aguilera O, Fraga MF, Ballestar E, Paz MF, Herranz M, Espada J, Garcia JM, Munoz A, Esteller M, Gonzalez-Sancho JM. Epigenetic inactivation of the Wnt antagonist DICKKOPF-1 (DKK-1) gene in human colorectal cancer. Oncogene. 2006;25:4116-4121. [PubMed] |
| 8. | Sato H, Suzuki H, Toyota M, Nojima M, Maruyama R, Sasaki S, Takagi H, Sogabe Y, Sasaki Y, Idogawa M. Frequent epigenetic inactivation of DICKKOPF family genes in human gastrointestinal tumors. Carcinogenesis. 2007;28:2459-2466. [PubMed] |
| 9. | Shou J, Ali-Osman F, Multani AS, Pathak S, Fedi P, Srivenugopal KS. Human Dkk-1, a gene encoding a Wnt antagonist, responds to DNA damage and its overexpression sensitizes brain tumor cells to apoptosis following alkylation damage of DNA. Oncogene. 2002;21:878-889. [PubMed] |
| 10. | Patil MA, Chua MS, Pan KH, Lin R, Lih CJ, Cheung ST, Ho C, Li R, Fan ST, Cohen SN. An integrated data analysis approach to characterize genes highly expressed in hepatocellular carcinoma. Oncogene. 2005;24:3737-3747. [PubMed] |
| 11. | Wirths O, Waha A, Weggen S, Schirmacher P, Kuhne T, Goodyer CG, Albrecht S, Von Schweinitz D, Pietsch T. Overexpression of human Dickkopf-1, an antagonist of wingless/WNT signaling, in human hepatoblastomas and Wilms' tumors. Lab Invest. 2003;83:429-434. [PubMed] |
| 12. | Kuphal S, Lodermeyer S, Bataille F, Schuierer M, Hoang BH, Bosserhoff AK. Expression of Dickkopf genes is strongly reduced in malignant melanoma. Oncogene. 2006;25:5027-5036. [PubMed] |
| 13. | Yamabuki T, Takano A, Hayama S, Ishikawa N, Kato T, Miyamoto M, Ito T, Ito H, Miyagi Y, Nakayama H. Dikkopf-1 as a novel serologic and prognostic biomarker for lung and esophageal carcinomas. Cancer Res. 2007;67:2517-2525. [PubMed] |
| 14. | Mikheev AM, Mikheeva SA, Liu B, Cohen P, Zarbl H. A functional genomics approach for the identification of putative tumor suppressor genes: Dickkopf-1 as suppressor of HeLa cell transformation. Carcinogenesis. 2004;25:47-59. [PubMed] |
| 15. | Wang J, Shou J, Chen X. Dickkopf-1, an inhibitor of the Wnt signaling pathway, is induced by p53. Oncogene. 2000;19:1843-1848. [PubMed] |
| 16. | Yang G, Zhang G, Pittelkow MR, Ramoni M, Tsao H. Expression profiling of UVB response in melanocytes identifies a set of p53-target genes. J Invest Dermatol. 2006;126:2490-2506. [PubMed] |
| 17. | Gonzalez-Sancho JM, Aguilera O, Garcia JM, Pendas-Franco N, Pena C, Cal S, Garcia de Herreros A, Bonilla F, Munoz A. The Wnt antagonist DICKKOPF-1 gene is a downstream target of beta-catenin/TCF and is downregulated in human colon cancer. Oncogene. 2005;24:1098-1103. [PubMed] |
| 18. | Palozza P, Serini S, Maggiano N, Angelini M, Boninsegna A, Di Nicuolo F, Ranelletti FO, Calviello G. Induction of cell cycle arrest and apoptosis in human colon adenocarcinoma cell lines by beta-carotene through down-regulation of cyclin A and Bcl-2 family proteins. Carcinogenesis. 2002;23:11-18. [PubMed] |
| 19. | Mahyar-Roemer M, Kohler H, Roemer K. Role of Bax in resveratrol-induced apoptosis of colorectal carcinoma cells. BMC Cancer. 2002;2:27. [PubMed] |
| 20. | Paul-Samojedny M, Kokocinska D, Samojedny A, Mazurek U, Partyka R, Lorenz Z, Wilczok T. Expression of cell survival/death genes: Bcl-2 and Bax at the rate of colon cancer prognosis. Biochim Biophys Acta. 2005;1741:25-29. [PubMed] |
| 21. | Suraweera N, Robinson J, Volikos E, Guenther T, Talbot I, Tomlinson I, Silver A. Mutations within Wnt pathway genes in sporadic colorectal cancers and cell lines. Int J Cancer. 2006;119:1837-1842. [PubMed] |
| 22. | Mueller W, Lass U, Wellmann S, Kunitz F, von Deimling A. Mutation analysis of DKK1 and in vivo evidence of predominant p53-independent DKK1 function in gliomas. Acta Neuropathol (Berl). 2005;109:314-320. [PubMed] |