修回日期: 2007-12-21
接受日期: 2007-12-25
在线出版日期: 2008-01-08
目的: 本实验通过建立梗阻性黄疸大鼠实验模型, 检测不同时间段梗阻性黄疸大鼠及对照组大鼠肾脏中AQP-3的表达.
方法: 成年♂Wistar大鼠40只, 随机分为A、B、C、D四组(n = 10), A组为梗阻性黄疸7 d实验组、B组为A组对照组、C组为梗阻性黄疸14 d组、D组为C组对照组. 黄疸建立后7 d及14 d分别剖杀A、B、C和D组实验动物, Western blotting检测各组大鼠肾脏AQP-3的表达.
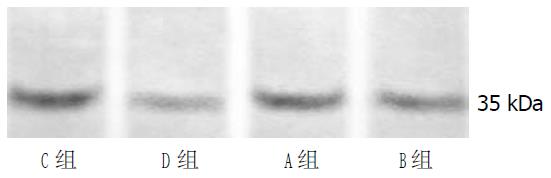
结果: 各组大鼠血清肌酐检测结果无差异; C、D组间血尿素氮检测有显著性差异(9.23±0.70 vs 8.22±0.43, P<0.05), 而其余各组间无差异; AQP-3表达在A与C组(t = 7.629, P = 0.000), C与D组(t = -13.159, P = 0.000), A与B组间(t = -2.310, P = 0.033)有显著性差异.
结论: 梗阻性黄疸14 d内血清肌酐可无明显变化; 梗阻性黄疸14 d时可出现尿素氮的轻度增高; 梗阻性黄疸时AQP-3表达减少, 并随着梗阻时间的延长, AQP-3有逐渐降低的趋势.
引文著录: 张德巍, 李云飞, 王勇, 王晟, 孟相真, 刘金钢. 梗阻性黄疸对大鼠肾脏AQP-3表达的影响. 世界华人消化杂志 2008; 16(1): 10-14
Revised: December 21, 2007
Accepted: December 25, 2007
Published online: January 8, 2008
AIM: To detect and analyze the expression of aquaporin-3 (AQP-3) in a model of rats with obstructive jaundice at different time periods.
METHODS: Forty adult male Wistar rats were selected for the experiment. All the rats were randomly divided into four groups of 10 rats each (groups A, B, C and D). Group A consisted of rats that had obstructive jaundice for 7 d. Group B was the control group for group A. Group C consisted of rats that had obstructive jaundice for 14 d. Group D was the control group for group C. All the experimental rats were killed respectively on day 7 or 14 after the experimental animal model of obstructive jaundice was established. Western blotting was used to detect the amount of AQP-3 in the kidneys.
RESULTS: There was no difference in CREA between each experimental group. The level of UREA differed between group C and D (9.23 ± 0.70 vs 8.22 ± 0.43, P < 0.05), whereas it did not differ between the other groups. The differences in AQP-3 between group A and C (t = 7.629, P = 0.000) and between group C and D (t = -13.159, P = 0.000) were significant (P < 0.01). The difference between group A and B was also significant (t = -2.310, P = 0.033).
CONCLUSION: There was no obvious change in CREA 14 d after the appearance of obstructive jaundice. UREA increased slightly 14 d after the appearance of obstructive jaundice. Expression of AQP-3 decreases in the early stage of obstructive jaundice, and it decreases slowly with the duration of obstructive jaundice.
- Citation: Zhang DW, Li YF, Wang Y, Wang S, Meng XZ, Liu JG. Renal aquaporin-3 expression in rats with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2008; 16(1): 10-14
- URL: https://www.wjgnet.com/1009-3079/full/v16/i1/10.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i1.10
梗阻性黄疸(obstructive jaundice, OJ)能导致急性肾功能衰竭(acute renal failure, ARF)[1]. 文献资料表明OJ导致ARF的发生率可达6%-18%, 其死亡率高达32%-100%[2]. OJ所导致ARF的病理特征是肾小管变性及坏死[3], 实验表明OJ时肾小管对水和钠重吸收功能障碍多先于肾血流的减少和肾小球滤过功能障碍, 尿液浓缩功能障碍是OJ并发肾损害的早期表现[4]. 1991年Agre et al[5]发现水通道蛋白(aquaporins, AQPs), 现已明确AQPs是肾脏重吸收水、浓缩尿液, 维持机体水平衡的主要分子基础. AQP-3不仅对水具有高度的通透性, 同时可调节尿素和甘油等小分子的代谢[6], 而尿素在尿液浓缩机制中起重要的作用. 通过对尿液中水通道蛋白的检测, 作到对肾功能改变的早期评定指标[7], 克服了目前作为肾功能检查的主要指标肌酐和尿素氮不能反映早期肾脏功能损伤的缺点.
清洁级♂Wistar大鼠40只, 体质量250-300 g, 中国医科大学实验动物中心提供, 经检疫合格, 实验前饲养7 d无疾病者入选. 鼠手术操作台, 灭菌手术器械, HITACHI冰箱, HITACHI7600全自动生化分析仪, 德国Heraus-Biofuge-PrimoR超速低温离心机, 日本岛津UV-260紫外分光光度计, 德国UP200H组织超声匀浆器, 美国BIO-RAD-PAC300型垂直电泳仪, 美国BIO-RAD MiniPROTEAN Ⅱ cell型垂直电泳槽, 上海天能公司Tanon小型转印电泳槽, 上海天能公司GIS-2020型凝胶扫描成像系统, AQP-3一抗, 二抗购自Santa Cruz公司.
1.2.1 分组: 采用摸球法将40只大鼠随机分成四组, 每组10只, A组为梗阻性黄疸7 d实验组、B组为假手术7 d对照组、C组为梗阻性黄疸14 d实验组、D组为假手术14 d对照组.
1.2.2 梗阻性黄疸大鼠模型的建立: 术前禁食12 h, 4 h禁水, 称量大鼠体质量, 30 mL/g ip 100 mL/L的水合氯醛麻醉大鼠, 麻醉生效后将大鼠固定于手术台上, 术区备皮、碘伏消毒和铺巾, 取正中切口1.5-2 cm入腹, 入腹后将肝缘用棉签推开即可暴露胆总管, 分离胆总管, 实验组丝线于胆总管下端双重结扎, 对照组大鼠分离胆总管后不结扎, 缝合关腹. 术后4 h后自由进水, 12 h后进食, 自由活动, 大鼠分笼饲养, 每日给予青霉素2万单位/100 g肌注, 连续3 d.
1.2.3 标本采集: 术后7 d及14 d取A、B组及C、D组大鼠终止动物实验, 麻醉后取腔静脉血5-8 mL, -20℃冰箱内保存, 待测生化指标即总胆红素(T-BIL)、直接胆红素(D-BIL)、血肌酐(CREA)和尿素氮(UREA), 大鼠左侧肾脏置于-80℃冰箱内保存, 待检测AQP-3.
1.2.4 AQP-3的检测(Western blot技术): 标本加入6倍体积的细胞裂解液A匀浆, 4℃ 17 500 g 离心90-120 min, 上清为胞质蛋白样品. 沉淀(膜的成份)加入1 mL细胞裂解液B在冰水中匀浆, 超声粉碎20 s, 间隔20 s, 2-3次, 静置4℃过夜后, 4℃ 17 500 g离心为90 min, 取上清为胞膜蛋白样品. Lorry法蛋白定量: 各取样品50 μL蛋白定量, 以浓度最低管为基准, 调节蛋白浓度, 加5×样品缓冲液, 煮沸3-5 min, 按顺序过胶、转膜、扫描.
统计学处理 应用SPSS11.0统计软件包处理. 数据采用mean±SD表示, 应用独立样本t检验, P<0.05有显著性差异.
A组与B组、C组与D组间大鼠T-BIL和D-BIL有显著性差异(P<0.01), 假手术组间无差异, 证实梗阻性黄疸模型建立(表1).
| A组 | B组 | t | P | C组 | D组 | t | P | |
| T-BIL | 70.93±7.55 | 4.64±1.55 | 27.209 | 0.000 | 96.00±14.35 | 3.77±1.01 | 20.268 | 0.000 |
| D-BIL | 53.93±7.81 | 4.07±1.43 | 19.847 | 0.000 | 73.82±11.90 | 3.26±1.00 | 18.683 | 0.000 |
| CREA | 27.30±11.85 | 24.20±3.49 | 0.793 | 0.438 | 29.20±8.40 | 24.20±4.44 | 1.663 | 0.114 |
| UREA | 7.80±0.81 | 8.04±0.28 | -0.885 | 0.388 | 9.23±0.70 | 8.22±0.43 | 3.870 | 0.0011 |
各组大鼠CREA检测结果无差异; 14 d实验组与对照组UREA检测有显著性差异, 而其余各组间无差异(表1).
OJ导致肾脏损害的确切机制尚不完全清楚, 其发生可能与内毒素血症, 胆红素和胆酸毒性, 肿瘤坏死因子, 血管活性物质、血容量减少、水盐代谢紊乱和肾脏再灌注损伤等多方面因素有关[1,8-11].
1991年Agre et al[5]在分离非洲爪蟾卵母细胞Rh蛋白时发现一种具有将细胞外水转运到细胞内的蛋白质, 将其命名为AQPs. 随后发现10余种AQPs, 其中分布于肾脏的有AQP0、1、2、3、4、6、7、8等八种. 现已明确AQPs是肾脏重吸收水、浓缩尿液, 从而维持机体水平衡的主要分子基础, 在肾脏功能损伤的早期多伴随着不同程度的水通道蛋白表达的变化[12]. AQP-3主要分布于集合管上皮主细胞基侧质膜, 除对水通透性外还可转运非离子的小分子物质(如尿素和甘油等)[13], 而尿素在尿的浓缩机制中有着重要意义[14]. 尿素在AQP-3参与下逆渗透压梯度差被重吸收, 小管液中尿素的量增加, 是形成逆流倍增现象的基础, 故AQP-3在尿的浓缩中起重要作用. 敲除大鼠肾脏中的AQP-3[15], 其饮水量和尿量增加12倍以上, 表现为严重的尿崩症, 大鼠表现为多饮、多尿、钠排出增多、尿渗透压降低. 另一方面, AQP-3可改变Na-K泵、其他AQPs及Na-K ATP酶活性, 增强对原尿中的水及离子的重吸收[16]. AQP-3受精氨酸抗利尿激素的调节, 精氨酸抗利尿激素可使AQP-3表达上调, 从而促进对水、钠的重吸收[17].
本实验中, 梗阻性黄疸时肾脏AQP-3表达明显下调, 且这种表达下调随着梗阻时间延长进行性加重. 目前就梗阻性黄疸时AQP-3表达变化的研究尚未见确切报道, 但药物、失血性休克等因素引起的急、慢性肾功能衰竭及肾脏缺血再灌注损伤中肾脏AQP-3表达均表现为明显下调[18-21]. 实验研究认为肿瘤坏死因子、内皮素、前列腺素、血栓素、血管紧张素、一氧化氮等细胞因子对于肾脏集合管主细胞的直接损伤可以导致AQPs表达的下调[22-27]. 而在梗阻性黄疸时肾脏的损伤因素更加复杂. 首先, OJ时肠黏膜屏障受损、细菌细菌易位明显增加[9]导致内毒素血症, OJ动物模型[28]和大多数OJ患者都存在明显的内毒素血症, 而肾脏又是内毒素的敏感靶器官, 内毒素的肾脏损害不言而喻. 其次、OJ时胆汁排出受阻, 胆管内压升高, 当压力超过3.43 kPa则导致胆汁逆流入血引起高胆红素血症, 一方面胆红素及胆酸血症直接作用使Kupffer细胞数量减少、活性抑制, 导致网状内皮系统功能低下, 全身免疫系统功能抑制, 增强了内毒素的作用. 另一方面, 胆红素可在肾小管细胞内滞留, 当其浓度增高时可抑制线粒体内呼吸链的电子传递过程[1], 使氧化和磷酸化的偶联作用解除, 对肾小管细胞具有毒性, 并使肾小管细胞呼吸速度减慢, 造成细胞缺氧, 使肾脏功能和结构受损, 加重肾损害. 实验表明淤胆性肝硬化大鼠集合管基底侧壁AQP-3的表达较明显低于对照组[29], 说明梗阻性黄疸时肾脏AQP-3表达的变化规律. 最后, OJ同时存在着肾缺血以及肾再灌流恢复的两方面因素[10], 具备了肾脏再灌注损伤的产生的条件. 免疫电泳和免疫细胞化学显示肾脏再灌注损伤时AQP-3的表达明显下调, 而AQP-3的表达的下调是肾脏再灌注损伤时尿重吸收功能减退、钠的重吸收降低, 尿量增多、尿钠排出增加等表现的分子学基础[20].
研究梗阻性黄疸时大鼠肾脏AQP-3及AQP-3 mRNA表达的意义不仅在于揭示梗阻性黄疸时肾脏AQP-3及AQP-3 mRNA的变化规律, 而且, 因为大鼠和人的AQP cDNA及人类AQP家族其他成员cDNA有高度同源性[30]. 我们可以通过研究梗阻性黄疸大鼠肾AQP-3的变化推断人类梗阻性黄疸时水通道蛋白3的变化. 本实验显示梗阻性黄疸早期(7 d内)大鼠肌酐、尿素氮无明显变化, 而此时实验组大鼠肾脏AQP-3及AQP-3 mRNA与对照组间有十分显著性差异, 说明肾脏中AQP-3及AQP-3 mRNA的变化较传统的肌酐、尿素氮等肾功能指标出现早, 鉴于AQPs按肾脏中AQPs含量的一定比率分泌至尿液中排泄, 目前尿液中AQPs的测定已是成熟的技术. 我们可以通过测定尿液中AQPs的含量, 推测肾脏中AQPs的含量, 如果其可作为检测肾脏尿液浓缩功能的指标, 无疑有助于提高OJ时肾功能损害的早期诊断率. 早期对OJ患者施加一些治疗手段, 这可减少或防止OJ时发生ARF.
梗阻性黄疸导致肾脏损害的确切机制尚不完全清楚, 其发生可能与内毒素血症, 胆红素和胆酸毒性, 肿瘤坏死因子, 血管活性物质、血容量减少, 水盐代谢紊乱等多方面因素有关. 随着对水通道蛋白的发现及对其研究的不断深入, 人们渴望在分子水平上对梗阻性黄疸时发生急性肾功能衰竭的机制加以诠释.
1988年Ager et al发现AQP以来, 随着人们对AQP的逐渐深入, 现对尿崩症, 泌尿系梗阻、糖尿病等引起的ARF研究较为深入, 但对OJ导致的ARF的研究仍处于起步阶段. 而对AQP-3的研究却只局限于失血性休克、肾脏再灌注损伤及胆总管结扎对其在肾脏中表达的影响上.
研究OJ时大鼠肾脏AQP-3表达的意义不仅在于揭示OJ时肾脏AQP-3的变化规律, 而且可以通过研究OJ大鼠肾脏AQP-3的变化推断人类OJ时AQP-3的变化. 鉴于AQPs按肾脏中AQPs含量的一定比率分泌至尿液中排泄, 可以通过测定尿液中AQPs的含量, 推测肾脏中AQPs的含量, 如果其可作为检测肾脏尿液浓缩功能的指标, 无疑有助于提高OJ时肾功能损害的早期诊断率. 早期对OJ患者施加一些治疗手段, 减少或防止OJ时发生ARF.
本文立题新颖, 设计合理. 科学性较强, 具有一定的学术价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Fogarty BJ, Parks RW, Rowlands BJ, Diamond T. Renal dysfunction in obstructive jaundice. Br J Surg. 1995;82:877-884. [PubMed] |
| 2. | Ingoldby CJ, McPherson GA, Blumgart LH. Endotoxemia in human obstructive jaundice. Effect of polymyxin B. Am J Surg. 1984;147:766-771. [PubMed] |
| 3. | Kaler B, Karram T, Morgan WA, Bach PH, Yousef IM, Bomzon A. Are bile acids involved in the renal dysfunction of obstructive jaundice? An experimental study in bile duct ligated rats. Ren Fail. 2004;26:507-516. [PubMed] |
| 5. | Agre P, Preston GM, Smith BL, Jung JS, Raina S, Moon C, Guggino WB, Nielsen S. Aquaporin CHIP: the archetypal molecular water channel. Am J Physiol. 1993;265:F463-F476. [PubMed] |
| 6. | Hatakeyama S, Yoshida Y, Tani T, Koyama Y, Nihei K, Ohshiro K, Kamiie JI, Yaoita E, Suda T, Hatakeyama K. Cloning of a new aquaporin (AQP10) abundantly expressed in duodenum and jejunum. Biochem Biophys Res Commun. 2001;287:814-819. [PubMed] |
| 7. | Rai T, Sekine K, Kanno K, Hata K, Miura M, Mizushima A, Marumo F, Sasaki S. Urinary excretion of aquaporin-2 water channel protein in human and rat. J Am Soc Nephrol. 1997;8:1357-1362. [PubMed] |
| 8. | Uslu A, Cayci M, Nart A, Karaca C, Zalluhoglu N, Gürkan A, Varilsuha C, Adagülü H. Renal failure in obstructive jaundice. Hepatogastroenterology. 2005;52:52-54. [PubMed] |
| 10. | Yüceyar S, Gümüştaş K, Ertürk S, Hamzaoğlu IH, Uygun N, Ayaz M, Cengiz A, Kafadar Y. The role of oxygen free radicals in acute renal failure complicating obstructive jaundice: an experimental study. HPB Surg. 1998;10:387-393. [PubMed] |
| 11. | Padillo FJ, Cruz A, Briceño J, Martin-Malo A, Pera-Madrazo C, Sitges-Serra A. Multivariate analysis of factors associated with renal dysfunction in patients with obstructive jaundice. Br J Surg. 2005;92:1388-1392. [PubMed] |
| 12. | Jung JS, Lee RH, Koh SH, Kim YK. Changes in expression of sodium cotransporters and aquaporin-2 during ischemia- reperfusion injury in rabbit kidney. Ren Fail. 2000;22:407-421. [PubMed] |
| 13. | Mobasheri A, Wray S, Marples D. Distribution of AQP2 and AQP3 water channels in human tissue microarrays. J Mol Histol. 2005;36:1-14. [PubMed] |
| 14. | Ohshiro K, Yaoita E, Yoshida Y, Fujinaka H, Matsuki A, Kamiie J, Kovalenko P, Yamamoto T. Expression and immunolocalization of AQP6 in intercalated cells of the rat kidney collecting duct. Arch Histol Cytol. 2001;64:329-338. [PubMed] |
| 15. | Combet S, Geffroy N, Berthonaud V, Dick B, Teillet L, Verbavatz JM, Corman B, Trinh-Trang-Tan MM. Correction of age- related polyuria by dDAVP: molecular analysis of aquaporins and urea transporters. Am J Physiol Renal Physiol. 2003;284:F199-F208. [PubMed] |
| 16. | Kim SW, Gresz V, Rojek A, Wang W, Verkman AS, Frøkiaer J, Nielsen S. Decreased expression of AQP2 and AQP4 water channels and Na,K-ATPase in kidney collecting duct in AQP3 null mice. Biol Cell. 2005;97:765-778. [PubMed] |
| 17. | Dibas AI, Mia AJ, Yorio T. Aquaporins (water channels): role in vasopressin-activated water transport. Proc Soc Exp Biol Med. 1998;219:183-199. [PubMed] |
| 18. | Leung JC, Chan LY, Tsang AW, Tang SC, Lai KN. Differential expression of aquaporins in the kidneys of streptozotocin- induced diabetic mice. Nephrology (Carlton). 2005;10:63-72. [PubMed] |
| 19. | Gong H, Wang W, Kwon TH, Jonassen T, Frøkiaer J, Nielsen S. Reduced renal expression of AQP2, p-AQP2 and AQP3 in haemorrhagic shock-induced acute renal failure. Nephrol Dial Transplant. 2003;18:2551-2559. [PubMed] |
| 20. | Fernandez-Llama P, Andrews P, Turner R, Saggi S, Dimari J, Kwon TH, Nielsen S, Safirstein R, Knepper MA. Decreased abundance of collecting duct aquaporins in post-ischemic renal failure in rats. J Am Soc Nephrol. 1999;10:1658-1668. [PubMed] |
| 21. | Spector DA, Wade JB, Dillow R, Steplock DA, Weinman EJ. Expression, localization, and regulation of aquaporin-1 to -3 in rat urothelia. Am J Physiol Renal Physiol. 2002;282:F1034-F1042. [PubMed] |
| 22. | Fasshauer M, Klein J, Lossner U, Klier M, Kralisch S, Paschke R. Suppression of aquaporin adipose gene expression by isoproterenol, TNFalpha, and dexamethasone. Horm Metab Res. 2003;35:222-227. [PubMed] |
| 23. | Ge Y, Ahn D, Stricklett PK, Hughes AK, Yanagisawa M, Verbalis JG, Kohan DE. Collecting duct-specific knockout of endothelin-1 alters vasopressin regulation of urine osmolality. Am J Physiol Renal Physiol. 2005;288:F912-F920. [PubMed] |
| 24. | Nejsum LN, Zelenina M, Aperia A, Frøkiaer J, Nielsen S. Bidirectional regulation of AQP2 trafficking and recycling: involvement of AQP2-S256 phosphorylation. Am J Physiol Renal Physiol. 2005;288:F930-F938. [PubMed] |
| 25. | Murer L, Addabbo F, Carmosino M, Procino G, Tamma G, Montini G, Rigamonti W, Zucchetta P, Della Vella M, Venturini A. Selective decrease in urinary aquaporin 2 and increase in prostaglandin E2 excretion is associated with postobstructive polyuria in human congenital hydronephrosis. J Am Soc Nephrol. 2004;15:2705-2712. [PubMed] |
| 26. | Devuyst O, Combet S, Cnops Y, Stoenoiu MS. Regulation of NO synthase isoforms in the peritoneum: implications for ultrafiltration failure in peritoneal dialysis. Nephrol Dial Transplant. 2001;16:675-678. [PubMed] |
| 27. | Nørregaard R, Jensen BL, Li C, Wang W, Knepper MA, Nielsen S, Frøkiaer J. COX-2 inhibition prevents downregulation of key renal water and sodium transport proteins in response to bilateral ureteral obstruction. Am J Physiol Renal Physiol. 2005;289:F322-F333. [PubMed] |
| 28. | Papakostas C, Bezirtzoglou E, Pitiakoudis M, Polychronidis A, Simopoulos C. Endotoxinemia in the portal and the systemic circulation in obstructive jaundice. Clin Exp Med. 2003;3:124-128. [PubMed] |
| 29. | Fernandez-Llama P, Turner R, Dibona G, Knepper MA. Renal expression of aquaporins in liver cirrhosis induced by chronic common bile duct ligation in rats. J Am Soc Nephrol. 1999;10:1950-1957. [PubMed] |