修回日期: 2006-11-22
接受日期: 2006-12-01
在线出版日期: 2007-03-28
目的: 探讨过氧化物酶体增殖剂激活受体-γ (PPAR-γ)在白藜芦醇(Res)抑制人胃癌细胞SGC-7901增殖中的作用.
方法: 体外常规培养人胃癌细胞SGC-7901, MTT法检测Res和GW9662(PPAR-γ特异阻断剂)对SGC-7901细胞的增殖抑制作用, 流式细胞仪测定对细胞周期的影响, RT-PCR方法检测PPAR-γ, Cyclin D1的mRNA表达, Western blot检测PPAR-γ蛋白的表达, 免疫细胞化学检测Cyclin D1蛋白表达的改变.
结果: Res以时间、浓度依赖性方式抑制胃癌细胞SGC-7901的增殖(P<0.05), 使细胞周期停留在G1期; 胃癌细胞SGC-7901存在PPAR-γ mRNA和蛋白的表达, Res呈浓度依赖性的激活PPAR-γ mRNA的转录. 25, 50, 75, 100 mmol/L Res作用于胃癌细胞后, 细胞中PPAR-γ mRNA相对表达分别是空白对照组的122.2%, 195.1%, 232.9%和277.1%(P<0.05), 而PPAR-γ蛋白的表达几乎没有变化; 胃癌SGC-7901细胞高水平表达Cyclin D1, Res显著的抑制Cyclin D1的表达. 经25, 50, 75, 100 mmol/L Res处理后, Cyclin D1 mRNA抑制率分别为11.3%, 24.3%, 35.4%, 59.5%, 而GW9662能够明显降低Res的上述作用.
结论: Res在胃癌SGC-7901细胞中部分的通过激活PPAR-γ从而抑制Cyclin D1的表达, 使癌细胞停留在G1期, 抑制细胞的增殖.
引文著录: 胡光胜, 曹文涛, 廖爱军, 曾斌, 廖丹, 石巍. 过氧化物酶体增殖剂激活受体-γ在白藜芦醇抑制胃癌SGC-7901细胞增殖中的作用. 世界华人消化杂志 2007; 15(9): 941-946
Revised: November 22, 2006
Accepted: December 1, 2006
Published online: March 28, 2007
AIM: To investigate the role of peroxisome proliferator-activated receptor-γ (PPAR-γ) in the inhibitory effects of resveratrol (Res) on gastric cancer cell SGC-7901 proliferation in vitro.
METHODS: After human gastric cancer cell SGC-7901 was cultured in vitro, MTT assay was used to detect the inhibitory effect of Res and GW9662 (specific blocker of PPAR-γ) on cell proliferation. Flow cytometry was used to detect cell cycle, and PPAR-γ, Cyclin D1 mRNA was measured quantitatively by reverse transcription-polymerase chain reaction (RT-PCR). The expression of PPAR-γ protein was measured quantitatively by Western blot, and the expression of Cyclin D1 protein in gastric cancer cells was detected by immunohistochemistry.
RESULTS: Res inhibited the proliferation of SGC-7901 cells in a dose- and time-dependent manner (P < 0.05), and flow cytometry analysis revealed that the cell cycle was blocked at G1-phase. RT-PCR and Western blot showed that both PPAR-γ mRNA and protein were expressed in SGC-7901 cells, and Res enhanced PPAR-γ mRNA expression. After SGC-7901 cells were treated by Res with the concentration of 25, 50, 75 and 100 μmol/L, the relative percentages of PPAR-γ mRNA expression were 122.2%, 195.1%, 232.9% and 277.1% of those in the controls (P < 0.05), but the expression of PPAR-γ protein didn't changed. The high levels of Cyclin D1 mRNA and protein expression were detected in SGC-7901 cells, while Res significantly decreased the expression of Cyclin D1. After SGC-7901 cells were treated by Res with the concentration of 25, 50, 75 and 100 mmol/L, the inhibitory rates of Cyclin D1 mRNA were 11.3%, 24.3%, 35.4% and 59.5%, respectively, while GW9662 markedly decreased the above effects of Res.
CONCLUSION: Res can significantly inhibit Cyclin D1 expression partly by activating PPAR-γ in gastric cancer cells SGC-7901, which results in the blockage of cell cycle at G1 phase and inhibition of cell proliferation.
- Citation: Hu GS, Cao WT, Liao AJ, Zeng B, Liao D, Shi W. Role of peroxisome proliferator-activated receptor-γ in resveatrol-induced proliferation inhibition of gastric cancer cell line SGC-7901. Shijie Huaren Xiaohua Zazhi 2007; 15(9): 941-946
- URL: https://www.wjgnet.com/1009-3079/full/v15/i9/941.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i9.941
白藜芦醇(resveratrol, Res)是广泛地存在于葡萄、花生和多种药用植物中的一种多酚类化合物, 目前至少已经在21个科、31个属的72种植物中发现了Res. 早期的研究发现, Res具有保护心血管、调节血脂、抗病原微生物、护肝等多种生物学作用. 自从Jang et al[1]于1997年系统地报道了Res的抗肿瘤作用后, 迄今发现他能抑制多种癌细胞的生长, 包括胃癌、肠癌、乳腺癌、白血病等, 但其作用机制仍未明确[2]. 本实验以胃癌SGC-7901细胞为靶细胞, 研究Res影响肿瘤细胞增殖的机制.
Res购自Sigma公司, 用DMSO配成10 mmol/L -20 ℃贮存备用. 甲氮甲唑蓝(MTT)、GW9662(PPAR-γ特异阻断剂)为Sigma产品, RPMI1640培养基, 美国Gibco公司产品, 新生牛血清为杭州四季青公司产品. RNA提取试剂盒、MMLV逆转录试剂盒、PCR试剂盒均购自上海生工生物公司. 山羊抗人actin多克隆抗体、山羊抗人过氧化物酶体增长因子活化受体γ(peroxisome proliferators-activated receptor-gamma, PPAR-γ)多克隆抗体及ECL显影剂(美国Santa Cruz公司). Cyclin D1小鼠mAb为博士德公司产品. SP试剂盒及DAB试剂均购自北京中杉试剂有限公司. 人胃癌SGC-7901细胞株购自中科院上海细胞所, 培养于含100 mL/L新生牛血清的RPMI1640培养液中, 加入1×105 U/L青霉素, 100 mg/L链霉素, 置于孵箱, 在37 ℃, 50 mL/L CO2饱和湿度的条件下培养, 实验时取对数生长期细胞.
1.2.1 MTT: 检测胃癌细胞的增殖: 收集细胞, 将细胞重新接种至96孔板中, 使其每孔细胞数为1×103-1×104个, 分别以不同终浓度的GW9662和或Res的RPMI1640培养液100 µL作用细胞, 对照组和调零组加100 µL完全培养基, 每组设6个平行孔, 实验时间后, 加5 g/L MTT 20 µL/孔(调零组除外), 再培养4 h, 然后吸去上清液, 每孔加入150 µL DMSO溶解样品, 用酶联免疫检测仪测定各孔490 nm吸光度值. 按公式计算药物对细胞生长抑制率(IR): IR(%) = (1-试验孔A均值/对照孔A均值)×100%.
1.2.2 细胞周期的测定: 收集培养48 h后的对照组和实验组的细胞, 用体积分数为750 mL/L的乙醇固定, 经0.5 g/L的RnaseA消化30 min, 终浓度65 mg/L的碘化丙锭(propidium iodidu, PI)染色1 h后流式细胞仪(型号为FACS420)测定细胞周期.
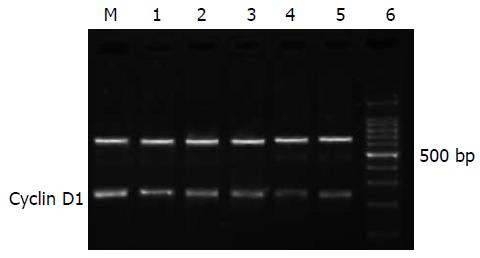
1.2.3 半定量RT-PCR检测PPAR-γ, Cyclin D1的mRNA表达: 采用RNA提取试剂盒提取总RNA, 获得的RNA按MMLV第一链cDNA合成试剂盒说明书合成cDNA. PCR引物用Primer 5.0搜索, 由上海生物工程技术有限公司合成. PPAR-γ的上游引物为: 5'-TGTGAAGCCCATTGAAGACA-3', 下游引物为: 5'-GAGCGGGTGAAGACTCATGT-3', 扩增产物为199 bp, Tm 53 ℃; Cyclin D1的上游引物为: 5'-GAGGCGGAGGAGAACAAACA-3', 下游引物为: 5'-GAAGCGTGTGAGGCGGTAG-3', 扩增产物为189 bp, Tm 59 ℃. 内参GAPDH上游引物为: 5'-GTGGACATCCGCAAAGAC-3'; 下游引物为: 5'-TCAACGCAATGTGGGAAAG-3'; 扩增产物为697 bp, Tm 56 ℃. 扩增产物进行15 g/L琼脂糖凝胶电泳, 采用凝胶成像系统做积分A值测定, 以各组PPAR-γ, Cyclin D1与GAPDH的A值的比值表示相对表达量.
1.2.4 Western blot检测PPAR-γ蛋白的表达: 提取总蛋白并按PIERCE BCA蛋白定量试剂盒说明书操作, 取细胞溶解液蛋白50 mg在80 g/L的SDS聚丙烯酰胺凝胶上电泳后, 冰上恒压100 V电转1 h, 蛋白转至PVDF膜上, 加入1:200稀释的兔抗鼠PPAR-γ抗体, 4 ℃过夜. TBST漂洗后加入1:400生物素化的羊抗兔二抗, 室温下摇床杂交1 h. TBST漂洗后以ECL化学发光底物系统放射自显影. 以相同方法测定内参照β-actin的表达. PPAR-γ相对分子质量55000, β-actin相对分子质量42000. 通过Bandscan 510软件进行灰度测定, PPAR-γ的表达水平以PPAR-γ灰度值与β-actin灰度值的相对值(相对灰度值) 表示.
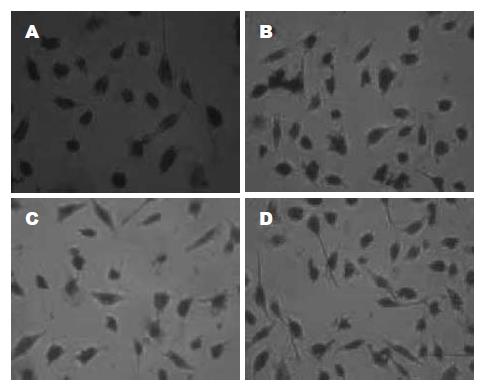
1.2.5 免疫细胞化学法检测Cyclin D1蛋白表达: 将盖玻片分别置于各处理组的细胞培养液中, 待细胞爬片后取出固定, 固定的细胞片按照SP试剂盒说明操作, 胞质及胞核呈棕黄色颗粒者视为免疫阳性细胞.
统计学处理 计量资料用mean±SD表示, 采用SPSS11.0统计分析软件进行分析. P<0.05为差异有显著性.
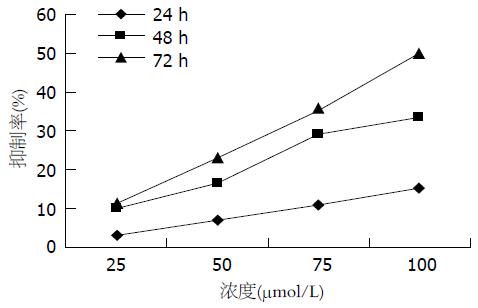
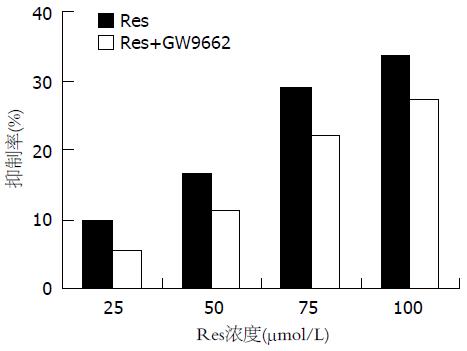
Res以时间、浓度依赖性方式抑制胃癌SGC-7901细胞的生长, 作用72 h抑制率最高达49.8%, 最低达11.2%(图1); 但在48 h以相同浓度的Res加上GW9662 10 mmol/L干预胃癌SGC-7901细胞时, 其抑制率比同浓度的Res低(P<0.05)(图2).
不同浓度Res抑制胃癌SGC-7901细胞的生长, 使细胞停滞在G1期. 加药48 h结果如表1所示.
| 分组 | G0/G1 | S | G2/M |
| 对照组 | 40.7 | 48.7 | 10.6 |
| 50 μmol/L Res | 52.5 | 36.4 | 11.1 |
| 100 μmol/L Res | 67.4 | 25.1 | 7.5 |
| 100 μmol/L Res+10 μmol/L GW9662 | 63.4 | 28.1 | 8.6 |
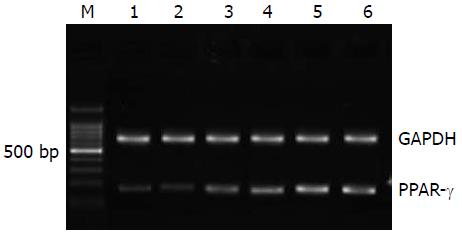
Res能明显激活胃癌细胞中PPAR-γ mRNA表达. 经过25, 50, 75, 100 mmol/L Res作用于胃癌细胞48 h后, 细胞中PPAR-γ mRNA相对表达分别是空白对照组的122.2%, 195.1%, 232.9%和277.1%(P<0.05), 而GW9662 10 mmol/L+100 mmol/L Res处理的胃癌细胞PPAR-γ mRNA相对表达是空白对照组的261.1%, 与同浓度的Res处理组相比(P<0.05) (图3).
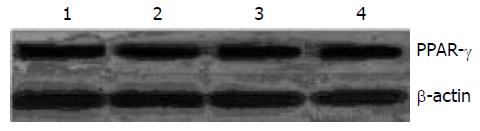
经50, 100 mmol/L Res及GW9662 10 mmol/L+100 mmol/L Res处理胃癌细胞后, 其PPAR-γ蛋白表达的相对灰度值为(0.39733±0.00603), (0.39800±0.00265), (0.39333±0.00603), 与未加药物处理胃癌细胞的相对灰度值(0.39067±0.00404)相比, P>0.05(图4).
未加药物处理的对照组胃癌SGC-7901细胞高水平表达Cyclin D1 mRNA, 经25, 50, 75, 100 mmol/L Res处理48 h后, Cyclin D1 mRNA的电泳条带亮度比对照组的暗(P<0.05), 随着浓度的增加, 条带亮度越暗, 其抑制率分别为11.3%, 24.3%, 35.4%, 59.5%; 而同时使用PPAR-γ抑制剂GW9662和Res处理的胃癌细胞Cyclin D1 mRNA生成的抑制作用明显下降, 其抑制率为40.7%, 与同浓度的Res处理组相比(P<0.05)(图5).
用50, 100 μmol/L Res处理胃癌SGC-7901细胞48 h后, 免疫组化图片结果显示, 空白对照组染色较强, 胞质及胞核可见均匀的棕黄色颗粒; 而处理组细胞Cyclin D1蛋白表达水平与对照组比较明显下降; 加用PPAR-γ抑制剂GW9662的处理组, Cyclin D1蛋白表达与同浓度的Res处理组相比要多(图6).
PPAR-γ是一类由配体激活的核转录因子, 为核激素受体超家族中的成员. PPAR-γ转录后调控作用依赖于与其配体的结合, 当其被配体激活后, 常与视黄酸X受体(retinoid X receptor, RXR)或糖皮质激素受体结合形成异二聚体后, 再与位于其上游的靶基因的特异性DNA序列过氧化物酶体增殖物反应元件(peroxisome proliferator responsive element, PPRE)结合, 使靶基因活化, 而发挥其转录后调控作用. PPAR-γ的表达具有组织特异性, 主要在脂肪细胞内表达, 在调节脂肪细胞的分化方面起重要作用. 近年来研究表明PPAR-γ以失活状态在多种肿瘤中高表达, 同时大量文献证实PPAR-γ配体可以通过激活PPAR-γ而发挥潜在的抗肿瘤作用[3-5].
Res是一种多酚类化合物, 通过抗氧化、抗自由基及抗突变; 干扰信号传导通路; 抑制与肿瘤发生有关的酶等途径对肿瘤的起始、促进、发展三个阶段均有抑制作用[1-2], 但是其作用机制还不是很清楚. 近来, 研究者发现Res能够结合配体激活的转录因子受体PPAR-γ. Inoue et al[6]通过体内外实验表明了Res在小鼠重要皮质区、牛脑微血管内皮细胞、人的脐静脉内皮细胞和牛的动脉内皮细胞中呈剂量依赖性地活化核受体PPAR-γ. 在鼠的脂肪细胞中, Picard et al[7]研究发现Res通过激活氧化物酶体增生物激活受体PPAR-γ诱导甘油三脂的脂解和脂肪酸动员. 我国学者葛恒et al[8]也发现在自身不表达PPAR-γ蛋白的人类组织细胞淋巴瘤U937细胞中电穿孔共转染PPAR-γ表达质粒和其报告质粒, 从而构建PPAR-γ激动剂筛选模型, 同时在U937细胞内单独转染PPAR-γ报告质粒作为阴性对照, 发现Res能够剂量依赖的激动PPAR-γ. 最近, Ricketts et al[9]研究发现Res在肾脏内皮细胞株CV-1及大量的血管内皮细胞中剂量依赖性地激活核受体PPAR-γ. 在胃癌中, Sato et al[10]研究发现在高、中、低分化的人类胃癌细胞株中PPAR-γ均呈高表达, PPAR-γ激动剂对胃癌细胞的增殖呈剂量依赖性抑制效应. 根据以上研究, 我们假设Res可以通过激活PPAR-γ抑制胃癌细胞的增殖. 研究发现Res以时间、浓度依赖性方式抑制胃癌SGC-7901细胞的生长; 但以相同浓度的Res加上PPAR-γ特异的抑制剂GW9662干预胃癌SGC-7901细胞时, 其抑制率比同浓度的Res低; 细胞周期分析表明: 用药组细胞G1期增大, S期减小, 而加用PPAR-γ特异的抑制剂GW9662处理组具有一定的逆转作用, 说明Res部分地通过PPAR-γ途径抑制胃癌细胞的生长. 为了进一步证明PPAR-γ在Res抗增殖的作用, 我们用RT-PCR和Western blot检测PPAR-γ mRNA和蛋白的表达变化, 发现Res呈浓度依赖性地激活PPAR-γ mRNA的转录, 特异的PPAR-γ抑制剂GW9662能够阻止Res对PPAR-γ mRNA的激活; 而加药处理组及对照组PPAR-γ蛋白的表达几乎没有变化, 有研究表明被JNK和/或ERK磷酸化的PPAR-γ蛋白无生物活性[11-12], 而Res可以阻断JNK和/或ERK的信号传导途径[13], 在本实验中可能是Res使PPAR-γ蛋白去磷酸化而恢复了PPAR-γ活性, 从而调节下游基因的转录, 抑制胃癌SGC-7901细胞的生长.
本实验流式细胞术检测发现Res作用于胃癌SGC-7901细胞后G1期比例增加, S期下降, G2期基本上没有什么变化. Cyclin D1是细胞周期G1期的重要调节因子, 越来越多的研究表明, Cyclin D1的过表达加速细胞从G1-S期转变过程, 最终形成肿瘤[14-15]. 以前的研究证明, Res可以抑制Cyclin D1的表达, 从而阻止肿瘤细胞的增殖, 但是其机制还不清楚[16]. 本实验研究发现, Cyclin D1在胃癌SGC-7901细胞中高表达, Res以剂量依赖性的方式抑制Cyclin D1的翻译和转录, 而加用PPAR-γ特异的抑制剂GW9662的处理组其抑制作用减弱, 以上说明, Res部分的通过激活PPAR-γ抑制Cyclin D1的表达, 从而使胃癌SGC-7901细胞停留在G1期, 抑制其增殖. 也有研究认为Cyclin D1的过度表达竞争性抑制PPAR-γ功能, 抑制Cyclin D1的过度表达可以恢复PPAR-γ活性, 其两者存在什么样的关系需要进一步的研究.
总之, Res在胃癌SGC-7901细胞中部分的通过激活PPAR-γ抑制Cyclin D1的表达, 使癌细胞停留在G1期, 抑制细胞的增殖. Res是通过何种机制激活PPAR-γ的表达, 恢复PPAR-γ的活性, 是否通过激活PPAR-γ具有广泛的抗癌作用, 还有待于进一步研究.
白藜芦醇抗肿瘤作用机制研究热点主要集中在其可能经过诱导肿瘤细胞凋亡, 干预细胞周期, 抑制增殖; 抗氧化、抗自由基及抗突变; 干扰信号传导通路; 抑制与肿瘤发生有关的酶等途径相关. 近年来研究表明PPAR-γ以失活状态在多种肿瘤中高表达, 同时大量文献证实PPAR-γ配体可以通过激活PPAR-γ而发挥潜在的抗肿瘤作用, 对白藜芦醇抗肿瘤是否与PPAR-γ相关进行初步的研究, 有望为白藜芦醇的临床应用提供新的理论依据.
近来, 大量研究发现白藜芦醇在非肿瘤细胞中能够激活核转录因子PPAR-γ, 这些都表明白藜芦醇是PPAR-γ的天然配体激活剂. Satoetal研究发现在高、中、低分化的人类胃癌细胞株中PPAR-γ均呈高表达, PPAR-γ激动剂对胃癌细胞的增殖呈剂量依赖性抑制效应.
研究白藜芦醇对胃癌细胞增殖的影响, 白藜芦醇对PPAR-γ基因及对PPAR-γ下游基因CyclinD1在防治胃癌中起到的作用, 探讨白藜芦醇抗癌的分子机制, 为流行病学和临床应用白藜芦醇作为肿瘤预防提供理论基础.
过氧化物酶体增长因子活化受体γ(PPAR-γ): 是一类由配体激活的核转录因子, 为核激素受体超家族中的成员之一;
细胞周期素D1(CyclinD1): 是细胞周期G1期的重要调节因子, CyclinD1的过表达加速细胞从G1-S期转变过程, 促使肿瘤的形成.
本文研究了PPAR-γ在白藜芦醇抑制胃癌SGC-7901细胞增殖的作用, 结果发现白藜芦醇通过激活PPAR-γ抑制CyclinD1的表达, 使癌细胞停留在G1期, 抑制细胞的增殖, 对于揭示白藜芦醇的抗癌机制有重要意义. 文章内容丰富, 论述充分且比较全面.
编辑: 张焕兰 电编:张敏
| 1. | Jang M, Cai L, Udeani GO, Slowing KV, Thomas CF, Beecher CW, Fong HH, Farnsworth NR, Kinghorn AD, Mehta RG. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science. 1997;275:218-220. [PubMed] [DOI] |
| 2. | Delmas D, Lançon A, Colin D, Jannin B, Latruffe N. Resveratrol as a chemopreventive agent: a promising molecule for fighting cancer. Curr Drug Targets. 2006;7:423-442. [PubMed] [DOI] |
| 3. | Ray DM, Bernstein SH, Phipps RP. Human multiple myeloma cells express peroxisome proliferator-activated receptor gamma and undergo apoptosis upon exposure to PPARgamma ligands. Clin Immunol. 2004;113:203-213. [PubMed] [DOI] |
| 4. | 陈 白莉, 曾 志荣, 胡 品津, 唐 保东, 何 瑶, 陈 为. 幽门螺杆菌感染与慢性胃炎胃黏膜组织中COX-2、iNOS表达的相关性研究. 世界华人消化杂志. 2004;12:902-906. [DOI] |
| 6. | Inoue H, Jiang XF, Katayama T, Osada S, Umesono K, Namura S. Brain protection by resveratrol and fenofibrate against stroke requires peroxisome proliferator-activated receptor alpha in mice. Neurosci Lett. 2003;352:203-206. [PubMed] [DOI] |
| 7. | Picard F, Kurtev M, Chung N, Topark-Ngarm A, Senawong T, Machado De Oliveira R, Leid M, McBurney MW, Guarente L. Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-γamma. Nature. 2004;429:771-776. [PubMed] [DOI] |
| 9. | Ricketts ML, Moore DD, Banz WJ, Mezei O, Shay NF. Molecular mechanisms of action of the soy isoflavones includes activation of promiscuous nuclear receptors. A review. J Nutr Biochem. 2005;16:321-330. [PubMed] [DOI] |
| 10. | Sato H, Ishihara S, Kawashima K, Moriyama N, Suetsugu H, Kazumori H, Okuyama T, Rumi MA, Fukuda R, Nagasue N. Expression of peroxisome proliferator-activated receptor (PPAR)gamma in gastric cancer and inhibitory effects of PPARgamma agonists. Br J Cancer. 2000;83:1394-1400. [PubMed] [DOI] |
| 11. | Camp HS, Tafuri SR. Regulation of peroxisome proliferator-activated receptor gamma activity by mitogen-activated protein kinase. J Biol Chem. 1997;272:10811-10816. [PubMed] [DOI] |
| 12. | Camp HS, Tafuri SR, Leff T. c-Jun N-terminal kinase phosphorylates peroxisome proliferator-activated receptor-gamma1 and negatively regulates its transcriptional activity. Endocrinology. 1999;140:392-397. [PubMed] |
| 13. | Kutuk O, Poli G, Basaga H. Resveratrol protects against 4-hydroxynonenal-induced apoptosis by blocking JNK and c-JUN/AP-1 signaling. Toxicol Sci. 2006;90:120-132. [PubMed] [DOI] |