修回日期: 2007-01-13
接受日期: 2007-01-20
在线出版日期: 2007-03-18
目的: 探讨20岁以下慢性乙型肝炎病毒(HBV)感染者血清中HBV DNA、乙型肝炎病毒e抗原(HBeAg)定量之间关系.
方法: 用实时荧光定量聚合酶链反应(FQ-PCR)及时间分辩荧光免疫分析(TRFIA)技术检测339例(1-20岁)慢性HBV感染者血清中HBV DNA、HBeAg含量, 用速率法检测ALT水平.
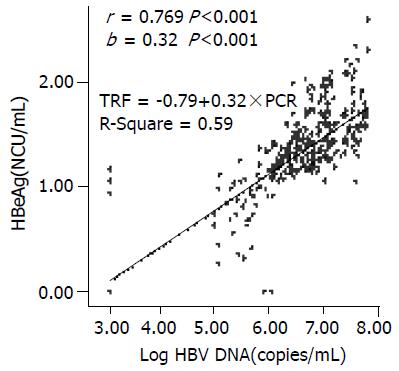
结果: HBeAg定量>0.3 NCU/mL、HBV DNA定量>105 copies/mL、而ALT水平正常者占总检测病例的92.3%; HBV DNA定量(对数值)与HBeAg定量之间存在正相关关系(r = 0.769, P <0.001)和线性回归关系(b = 0.32, R2 = 0.59, P <0.001).
结论: 20岁以下慢性HBV感染者血清中HBV DNA水平与HBeAg水平存在同时消长的关系, 但是有极少患者例外. HBV DNA定量与HBeAg定量两种检测方法相结合应能够更客观地反映患者HBV感染状况, 二者具有互补性.
引文著录: 吴殿磊, 徐光华, 冯继红, 樊霞, 苗乃周, 刘晓斌, 陈天艳, 张树林. 二十岁以下慢性HBV感染者HBV DNA与HBeAg的定量关系. 世界华人消化杂志 2007; 15(8): 909-912
Revised: January 13, 2007
Accepted: January 20, 2007
Published online: March 18, 2007
AIM: To investigate the relationshipt between hepatitis B virus (HBV) DNA contents and HBeAg quantity in HBV-infected patients under 20 years old.
METHODS: The serum HBV DNA contents and HBeAg quantity in 339 patients (age 1-20) with chronic HBV infection were examined by real time fluorescence quantitative polymerase chain reaction (FQ-PCR) and time-resolved fluoroimmunoassay (TRFIA) respectively, and the level of anine aminotransferase (ALT) was detected by rate method.
RESULTS: The patients with HBV DNA contents more than 105 copies/mL, HBeAg quantity more than 0.3 NCU/mL, and normal ALT level accounted for 92.3% of the total cases. Positive correlation (r = 0.769, P < 0.001) and linear regression (b = 0.32, R2 = 0.59, P < 0.001) existed between HBV DNA contents (on a log scale) and HBeAg quantity in the patients under 20 years old.
CONCLUSION: Serum HBV DNA contents and HBeAg quantity are changed simultaneously in HBV-infected patients under 20 years old, except in quite a few cases, so combined examination of HBV DNA and HBeAg may help to evaluate the state of chronic HBV infection more exactly.
- Citation: Wu DL, Xu GH, Feng JH, Fan X, Miao NZ, Liu XB, Chen TY, Zhang SL. Correlation between hepatitis B virus DNA levels and HBeAg quantity in patients under 20 years old with chronic hepatitis B virus infection. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 909-912
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/909.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.909
乙型肝炎是全球性公共卫生问题, 我国是乙型肝炎高流行区. 随着分子生物学技术, 荧光免疫技术的发展, 乙型肝炎病毒脱氧核糖核酸(HBV DNA)及乙肝血清标志物检测已由过去的定性发展到定量. 特别是近年来发展起来的HBV DNA的实时荧光定量聚合酶链反应(FQ-PCR)及乙肝血清标志物时间分辩荧光免疫分析技术(TRFIA), 以其高度的灵敏性、特异性、精确性以及操作简单, 时间短, 不易污染, 自动化程度高等优点逐步广泛应用于临床. 我们应用FQ-PCR、TRFIA技术, 平行检测339例(1-20岁)慢性HBV感染者血清中的HBV DNA含量, 乙肝血清标志物定量; 并对照患者的肝功能, 以探讨20岁以下慢性HBV感染者血清HBV DNA含量与乙肝血清标志物中HBeAg定量的关系.
本院2005-06/2006-09门诊慢性HBV感染者共339例, 男206例, 女133例, 年龄1-20(平均10.2±6.13)岁. 所有患者无使用抗病毒药物病史, 无合并其他肝炎病毒感染. 诊断符合2005-12北京公布的《乙型肝炎防治指南》中的诊断标准. 美国PE公司Gene AmP5700定量基因检测系统和1235 Auto DELFIA全自动时间分辩荧光免疫分析系统; 日立7600全自动生化分析仪. 乙型肝炎病毒核酸荧光检测试剂盒, 由中山大学达安基因诊断中心提供; 时间分辩荧光免疫分析乙肝血清标志物定量检测试剂盒, 由苏州新波生物技术有限公司提供; ALT相关试剂, 由北京九强生物技术有限公司提供.
339例慢性HBV感染者中, HBV DNA定量(取对数值下同)>5 copies/mL(6.83±0.68 copies/mL), 同时HBeAg定量>0.3 NCU/mL(1.37±0.33 NCU/mL), 而ALT水平于正常范围的病例为313例, 占总病例数的92.3%; 12例ALT值>80 U/L(142.9±46.4 U/L); 3例患者: ALT水平正常, HBV DNA检测是阴性, 而HBeAg定量>0.5 NCU/mL(1.03±0.105 NCU/mL); 2例ALT水平正常, HBeAg定量在正常范围, 而HBV DNA检测值>5 copies/mL(6.05±0.113 copies/mL); HBV DNA定量<3 copies/mL, 同时HBeAg, 定量<0.03 NCU/mL, 且ALT水平于正常范围的有9例(表2).
| n | HBV DNA(copies/mL) | HBeAg(NCU/mL) | ALT(U/L) | % |
| 313 | >5 | >0.3 | <80 | 92.3 |
| 3 | <3 | >0.5 | <80 | 0.88 |
| 2 | >5 | <0.03 | <80 | 0.59 |
| 12 | >5 | >0.3 | >80 | 3.53 |
| 9 | <3 | <0.03 | <80 | 2.65 |
患者血清HBV DNA含量与HBeAg定量, 二者存在正相关关系(r = 0.769 P<0.001)和线性回归关系(b =0.32, R2 = 0.59 P<0.001)(图1).
FQ-PCR是一种新的基因检测技术, 本技术是在定性PCR基础上增加了一条荧光探针, 标记有荧光报告基团(R)和荧光淬灭基团(Q), 当荧光探针保持完整时, R的荧光信号被Q所淬灭, 在PCR反应中, Taq酶将探针切断时, R释放出荧光信号, 每切断一条探针, 相应就有一条核酸链复制, 同时释放出一个单位的荧光集团, 通过计算机采用光电技术将荧光信号强弱量化, 从而反映分析物HBV DNA的含量[1]. FQ-PCR的整个操作过程仅需开盖一次, 克服了定性PCR易污染, 假阳性率高等不足. 检测的灵敏性、特异性、精确性高, 可以客观准确的反映机体HBV的感染及复制状况[2]. 目前已广泛应用于临床实践, 并成为病毒学、细菌学、病因病理学等基础研究的重要工具.
TRFIA是用三价稀土离子及其螯合剂作为示踪物, 如铕(Eu3+)、铽(Te3+)、及钐(Sm3+)、镝(De3+)等代替传统的荧光物质, 放射性同位素, 酶和化学发光物质, 来标记抗体、抗原、多肽、激素、核酸探针及生物素. 待反应体系发生后, 用时间分辩荧光仪测定最后产物中的荧光强度, 根据荧光强度和相对荧光强度比值, 判断反应体系中分析物的浓度, 达到定量分析的目的[3]. 稀土离子螯合物具有荧光衰变时间长; 激发光与发射光的Stokes位移(激发光与发射光波相差)大及被激发的荧光光谱极窄; 荧光激发波长范围宽; 为原子标记, 体积很小等特点. 使TRFIA集酶标记, 同位素标记技术的优点于一身, 具有灵敏度高[4], 特异性强, 稳定性好, 标记制备简便, 储存时间长, 无放射性污染, 检测重复性好, 操作流程短, 标准曲线范围宽和应用范围广泛等优点[5-6], 其灵敏度大大的超过了放射免疫分析技术, 是目前配基结合分析中最有发展前途的一项超微量检测手段. 已逐步在临床实践中推广.
HBV DNA是乙型肝炎病毒的分子生物学标记, HBV DNA的存在是HBV复制和传染性的直接标志[2,7-8]. HBeAg同样被视为HBV复制与传染的标志而且是重要的免疫耐受因子[7-8], 大部分情况下血清中HBeAg中、高浓度存在表示患者处于高感染低应答期. HBeAg消失而抗HBe产生称为血清转换. 转换过程通常意味着机体由免疫耐受转为免疫激活. HBeAg致机体的免疫耐受作用是HBV适应、生存及繁衍的一种重要保护手段. 我们的研究表明: 青少年和小儿慢性HBV感染者血清中HBV DNA含量与HBeAg定量之间存在正相关关系和线性回归关系. 本研究结果与Hussain et al[9]研究报导基本一致. 不同的是以往研究未将研究对象按年龄区分[10]; HBeAg研究方法多是定性而非定量; 未用线性回归关系分析进一步阐明二者间量的关系. 我们发现, HBV DNA定量对数值每升高1 copy/mL, HBeAg定量随之平均升高0.32 NCU/mL.
研究发现, 339例总样本中, HBV病毒复制活跃, (HBV DNA定量升高, HBeAg定量升高), 而ALT水平正常的病例为313例占总病例数的92.3%. Lok et al[11]认为, 慢性乙肝自然史分为4个不同时期: 免疫耐受期、免疫清除期、非活动期、复发期. 免疫耐受期的特点是: HBV DNA滴度较高, HBeAg(+), 而ALT水平正常, 组织学无明显异常. 我们的研究发现与上述观点是一致的. 青少年和小儿免疫系统发育尚未完善, 加上HBeAg免疫耐受因子的作用, HBV感染时机体处于免疫耐受状态, 而乙肝的发生与免疫清除损害明显相关(Ishikawa et al[12]、Chisari et al[13]研究认为, 乙型肝炎的发生与患者自身的免疫清除损害明显相关, 与HBV的直接作用无明显相关性. 如: 致敏T细胞清除机体HBV的同时也损伤了肝细胞[14]). 此时肝脏无损害或损害轻微尚达不到肝炎水平, 称为HBV携带状态, 通常具有较强的感染性. 这一时期, 目前尚缺乏有效的治疗药物与治疗方法, 需动态监测, 在ALT升高>正常值上限两倍时(排除 劳累、熬夜、饮酒, 损害肝脏药物及其他因素或疾病所至ALT升高, 也应排除因应用降酶药物后ALT暂时性正常)、即视为其免疫清除发动(激活)的开始. ALT持续或间断升高, 超过6 mo, 在其自身不能自发进行HBeAg到抗HBe的血清转换过程的情况下, 尤其ALT升高至正常值的5-10倍时, 对其(此类患者)进行外源性药物干预或增强其免疫力[15-16], 对其预后是有益的.
本次研究中发现有9例患者(HBV DNA定量 <5 copies/mL, 同时HBeAg, 定量<0.03 NCU/mL, 且ALT水平于正常范围)已3/4过HBeAg血清转换处于非活动期. 有极少数病例HBeAg定量阳性、而HBV DNA阴性或HBV DNA定量阳性、而HBeAg定量阴性. 这可能是病情复发、引物及探针对应的HBV DNA序列变异所致或与HBV前C区基因变异相关[17-19]. 因此, HBV DNA定量与乙肝血清标志物定量检测需互补[20-22], 且结合肝功能生化指标[23], 肝脏影像学, 甚至组织学或原位PCR应该能够更客观综合评价乙型肝炎患者HBV感染状况.
关于HBVDNA与HBeAg关系研究的学术文章非常多, 得到的结论基本上都是: 慢性乙肝病毒感染者血清中HBVDNA与HBeAg之间存在良好的相关性, 随着对慢性乙肝病毒感染自然史的不断深入了解及对HBeAg阴性慢性乙肝病毒感染研究的深入, HBeAg研究方法已由定性发展到定量, 对于上述结论有必要重新探讨认识.
本文在慢性乙肝病毒感染自然史的背景下, 分不同年龄段采用定量分析技术, 分别阐明不同年龄阶段检测结果特点的分布构成状况, 并对不同年龄段HBVDNA定量与HBeAg定量进行直线相关分析.
研究发现, 20岁以下慢性HBV感染者血清中HBVDNA与HBeAg定量之间存在正相关关系, 而20岁以上慢性乙型肝炎患者血清中HBVDNA与HBeAg定量之间不一定存在明显正相关关系. 本文发现20岁以上小三阳的慢性乙型肝炎患者中HBVDNA定量明显升高者超过30%, 必将为以后的研究提供新的思路和方法.
本文进行了不同年龄阶段慢性乙肝病毒感染者血清中HBVDNA与HBeAg相关关系的量化研究, 立题合理, 检测方法先进, 具有一定科学性.
编辑: 张焕兰 电编:李琪
| 1. | Livak KJ, Flood SJ, Marmaro J, Giusti W, Deetz K. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl. 1995;4:357-362. [PubMed] [DOI] |
| 2. | Zanella I, Rossini A, Domenighini D, Albertini A, Cariani E. Quantitative analysis of hepatitis B virus DNA by real-lime amplification. Eur J Clin Microbiol Infect Dis. 2002;21:22-26. [PubMed] [DOI] |
| 3. | Gaillard O, Kapel N, Galli J, Delattre J, Meillet D. Time-resolved fluorometry: principles and applications in clinical biology. Ann Biol Clin (Paris). 1994;52:751-755. [PubMed] |
| 4. | Siitari H, Hemmilä I, Soini E, Lövgren T, Koistinen V. Detection of hepatitis B surface antigen using time-resolved fluoroimmunoassay. Nature. 1983;301:258-260. [PubMed] [DOI] |
| 5. | Wang L, Wu YS, Tang YP, Li M. Detection of SARS-associated coronavirus N protein by time-resolved fluoroimmunoassay. Diyi Junyi Daxue Xuebao. 2005;25:429-31, 434. [PubMed] |
| 6. | Mitrunen K, Pettersson K, Piironen T, Björk T, Lilja H, Lövgren T. Dual-label one-step immunoassay for simultaneous measurement of free and total prostate-specific antigen concentrations and ratios in serum. Clin Chem. 1995;41:1115-1120. [PubMed] |
| 7. | Alagiozian-Angelova V, Alagiozian D, Antonov K, Krustev Z. Clinical significance of serum HBeAg and HBV-DNA-specific values of virus replication in chronic hepatitis-B virus infection. Folia Med (Plovdiv). 1998;40:34-41. [PubMed] |
| 8. | 彭 文伟, 李 兰娟, 乔 光彦. 传染病学. 第6版. 北京: 人民卫生出版社 2004; 30-31. |
| 9. | Hussain AB, Karamat KA, Anwar M, Kazmi SY, Tariq WU. Correlation of HBV DNA PCR and HBeAg in hepatitis B carriers. J Coll Physicians Surg Pak. 2004;14:18-20. [PubMed] |
| 11. | Lok AS. Chronic hepatitis B. N Engl J Med. 2002;346:1682-1683. [PubMed] [DOI] |
| 12. | Ishikawa T, Kakumu S, Yoshioka K, Wakita T, Shinagawa T, Ito Y. T cell lines reactive with hepatitis B core and E antigens in patients with chronic hepatitis B. J Clin Lab Immunol. 1991;34:151-156. [PubMed] |
| 13. | Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol. 1995;13:29-60. [PubMed] [DOI] |
| 14. | Wieland S, Thimme R, Purcell RH, Chisari FV. Genomic analysis of the host response to hepatitis B virus infection. Proc Natl Acad Sci USA. 2004;101:6669-6674. [PubMed] [DOI] |
| 15. | Lok AS, McMahon BJ. AASLD Practice Guidelines. Chronic hepatitis B: update of therapeutic guidelines. Rom J Gastroenterol. 2004;13:150-154. [PubMed] |
| 16. | Fung SK, Lok AS. Treatment of chronic hepatitis B: who to treat, what to use, and for how long? Clin Gastroenterol Hepatol. 2004;2:839-848. [PubMed] [DOI] |
| 17. | Funk ML, Rosenberg DM, Lok AS. World-wide epidemiology of HBeAg-negative chronic hepatitis B and associated precore and core promoter variants. J Viral Hepat. 2002;9:52-61. [PubMed] [DOI] |
| 18. | Vivekanandan P, Abraham P, Sridharan G, Chandy G, Shaji RV, Daniel D, Raghuraman S, Daniel HD, Subramaniam T. High frequency of the 1896 precore mutation in patients and blood donors with hepatitis B virus infection from the Indian subcontinent. Mol Diagn. 2004;8:51-56. [PubMed] [DOI] |
| 19. | Peng XM, Huang GM, Li JG, Huang YS, Mei YY, Gao ZL. High level of hepatitis B virus DNA after HBeAg-to-anti-HBe seroconversion is related to coexistence of mutations in its precore and basal core promoter. World J Gastroenterol. 2005;11:3131-3134. [PubMed] [DOI] |
| 20. | Yang X, Luo HY, Zhang YH, Qian HY, Zeng XB, Huang L. Relationship between the quantities of virus and the models of serologic markers in patients infected with HBV. Zhonghua Ganzangbing Zazhi. 2002;10:269-271. [PubMed] |
| 23. | Hasan KN, Rumi MA, Hasanat MA, Azam MG, Ahmed S, Salam MA, Islam LN, Hassan MS. Chronic carriers of hepatitis B virus in Bangladesh: a comparative analysis of HBV-DNA, HBeAg/anti-HBe, and liver function tests. Southeast Asian J Trop Med Public Health. 2002;33:110-117. [PubMed] |