修回日期: 2007-01-03
接受日期: 2007-01-10
在线出版日期: 2007-03-18
目的: 纯化双齿围沙蚕(Perinereis aibuhitensis Grube)蛋白酶, 并对其性质进行研究.
方法: 将沙蚕匀浆液先后进行Superdex-75凝胶柱层析、MonoQTM阴离子交换柱层析及SP-Sepharose 4B阳离子交换层析进行纯化. 将经过非还原性SDS-聚丙烯酰胺凝胶电泳的蛋白酶电转移至含明胶的SDS-聚丙烯酰胺凝胶中, 通过观察明胶的分解来确定电泳条带的蛋白酶活性. 对纯化后蛋白酶的最适pH值, 热稳定性, 最适温度, 蛋白酶抑制剂的影响, 有机溶剂的稳定性, 金属离子对酶活性的影响等性质进行了测定.
结果: 纯化后得到的一种蛋白酶, 还原性SDS-PAGE显示纯化的蛋白酶为两条带, 分子量分别为Mr 34900和Mr 33900, 而非还原性SDS-PAGE出现了分子量分别为Mr 65600、Mr 57900、Mr 43500的三条蛋白带, 明胶蛋白酶活性图谱检测显示酶活性主要在约Mr 66000处. 该蛋白酶具较好的热稳定性, 在pH 8-10和20-35 ℃的情况下有较高活性. PMSF对该酶有较强抑制作用, 而有机溶剂对该酶没有明显的影响.
结论: 该蛋白酶由两个通过二硫键连接在一起的亚基构成, 两亚基的分子量分别为Mr 33900和Mr 34900; 本文所采用的新的明胶蛋白酶活性图谱检测法是一种非常灵敏和有效的蛋白酶活性检测方法.
引文著录: 汪靖超, 赵峰, 李荣贵, 王斌. 双齿围沙蚕蛋白酶的纯化及其性质. 世界华人消化杂志 2007; 15(8): 800-806
Revised: January 3, 2007
Accepted: January 10, 2007
Published online: March 18, 2007
AIM: To purify a new protease from the clamworm Perinereis aibuhitensis Grube, and study its properties.
METHODS: After homogenization, Superdex-75 chromatography, MonoQTM chromatography, and SP-Sepharose 4B chromatography were used ordinally to purify the protease from the clamworm Perinereis aibuhitensis Grube. A new gelatin zymography method was used to study the proteolytic activity of the protease: protease separated by non-reductive SDS-PAGE was electrophoretically transferred to a gel containing gelatin, and the proteolytic activity of the protease was determined by the clear zone of the electrophoretic protein band. The effect of pH value, temperature, protease inhibitor, organic solvents and metal ions on the proteolytic activity of the protease was studied.
RESULTS: After purification, one kind of protease was obtained, which showed two protein bands with molecular weights of 34900 and 33900 separately by reductive SDS-PAGE, while three bands with molecular weights of 65600, 57900, and 43500 separately by non-reductive SDS-PAGE. Gelatin zymography showed that the proteolytic activity mainly appeared around the band of Mr 66000. The protease was stable and displayed high proteolytic activity within the range of pH 8 to 10 and at 20-35 ℃ It was strongly inhibited by phenylmethyl sulfonyl fluoride (PMSF), while stable in the presence of organic solvents.
CONCLUSION: The protease is composed of two subunits, whose molecular weights are 33900 and 34900, respectively. Gelatin zymography is sensitive and effective in studying the proteolytic activity of proteases.
- Citation: Wang JC, Zhao F, Li RG, Wang B. Purification and properties of the protease from Perinereis aibuhitensis Grube. Shijie Huaren Xiaohua Zazhi 2007; 15(8): 800-806
- URL: https://www.wjgnet.com/1009-3079/full/v15/i8/800.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i8.800
双齿围沙蚕(Perinereis aibuhitensis Grube)属环节动物, 俗称海蜈蚣、青虫, 广泛分布在我国沿海滩涂, 平常被用作钓饵和对虾养殖的优质饵料[1]. 关于沙蚕的性质研究, 很多学者也进行了大量的工作[2-5], Takahashi et al[6]从沙蚕中分离出了多种具有生物活性的多肽, 这些多肽对环节动物的食管具有较强的收缩作用, Takahashi认为, 可以开发为新型胃动力药; Pan et al[7]从双齿围沙蚕体内分离出了具有广谱抗菌活性的一种抗菌肽; Li et al[8]从双齿围沙蚕体内克隆出了一种蛋白酶的cDNA, 插入表达载体后转化大肠杆菌, 得到了重组的沙蚕蛋白酶; 张伟云et al[9]从沙蚕体内分离出了一种蛋白酶. 我们从双齿围沙蚕体内分离纯化了一种蛋白酶, 具酪蛋白酶活性, 有望开发为一种新型的助消化药物. 我们在实验过程中还对传统的明胶蛋白酶图谱检测方法进行了改进.
双齿围沙蚕产于山东青岛. ÄKTA Purifier、SP-Sepharose 4B树脂为Amersham Biosciences产品, Superdex-75 树脂、MonoQTM阴离子交换树脂为Pharmacia公司产品, 其他试剂均为国产分析纯.
1.2.1 沙蚕蛋白酶的分离纯化: 称取约5 g新鲜活沙蚕, 加入25 mL TRIs-HCl缓冲液(20 mmol/L, pH8.0), 组织匀浆机中匀浆, 匀浆液于高速冷冻离心机中10000 g离心30 min, 取上清液. 以20 mmol/L TRIs-HCl缓冲液(pH8.0)平衡Superdex-75凝胶柱(1.6 cm×60 cm), 上样2 mL上清液, 用同样的缓冲液洗脱, 流速设置为0.5 mL/min, 分部收集器收集, 每管3 mL, 280 nm处检测. 取峰值样品进行蛋白酶活性检测. 将凝胶过滤后收集的Ⅳ号峰样品进一步经过MonoQTM阴离子交换树脂分离纯化, 首先用TRIs-HCl缓冲液(20 mmol/L, pH8.0)平衡层析柱, 取样品20 mL上样, 以含0.01-0.5 mol/L NaCl的相同缓冲溶液进行NaCl连续梯度洗脱, 流速0.5 mL/min, 分部收集器自动收集, 每管0.5 mL, 280 nm处检测. 取峰值样品进行蛋白酶活性检测. 取SP-Sepharose 4B树脂100 mL于1.5 mL eppendorf管中, 用TRIs-HCl (20 mmol/L, pH8.0)缓冲液平衡树脂. 将500 mL上一步中收集的第22管样品稀释至1 mL, 加入平衡好的树脂, 充分悬浮后低速离心, 弃上清. 再依次用250 mL含0.1, 0.2, 0.25, 0.3, 0.45 mol/L NaCl的TRIs-HCl (20 mmol/L, pH8.0)洗脱缓冲液进行不连续梯度洗脱, 每次洗脱后均低速离心, 收集上清, 并进行蛋白酶活性检测.
1.2.2 蛋白酶活性的测定: 20 mL TRIs-HCl缓冲液(20 mmol/L, pH8.0)中加入0.2 g琼脂糖、0.3 g脱脂奶粉, 混匀, 加热煮沸, 倒平板, 静置冷却, 用打孔器在平板上打直径约3 mm的孔. 在每个孔中点样20 mL蛋白酶样品, 于28 ℃恒温培养箱中保温12 h, 测量透明圈垂直的两直径, 取两值的乘积.
1.2.3 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE): 配制150 g/L的SDS-聚丙烯酰胺凝胶(50 g/L浓缩胶, 150 g/L分离胶)对蛋白样品进行电泳[10], 考玛斯亮蓝R-250染色, 电泳时分别使用还原与非还原 (不含b-巯基乙醇)的载样缓冲液, 观察条带位置与数目的变化.
1.2.4 聚丙烯酰胺凝胶电泳(PAGE): 配置150 g/L的聚丙烯酰胺凝胶对样品进行电泳, 观察并记录条带的数目, 与上述SDS-PAGE结果进行比较分析.
1.2.5 明胶蛋白酶图谱检测: 制备150 g/L的SDS-聚丙烯酰胺凝胶一块(含1 g/L明胶), 待用. 配制SDS-聚丙烯酰胺凝胶(50 g/L浓缩胶, 150 g/L分离胶), 取分离纯化的蛋白酶样品1 mL, 加15 mL非还原性载样缓冲液(不含b-巯基乙醇), 进行SDS-PAGE. 电泳后取下凝胶, 浸在印迹缓冲液(25 mmol/L TRIs-HCl, 192 mmol/L甘氨酸, 200 mL/L甲醇, pH8.3), 120 mA恒流条件下电转移1 h, 将凝胶中的蛋白转印至已制备好的含1 g/L明胶的SDS-聚丙烯酰胺凝胶中. 蒸馏水冲洗后浸入复性缓冲液(50 mmol/L TRIs-HCl, 25 g/L TritonX-100, pH 8.0), 室温振荡30 min(期间更换一次复性缓冲液), 倒掉复性缓冲液, 加入培育缓冲液(TRIs-HCl, 50 mmol/L, pH7.5, 5 mmol/L CaCl2, 200 mmol/L NaCl), 28 ℃温育约3 h. 然后用考玛斯亮蓝R-250染色液充分染色, 脱色后观察电泳条带的蛋白酶活性.
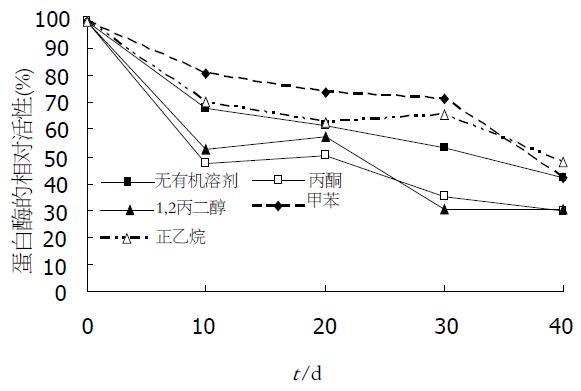
1.2.6 蛋白酶性质的研究: 沙蚕蛋白酶的最适pH值: 以pH3.0-pH10.0的缓冲液(pH3.0-pH6.0为NaAC-HAC缓冲液, pH7.0-pH10.0为TRIs-HCl缓冲液)配制蛋白平板测蛋白酶活性. 沙蚕蛋白酶的最适温度: pH8.0的蛋白平板, 加样后20 ℃, 25 ℃, 30 ℃, 35 ℃, 40 ℃下保温4 h, 测蛋白酶活性. 沙蚕蛋白酶的热稳定性: 将纯化的沙蚕蛋白酶置于10-80 ℃的水浴中保温30 min, 4 ℃下静置片刻, 测蛋白酶活性. 蛋白酶抑制剂的影响: 选用丝氨酸蛋白酶抑制剂苯甲基磺酰氟(PMSF). 测PMSF终浓度分别为2.5、5、10、20 mmol/L的纯化蛋白酶的酶活性. 沙蚕蛋白酶对有机溶剂的稳定性: 在纯化的沙蚕蛋白酶样品中分别加入3倍体积的甲醇、1,2-丙二醇、正己烷、丙酮4 ℃保存, 每10 d取样一次, 测蛋白酶活性. 金属离子对酶活性的影响: 检测Zn2+, Cu2+, Mn2+, Fe2+, Ni2+, K+, Ca2+, Mg2+ 8种金属离子对沙蚕蛋白酶活性的影响.
沙蚕经匀浆后, 匀浆上清液滴加到含脱脂奶粉的平板上, 28 ℃放置12 h后, 滴样孔周围有明显的透明圈(图1), 说明沙蚕匀浆上清液有酪蛋白水解活性, 所以断定沙蚕粗提液中有能水解酪蛋白的蛋白酶.
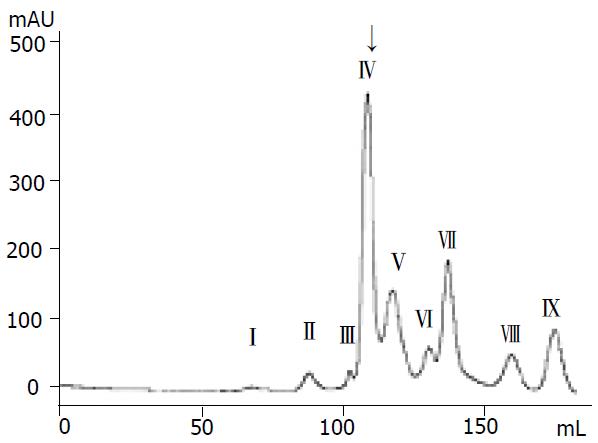
2.2.1 凝胶过滤柱层析: 沙蚕匀浆上清液经Superdex-75凝胶层析分离后, 共有9个紫外吸收峰(图2), 经蛋白平板检测Ⅳ号吸收峰的样品有明显蛋白酶活性, 对照管数合并Ⅳ号吸收峰样品, 进行阴离子交换层析.
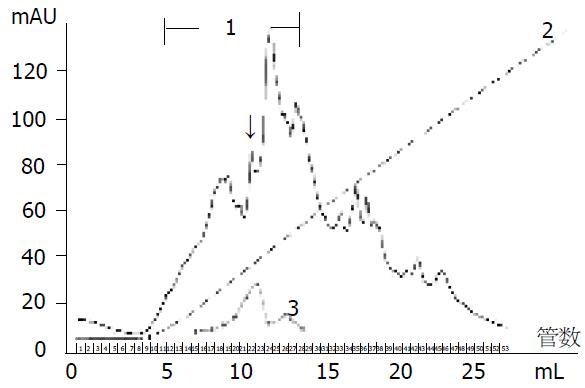
2.2.2 阴离子交换柱层析: 经MonoQTM阴离子交换树脂进一步分离纯化, 结果见图3. 经蛋白平板检测12-28号管中样品有活性, 对应的相对电导率(cond%)范围为3.2%-23.7%, 其中22号管中的样品酶活性最高(图3中箭头所示). 取22号管样品再进行阳离子交换层析.
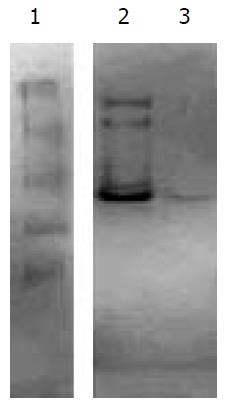
2.2.3 阳离子交换层析: 经SP-Sepharose 4B阳离子交换层析后发现, 未与SP-Sepharose 4B树脂结合的流出液有明显的蛋白酶活性, 而由各浓度盐离子洗脱下的蛋白样品并没有水解酪蛋白平板的蛋白酶活性(图4). 这说明该蛋白酶在pH8.0的缓冲液中带有负电荷.
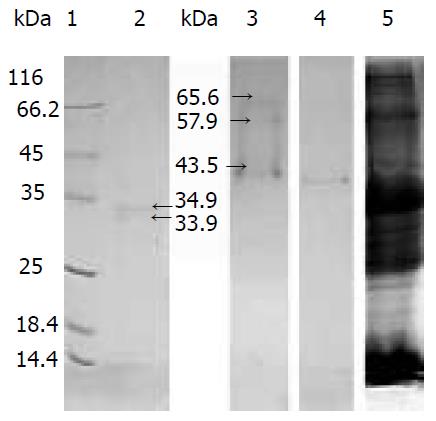
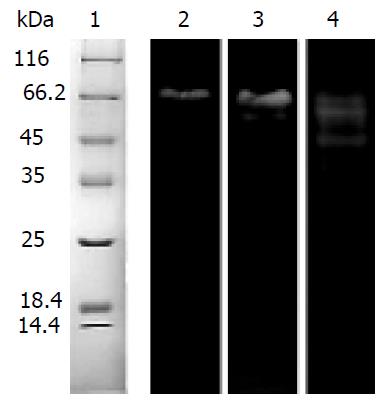
经以上多步纯化后, 还原性SDS-PAGE显示纯化的蛋白酶为分子量分别为Mr34900和Mr 33900的两条带(图5, 2), 两条带靠的很近且条带很弱. 我们怀疑这两条带是纯化出的蛋白酶的两个亚基, 在电泳过程中, 两亚基分开, 所以显为两条带. 为了研究还原性SDS-PAGE电泳中Mr 34900和Mr 33900的两条带是独立的两个蛋白质, 还是一个蛋白质的两个亚基, 我们又进行了非还原性SDS-PAGE. 结果显示, 在Mr 35000分子量左右并没有再出现蛋白质条带, 而出现了分子量分别为Mr 65600、Mr 57900、Mr 43500的3条蛋白带(图5, 3). 将纯化的蛋白酶在4 ℃保存10 d后, 再次进行非还原性SDS-PAGE, 结果显示, (图5, 3)中的两条大分子量蛋白条带均减弱, 只在Mr40000左右有一条清晰蛋白条带(图5, 4). 在进行非还原SDS-PAGE时, 使用的载样缓冲液中不添加b-巯基乙醇, 并且上样样品不进行煮沸处理, 因此蛋白间的二硫键不能被打开, 以二硫键相连的亚基也不会分开, 既然非还原SDS-PAGE电泳图中没有还原SDS-PAGE电泳图分子量为Mr 35000左右的两条带, 而是出现了分子量更大的条带, 所以我们推断, 还原SDS-PAGE电泳图谱中Mr 34900和Mr 33900的两条带不应该是两个独立的蛋白, 而应该是一个蛋白质的两个亚基, 这个蛋白质的分子量应当在Mr 60000-70000之间. 非还原性SDS-PAGE图谱中出现了3条蛋白条带, 而保存10 d后再次进行的非还原SDS-PAGE图谱中仅剩一条分子量约为Mr 40000的条带. 这两次电泳出现的差异我们认为可能是由于蛋白酶发生降解而引起的结果.
聚丙烯酰胺凝胶电泳检测图谱见图6, 与非还原SDS-PAGE(图5, 3-4)的结果基本吻合. 为了探讨Mr57900与Mr 43500两条带的出现是否是由于肽链间弱相互作用(如疏水性相互作用)的结果, 我们又进行了聚丙烯酰胺凝胶电泳, 聚丙烯酰胺凝胶电泳体系(电极缓冲液、凝胶、载样缓冲液)中没有SDS, 并且载样缓冲液中也不添加b-巯基乙醇, 因此蛋白经聚丙烯酰胺凝胶电泳时既不会打开二硫键, 也不会破坏亚基间的疏水性的相互作用, 电泳结果与非还原SDS-PAGE的结果基本吻合, 可以推断在蛋白亚基之间除二硫键以外并不存在疏水相互作用等弱连接. 对于Mr 57900与Mr 43500两条带出现原因, 我们推测可能是由于蛋白酶降解造成的.
非还原SDS-聚丙烯酰胺凝胶电泳后, 将蛋白电转移到含明胶的聚丙烯酰胺凝胶上, 检测蛋白条带的明胶蛋白酶活性, 结果见图7. 刚纯化出的蛋白(图7, 2), 其酶活性只在约Mr 66000处, 但随蛋白保存时间的延长, 出现了分子量小于Mr 66000的有酶活性的蛋白带(图7, 3-4), 尽管保存10 d后的蛋白在非还原SDS-PAGE、PAGE中均只显示为一条带, 但由于明胶蛋白酶图谱检测法的敏感性, 仍可显现出Mr 66000与Mr 57900左右的两条带来, 此时Mr 66000处条带明显变弱, 小分子量蛋白增多(图7, 4). 至此, 我们断定Mr 57900和Mr 43500的两条带是由Mr 65600的蛋白自溶产生的, 该蛋白由Mr 34900和Mr 33900的两个亚基组成. 蛋白酶的分子量约为Mr 65600, 也与该蛋白在凝胶过滤层析中的出峰位置(图2)基本吻合. 在最初进行明胶蛋白酶活性图谱检测时, 我们是参照文献[11]中介绍的方法进行的: 将蛋白样品直接在含1 g/L明胶的SDS-聚丙烯酰胺凝胶上进行电泳, 然后复性、温浴、考玛斯亮蓝R-250染色、脱色. 但效果并不好, 这是由于该蛋白酶的活性非常高, 伴随着电泳的进行蛋白酶已将凝胶板中的明胶水解, 活性染色时从加样孔至蛋白条带间出现大片的白色区域, 且分辨不清不同的蛋白条带, 我们也尝试了用冰浴法进行电泳、减少蛋白酶的上样量、缩短温浴时间等多种方法, 试图降低电泳时蛋白酶对明胶的分解, 但效果并不显著. 后来受Western blot实验原理的启发, 我们创造性的采用了电转移法来进行蛋白酶活性检测. 结果证明用该方法检测蛋白酶活性, 一方面避免了在电泳过程中蛋白酶就对明胶进行分解, 影响了最终结果的观察, 同时用该方法检测蛋白酶活性也极为敏感, 对条带的分辨率很高(图7).
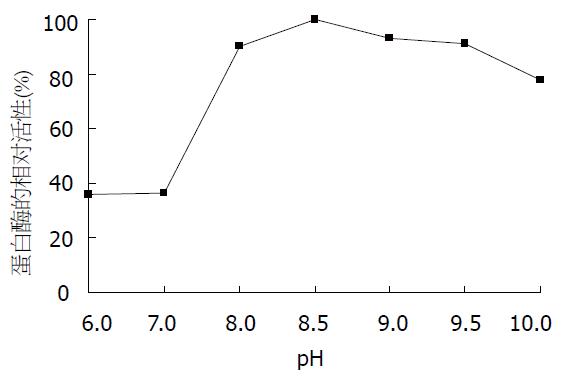
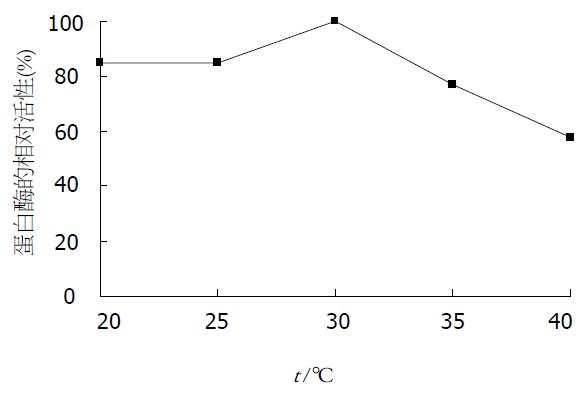
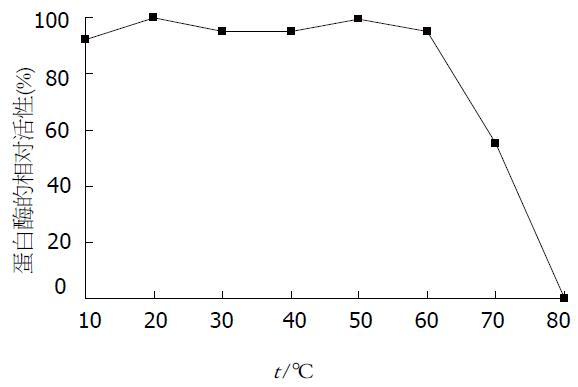
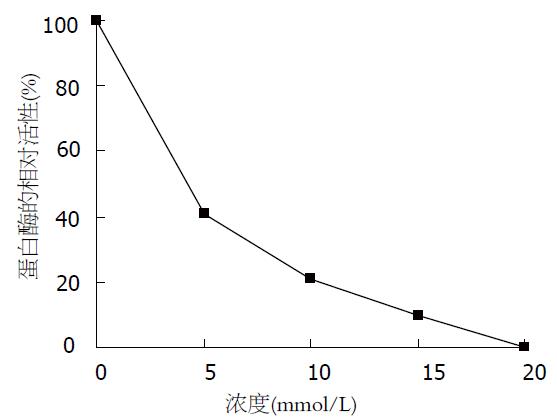
pH值对沙蚕蛋白酶活性的影响见图8, 沙蚕蛋白酶属碱性蛋白酶, 在碱性条件下有较高活性, 而在中性和酸性条件下活性较低, 最大酶活的pH值为8.5. 沙蚕蛋白酶在20-35 ℃间都有较高活性, 最适温度为30 ℃, 随着温度的升高, 酶活下降较快(图9). 沙蚕蛋白酶在不同温度下保温30 min后的酶活性见图10, 该沙蚕蛋白酶有较好的热稳定性, 60 ℃处理30 min对酶活性并没有影响, 70 ℃时酶活性才有显著降低, 80 ℃时酶则完全失活. PMSF对沙蚕蛋白酶具有明显的抑制作用(图11), 随PMSF浓度的升高抑制作用逐步加强, 20 mmol/L的PMSF能对此酶完全抑制. 这同时表明该沙蚕蛋白酶属于丝氨酸蛋白酶家族. 实验用各有机溶剂对沙蚕蛋白酶的稳定性并没有显著的影响(图12), 沙蚕蛋白酶对有机溶剂有较好的稳定性. 金属离子对沙蚕蛋白酶活性的影响见表1, Zn2+的存在对沙蚕蛋白酶有明显抑制作用, 随离子浓度的升高抑制作用也明显加强. Cu2+对沙蚕蛋白酶活性有一定抑制作用, 但离子浓度升高时, 抑制作用并不显著. Mn2+、Ni2+、K+对沙蚕蛋白酶活性有微弱的抑制作用, Fe2+、Ca2+对沙蚕蛋白酶活性则完全没有影响, 而Mg2+在低离子浓度的情况下对沙蚕蛋白酶有激活作用.
近年来, 蛋白酶及其抑制剂已成为研究热点. 众多研究表明, 蛋白酶在许多重要的生命活动过程中发挥着十分重要的作用. 蛋白酶参与蛋白质的水解、消化、血液凝固与血栓溶解、血管形成、炎症、受精以及细胞生长和维持细胞的形态等. 蛋白酶及其抑制剂与许多疾病的发病机制有关, 在人类疾病的治疗与诊断中也发挥着重要的作用[12-15].
沙蚕与蚯蚓同属环节动物, 人们对从蚯蚓中提取的蚓激酶已经做了大量的研究[16-21], 并作为溶栓药品推向了市场[22]. 沙蚕虽然广泛分布在我国沿海, 但目前国内外对沙蚕药用价值的开发和利用却并不多见. 我们采用Superdex75凝胶过滤柱层析、MonoQTM阴离子交换柱层析、SP-Sepharose 4B阳离子交换柱层析等方法从双齿围沙蚕中分离纯化出了一种蛋白酶, 该蛋白酶有很强的体外水解酪蛋白活性, 有较好的热稳定性, 有机溶剂对该酶没有明显的影响. 该蛋白酶有望开发为一种新型溶栓药物或新型的助消化药物.
我们推断, 本次纯化的蛋白酶由两个亚基组成, 两亚基的分子量分别约为Mr 33900和Mr 34900, 两亚基间通过二硫键相连. 张伟云et al[9]曾从双齿围沙蚕中提取出一种沙蚕纤溶酶, Li et al[8]从双齿围沙蚕体内克隆出一种蛋白酶的cDNA, 插入表达载体后转化大肠杆菌, 得到了重组的沙蚕蛋白酶, 但他们所得蛋白酶的分子量与我们提纯的蛋白酶分子量并不相同, 所以本文所报道的双齿围沙蚕蛋白酶是一种新型的蛋白酶. 在实验中进行明胶蛋白酶活性图谱检测时, 我们先是参照Noritaka et al[11]的方法进行的, 但由于该蛋白酶的活性非常高, 该方法并不可行, 后来我们创新性的采用了电转移法来进行蛋白酶活性检测. 结果证明我们的方法极其灵敏, 检出限极低, 是一种检测蛋白酶活性与纯度的好方法. 下一步我们将深入研究该蛋白酶的功能, 对其进行药理、毒理、临床反应等方面的研究, 为其作为一种新型药物的应用奠定基础.
沙蚕广泛分布在我国沿海, 但目前国内外对沙蚕药用价值的开发和利用却并不多见. 同属环节动物的蚯蚓中提取的蚓激酶已经作为溶栓药品推向了市场, 本研究从双齿围沙蚕中分离纯化出了一种蛋白酶.
关于沙蚕蛋白酶的研究国内外目前都较少, 沙蚕蛋白酶有相当大的开发前景和空间, 其药理、毒理、临床反应等方面的研究是本领域的研究热点.
Li et al从双齿围沙蚕体内克隆出一种蛋白酶的cDNA, 插入表达载体后转化大肠杆菌, 得到了重组的沙蚕蛋白酶; 利用分子生物学技术, 克隆出沙蚕蛋白酶的基因, 利用基因工程菌发酵生产重组沙蚕蛋白酶, 这种途径可以大量、持久的得到沙蚕蛋白酶.
本文提纯的蛋白酶是一种新型的蛋白酶, 同时本文还创新的使用了一种新的检测蛋白酶活性的明胶蛋白酶活性图谱检测法.
明胶蛋白酶活性图谱检测法: 为了检测电泳蛋白条带的蛋白酶活性, 将电泳后的蛋白电转移至含明胶的聚丙烯酰胺凝胶中, 考玛斯亮蓝R-250染色后观察电泳条带的蛋白酶活性.
本文研究了双齿围沙蚕蛋白酶的纯化及性质, 文章新颖度高、方法可靠、结果可信、有一定的实际应用价值.
编辑: 王晓瑜 电编:李琪
| 1. | 顾 晓英, 蒋 霞敏, 郑 忠明, 金 春华. 双齿围沙蚕(Perinereis aibuhitensis Grube)的生物学特征和开发利用现状. 现代渔业信息. 2002;17:33-34. |
| 3. | Tsuneshige A, Imai K, Hori H, Tyuma I, Gotoh T. Spectrophotometric, electron paramagnetic resonance and oxygen binding studies on the hemoglobin from the marine polychaete Perinereis aibuhitensis (Grübe): comparative physiology of hemoglobin. J Biochem. 1989;106:406-417. [PubMed] |
| 4. | Yamaki M, Kubota K, Matsubara K, Ebina S, Gotoh T. Carbohydrate gluing is a strategy for supramolecular clamping of submultiples in annelid extracellular multi-subunit hemoglobin. Arch Biochem Biophys. 1998;355:119-123. [PubMed] [DOI] |
| 5. | Chen CA, Chen CP, Fan TY, Yu JK, Hsieh HL. Nucleotide sequences of ribosomal internal transcribed spacers and their utility in distinguishing closely related Perinereis polychaets (Annelida; Polychaeta; Nereididae). Mar Biotechnol (NY). 2002;4:17-29. [PubMed] [DOI] |
| 6. | Takahashi T, Furukawa Y, Muneoka Y, Matsushima O, Ikeda T, Fujita T, Minakata H, Nomoto K. Isolation and characterization of four novel bioactive peptides from a polychaete annelid, Perinereis vancaurica. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol. 1995;110:297-304. [PubMed] [DOI] |
| 7. | Pan W, Liu X, Ge F, Han J, Zheng T. Perinerin, a novel antimicrobial peptide purified from the clamworm Perinereis aibuhitensis grube and its partial characterization. J Biochem. 2004;135:297-304. [PubMed] [DOI] |
| 8. | Li RG, Qian DM, Guo DS, Du GC, Yan ZY, Wang B. Isolation of a cDNA encoding a protease from Perinereis aibuhitensis Grube. Acta Biochim Biophys Sin (Shanghai). 2006;38:543-548. [PubMed] [DOI] |
| 10. | Sambrook J, Russell DW. Molecular cloning: a laboratory manual. New York: Cold Spring Harbor Laboratory Press 2001; 27-30. |
| 11. | Noritaka H, Naoko U, Akimasa H. Akashi K. Characterization of serine proteases in the monogenean Neobenedenia girellae. Aquaculture. 2006;255:188-195. [DOI] |
| 16. | 严 宜明, 孔 键, 李 红, 石 男, 隋 红艳. 蚯蚓纤溶酶原激活剂的分离纯化及其性质. 中国生物化学与分子生物学报. 2005;21:537-545. |
| 17. | Hu Y, Meng XL, Xu JP, Lu W, Wang J. Cloning and expression of earthworm fibrinolytic enzyme PM(246) in Pichia pastoris. Protein Expr Purif. 2005;43:18-25. [PubMed] [DOI] |
| 18. | Nakajima N, Sugimoto M, Ishihara K. Stable earthworm serine proteases: application of the protease function and usefulness of the earthworm autolysate. J Biosci Bioeng. 2000;90:174-179. [PubMed] [DOI] |
| 19. | Wang F, Wang C, Li M, Zhang JP, Gui LL, An XM, Chang WR. Crystal structure of earthworm fibrinolytic enzyme component B: a novel, glycosylated two-chained trypsin. J Mol Biol. 2005;348:671-685. [PubMed] [DOI] |
| 20. | Cho IH, Choi ES, Lee HH. Molecular cloning, sequencing, and expression of a fibrinolytic serine-protease gene from the earthworm Lumbricus rubellus. J Biochem Mol Biol. 2004;37:574-581. [PubMed] [DOI] |
| 21. | Wang C, Wang F, Li M, Tang Y, Zhang JP, Gui LL, An XM, Chang WR. Structural basis for broad substrate specificity of earthworm fibrinolytic enzyme component A. Biochem Biophys Res Commun. 2004;325:877-882. [PubMed] [DOI] |
| 22. | 胡 燕, 孟 小林, 徐 进平, 张 俊杰, 王 健, 鲁 伟. 蚯蚓纤溶酶基因的cDNA克隆及其序列分析. 武汉大学学报(理学版). 2004;50:211-215. |