修回日期: 2006-11-30
接受日期: 2006-12-18
在线出版日期: 2007-03-08
目的: 探讨成人盆底痉挛综合征型便秘的分型及其病理生理机制, 以及生物反馈治疗该型便秘的原理.
方法: 使用基础电路电压为1.53 μV的Medtronic公司生产的生物反馈训练仪对18例盆底痉挛综合征型便秘的成人患者首先进行约20 min放松练习, 肛门塞电极记录到外括约肌的静息电位值, 然后患者完成模拟排便动作, 获得模拟排便及放松两种状态下外括约肌电位的两组数值, 并进行统计学比较.
结果: 根据肛门外括约肌的静息电位以及模拟排便外括约肌的电位变化, 成人盆底痉挛综合征型便秘表现为三种病理分型, 即Ⅰ型: 高静息电位+矛盾运动(占44.44%), Ⅱ型: 高静息电位(占33.33%), Ⅲ型: 矛盾运动(占22.22%), 其中外括约肌的高静息电位占本组便秘患者的77.77%. 各病理分型外括约肌静息电位之间两两比较均具有显著性差异 (P = 0.001).
结论: 外括约肌的高静息电位以及在此基础上并发的外括约肌矛盾运动构成了盆底痉挛综合征型便秘的病理生理机制, 生物反馈训练能够有效降低外括约肌的静息电位并消除可能出现的外括约肌矛盾运动.
引文著录: 肖元宏, 刘洲禄, 刘贵麟, 彭少林, 王政, 彭正, 臧传波, 夏少友, 张艳君. 成人盆底痉挛综合征型便秘的分型及其病理生理机制. 世界华人消化杂志 2007; 15(7): 767-771
Revised: November 30, 2006
Accepted: December 18, 2006
Published online: March 8, 2007
AIM: To discuss the classification and pathophysiological mechanism of constipation caused by spastic pelvic floor syndrome (SPFS) in adults, and to investigate the mechanism of biofeedback training in treating this type of constipation.
METHODS: Biofeedback training was performed on 18 adult patients suffered from SPFS-caused constipation using the instruments produced by Medtronic Company with the basic circuit voltage of 1.53 μV for about 20-minute relaxation exercises. The basic resting and stimulated voltages of external anal sphincter (EAS) were obtained by the anal electrode, and then compared using statistical analysis.
RESULTS: Based on the resting voltage and the voltage change of EAS during simulation, the SPFS-caused constipation was classified into 3 types: type Ⅰ was characterized with a high resting voltage and paradoxical activity of EAS (44.44%); type Ⅱ was characterized with a high resting voltage of EAS (33.33%); type Ⅲ was characterized with paradoxical activity of EAS (22.22%). The patients with high resting voltages covered a percentage of 77.77%. There existed significant differences among three types (P = 0.001).
CONCLUSION: High resting voltages and secondary paradoxical activity may be the mechanisms of SPFS-caused constipation. A significant decrease of resting voltage and inhibition of EAS paradoxical activity can be obtained through biofeedback training.
- Citation: Xiao YH, Liu ZL, Liu GL, Peng SL, Wang Z, Peng Z, Zang CB, Xia SY, Zhang YJ. Classification and pathophysiological mechanism of adult constipation caused by spastic pelvic floor syndrome in adults. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 767-771
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.767
盆底痉挛综合征型便秘病理特点的认识目前主要是描述性, 即模拟排便时肛管内括约肌压力或外括约肌整合电位不呈现下降趋势反而升高, 对其发生的病理生理机制未见明确阐述[1-3], 存在下述多种描述性的诊断, 如盆底协同困难、耻骨直肠肌矛盾收缩、耻骨直肠肌失弛缓综合征、梗阻性排便以及盆底出口梗阻等等[1,4]. 2005-03/2005-12我们对18例成人盆底痉挛综合征型便秘患者外括约肌静息电位以及模拟排便时外括约肌电位变化进行检测分析, 来探讨成人该型便秘的病理分型及其病理生理机制.
18例患者年龄26-76(平均50.72)岁, 男女比例为5:13, 经结肠传输试验、直肠肛门抑制反射检测以及钡灌肠等功能及形态学检测技术排除结肠慢传输、先天性无神经节细胞巨结肠以及直肠前突套叠等造成的便秘, 并通过5次模拟排便动作中3次以上出现外括约肌压力的升高来初步判定为盆底痉挛综合征型便秘[4].
选用Medtronic公司生产的胃肠功能测定仪(PC Polygraf HR)以及8通道螺旋形分布压力检测导管进行直肠肛门抑制反射及模拟排便外括约肌压力变化检测, 获得距离肛门3.5 cm范围内八个层面(各通道两两间隔45度、相距0.5 cm)括约肌反射及压力变化情况. 选用该公司生产的生物反馈训练仪以及肛门塞电极, 首先嘱患者进行全身心的放松练习, 持续时间约20 min记录静息电位的变化, 最终获得外括约肌基础静息电位值. 在医师的口令下嘱患者做5次模拟排便动作(不看生物反馈训练仪的动画屏幕), 通过统计学计算验证是否存在外括约肌的矛盾收缩运动. 医师详细的向患者阐述正常的排便动力以及其自身存在的病理性的排便模式, 并通过模拟排便时动画曲线的变化来解释正常及异常的排便动力, 嘱患者按照动画指示的正常排便动力曲线完成模拟排便动作(增加腹压同时主动放松肛门外括约肌). 在此训练过程中要适时地给患者以必要的语言指导以帮助他们进一步认识、并纠正错误的模拟排便动作, 鼓励他们完成正确的模拟排便动作. 每次的模拟排便持续时间为10 s, 放松时间为10 s, 6次排便及放松动作为一组, 训练组间休息时间为10 min. 根据患者是否出现主观的感觉疲劳以及肛门部是否出现肌肉的酸胀感, 以及外括约肌电位是否稳定于一个较低的数值或达到电静息水平[5](仅表现为电路的基础电压1.53 μV)来决定是否结束该次训练, 一般总的训练时间为1.5-2 h.
统计学处理 通过CHISS软件对不同便秘类型外括约肌静息电位进行正态性检验及方差分析, P<0.05认为存在显著性差异.
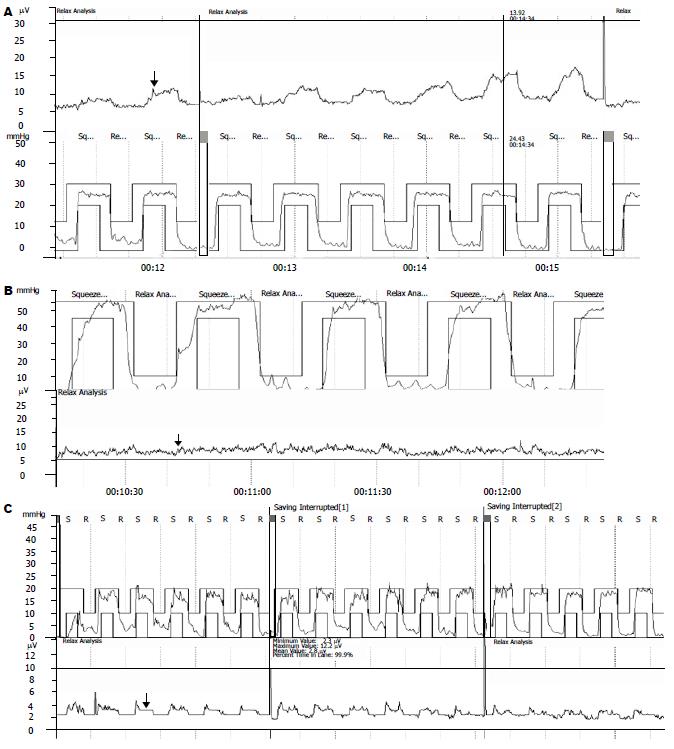
正常情况下, 肛门外括约肌静息电位及模拟排便时电位均不超过2 μV[6], 考虑到生物反馈训练仪电路的基础电压1.53 μV, 因此将外括约肌静息电位及模拟排便时电位超过3.53 μV判定为存在高静息电位以及模拟排便时外括约肌的矛盾收缩运动, 本研究发现成人盆底痉挛综合征型便秘患者存在三种病理分型(表1, 图1).
| 病理分型 | n | 比例(%) | 静息电位均数(μV) | 静息电位标准差(μV) |
| 高静息电位(Ⅰ)+矛盾运动 | 8 | 44.44 | 10.510 | 4.640 |
| 高静息电位(Ⅱ) | 6 | 33.33 | 4.251 | 0.551 |
| 矛盾运动(Ⅲ) | 4 | 22.22 | 2.504 | 0.301 |
外括约肌高静息电位总的发生率占该型便秘的77.77%. 各病理分型外括约肌静息电位之间两两比较均具有显著性差异(P = 0.001)(表1).
肛门外括约肌和耻骨直肠肌不同于一般的骨骼肌, 其中耐疲劳、保持持续张力性电活动的Ⅰ型纤维含量占78%, 而不耐疲劳、完成短时收缩活动的Ⅱ型纤维数量相对较少[7]. 正常静息状态下, 肛门外括约肌和耻骨直肠肌处于一种部分持续收缩状态, 与内括约肌持续张力性收缩协同维持肛管由近端向远端显著增大的静息张力梯度, 外括约肌由于肌纤维环状结构止点与作用位点的不同而对肛管不同层面产生直接方向压迫作用, 形成外括约肌的绞锁机制, 从而显著增强了静息状态下肛门的节制功能[8-13]. 外括约肌及耻骨直肠肌中Ⅰ型纤维保持一定的静息张力是Ⅱ型纤维完成一次收缩或反射活动的基础, 这是由排便和节制的脊髓低级反射中枢γ及α运动神经元对外括约肌及耻骨直肠肌Ⅰ, Ⅱ型进行神经支配, 以及脊髓上位各高级调节中枢, 如网状结构、小脑、大脑等对脊髓中枢活动进行综合调控的结果. 当机体由静息状态转为试图排便时, 大脑下达排便的指令, 网状结构下行兴奋性传导通路被抑制[14], 使脊髓前角γ运动神经元的电活动受到抑制, 进而使其支配的Ⅰ型纤维的张力性电活动减少, Ⅰ型纤维的本质是肌梭, 其发出的传入冲动减少, 无法达到α运动神经元的放电阈值[15], 因此无法激发后者所支配的Ⅱ型肌纤维的一次位相性收缩或反射活动; 实质上模拟排便的正常生理机制就是通过高级调控机制、低级中枢的反射机制使外括约肌和耻骨直肠肌Ⅰ型纤维的张力性电活动不断降低[16]、同时有效地抑制了Ⅱ型纤维可能出现的矛盾收缩运动. 盆底痉挛综合征型便秘生物反馈治疗的原理就在于上述排便和调控机制的全面康复过程. 在一个良好的指导者语言以及生物反馈动画协同指导下, 一个有良好意志力和理解力的个体能够使其肛门外括约肌和耻骨直肠肌完全放松, 以至于在示波器上找不到任何肌肉电活动[5], 如果不考虑本仪器的电路电压1.53 μv, 则一次训练授课最理想的状态应该是使外括约肌及耻骨直肠肌Ⅰ型纤维完全放松, 达到0电位的状态, 此时患者不仅感到大脑的主观疲劳, 而且有肛门部肌肉酸胀感, 其原因是肌肉由维持一定的紧张性收缩变成了完全放松状态, 实质上是处于被撑开的非自然状态, 此时盆底痉挛被完全解除, 包括Ⅰ型纤维的高静息张力以及Ⅱ型纤维可能出现的矛盾运动, 这也就是生物反馈训练治疗盆底痉挛综合征型便秘的原理所在.
盆底痉挛综合征型便秘Ⅰ型表现为外括约肌高静息电位以及模拟排便时外括约肌的矛盾运动, 其可能的病理生理机制在于此类患者静息状态下, 网状结构下行的兴奋性神经传导冲动较正常高, 使外括约肌Ⅰ型纤维处于一种高水平的电活动状态, 因此属于一种中枢调节的失调; 当患者试图排便时, 大脑高级中枢又发放了错误的命令, 即不是主动放松肛门外括约肌而是相反, 这样, 很容易出现外括约肌Ⅰ型纤维高静息电活动基础上的Ⅱ型纤维的一次位相性收缩活动, 即矛盾运动. 表现为脊髓前角γ运动神经元的电活动没有减少反而增加, 更容易激发α运动神经元的一次放电活动, 产生Ⅱ型纤维的一次位相性收缩活动, 表现为静息高电位水平上的矛盾运动(图1A). 盆底痉挛综合征型便秘Ⅱ型表现为外括约肌高静息电位, 模拟排便时并不表现为外括约肌的矛盾运动, 仅由外括约肌及耻骨直肠肌Ⅰ型纤维超过正常张力水平的电活动状态造成盆底出口的阻力, 仅属于一种中枢调节的失调而不存在中枢的错误命令. 并且其高静息电位水平显著小于Ⅰ型便秘患者, 其病理程度较后者轻微, 外括约肌Ⅰ型纤维高张力电活动尚未能达到α运动神经元的一次放电阈值因此未能激发其一次位相性收缩的矛盾运动而仅表现为高静息电位(图1B). 盆底痉挛综合征型便秘Ⅲ型表现为外括约肌的矛盾运动, 是否可以将其考虑为Ⅰ型中的一些特例, 原因是其脊髓前角α运动神经元的放电阈值低于一般水平, 以至于在外括约肌及耻骨直肠肌Ⅰ型纤维较低水平电活动的激发下也容易出现放电, 使其支配的Ⅰ型纤维出现反射性收缩活动, 即矛盾运动, 从而造成了排便时盆底阻力(图1C). 高静息电位在本组便秘中占77.77%, 说明了盆底痉挛综合征发病机制中外括约肌及耻骨直肠肌的高静息电位起到了主导作用, 其实质是脊髓上位高级中枢调节机制的失调, 而生物反馈能够有效减少这种异常的神经冲动, 从而使中枢的调节机制得到康复, 有效降低了外括约肌及耻骨直肠肌的高静息电位, 并消除在此基础上可能出现的矛盾运动. 因此, 对于盆底痉挛综合征Ⅰ型及Ⅲ型患者生物反馈训练中不仅要强调排便中枢调节机制的康复, 而且要鼓励激发患者的意志力使其主动纠正模拟排便时中枢发放的错误命令; 而对于Ⅱ型便秘训练的重点在于中枢调节机制的康复降低盆底肌的张力性电活动.
盆底痉挛综合征虽然表现为排便困难, 但由于其潜在的病理生理机制涉及的范围广泛, 因此需要多角度全方位进行研究, 特别是神经生理学、心理学的新成果对该型便秘的病理生理机制以及治疗的完善将起到积极的推动作用.
本文首次根据外括约肌静息电位及模拟排便是否存在外括约肌矛盾运动将盆底痉挛综合征型便秘分成3种病理类型, 并对各型的病理生理机制进行讨论, 得出外括约肌的高静息电位及在此基础上并发的外括约肌矛盾运动构成了该型便秘的病理生理机制, 生物反 馈的原理在于能够有效降低外括约肌的静息电位并消除可能出现的矛盾运动.
生物反馈: 指利用仪器设备(通常是电子设备)将人体某些内在的、正常的或异常的生理现象, 用可视或可听的信号形式表现出来, 其目的通过处理这些显示的信号教会个体如何处理这些生理事件. 如果不通过信号的形式予以表达, 对于这些正常或异常的生理现象人体不自知或感受不到的. 这项技术在开放的生物反 馈环中插入了人的意志力-因此被给予了生物反馈 的名字.
出口梗阻性便秘是由于肛管和直肠功能异常引起的排便过程不顺利, 为一种功能性疾病. 本文总体设计较科学合理, 数据充分, 结论可靠.
电编: 李琪 编辑:张焕兰
| 1. | 莫 平, 刘 宝华, 黄 彬鉴. 生物反馈训练治疗便秘的现状与展望. 国外医学·物理医学与康复医学分册. 2000;20:51-55. |
| 2. | Chiarioni G, Heymen S, Whitehead WE. Biofeedback therapy for dyssynergic defecation. World J Gastroenterol. 2006;12:7069-7074. [PubMed] |
| 3. | Wang J, Luo MH, Qi QH, Dong ZL. Prospective study of biofeedback retraining in patients with chronic idiopathic functional constipation. World J Gastroenterol. 2003;9:2109-2113. [PubMed] |
| 4. | Rao SS. Constipation: evaluation and treatment. Gastroenterol Clin North Am. 2003;32:659-683. [PubMed] |
| 5. | John V. Basmajian. Biofeedback principles and practice for clinicians. Second Edition, Baltimore: Williams Wilkins 1979; 275-281, 1-4. |
| 6. | Heymen S, Wexner SD, Vickers D, Nogueras JJ, Weiss EG, Pikarsky AJ. Prospective, randomized trial comparing four biofeedback techniques for patients with constipation. Dis Colon Rectum. 1999;42:1388-1393. [PubMed] |
| 7. | Lierse W, Holschneider AM, Steinfeld J. The relative proportions of type I and type II muscle fibers in the external sphincter ani muscle at different ages and stages of development-observations on the development of continence. Eur J Pediatr Surg. 1993;3:28-32. [PubMed] |
| 8. | Chang SM, Yu GR, Diao YM, Zhang MJ, Wang SB, Hou CL. Sacral anterior root stimulated defecation in spinal cord injuries: an experimental study in canine model. World J Gastroenterol. 2005;11:1715-1718. [PubMed] |
| 9. | Shafik A. A new concept of the anatomy of the anal sphincter mechanism and the physiology of defecation. The external anal sphincter: a triple-loop system. Invest Urol. 1975;12:412-419. [PubMed] |
| 10. | Williamson JL, Nelson RL, Orsay C, Pearl RK, Abcarian H. A comparison of simultaneous longitudinal and radial recordings of anal canal pressures. Dis Colon Rectum. 1990;33:201-206. [PubMed] |
| 11. | Xiao Y, Liu G. Quantitative evaluation of the anal sphincter by the tendency presented in the manometric asymmetry variations. Chin Med J (Engl). 2002;115:413-417. [PubMed] |
| 12. | Xiao YH, Liu GL. Manometric asymmetry of the anal sphincter: anatomic evidence and clinical application. Chin Med J (Engl). 2005;118:210-214. [PubMed] |
| 14. | Abysique A, Orsoni P, Bouvier M. Evidence for supraspinal nervous control of external anal sphincter motility in the cat. Brain Res. 1998;795:147-156. [PubMed] |
| 15. | Podnar S, Vodusek DB. Standardisation of anal sphincter EMG: high and low threshold motor units. Clin Neurophysiol. 1999;110:1488-1491. [PubMed] |