修回日期: 2006-11-30
接受日期: 2006-12-27
在线出版日期: 2007-03-08
目的: 观察日本血吸虫病肝纤维化小鼠肝脏肝组织核因子-κB(NF-κB)的活性和过氧化物酶体增殖物激活受体γ(PPARγ)的表达, 及PPARγ配体罗格列酮对其表达的影响.
方法: 50只昆明小鼠, 随机分为正常对照组、感染对照组、吡喹酮治疗组、罗格列酮治疗组及罗格列酮加吡喹酮治疗组. 除正常对照组外, 其余各组均建立血吸虫病肝纤维化小鼠模型. 用HE染色观察肝组织光镜下的病理改变. 用Western blot方法, 实时荧光定量PCR反应观察小鼠肝组织NF-κB的活性变化与PPARγ mRNA的表达.
结果: 罗格列酮加吡喹酮治疗组小鼠肝脏的炎性反应和纤维化病理改变较其他模型组轻(P<0.05). 感染对照组NF-κB活性(141.11±15.37)最强, 明显高于其余各组(正常对照组: 78.89±18.12; 吡喹酮组: 112.89±20.17; 罗格列酮组: 108.89±20.47; 罗格列酮加吡喹酮组: 88.89±19.34)(P<0.05). 感染对照组[-27.315±(-6.348)]及吡喹酮治疗组[-25.647±(-5.694)] PPARγ mRNA表达较正常对照组[-16.557±(-3.022)]及罗格列酮治疗组[-18.217±(-4.498)]、罗格列酮加吡喹酮治疗组[-18.212±(-3.909)]显著减弱(P<0.05).
结论: PPARγ及NF-κB在血吸虫病肝纤维化形成中起一定作用. PPARγ配体罗格列酮有明显的抗日本血吸虫病肝纤维化效应, 其抗纤维化机制与PPARγ配体激活PPARγ表达的同时抑制NF-κB的活性有关.
引文著录: 谌辉, 张景辉, 刘文琪, 贺永文. 罗格列酮对日本血吸虫病肝纤维化小鼠肝组织核因子-κB和过氧化物酶体增殖物激活受体γ表达的影响. 世界华人消化杂志 2007; 15(7): 741-745
Revised: November 30, 2006
Accepted: December 27, 2006
Published online: March 8, 2007
AIM: To investigate the effect of rosiglitazone on the binding activity of hepatic nuclear factor-kappa B (NF-κB) and the expression of peroxisome proliferator-activated receptor gamma (PPARγ) in mice with liver fibrosis caused by schistosoma japonicum infection.
METHODS: A total of 50 mice were randomly and averagely divided into group A, B, C, D and E. The mice in group A served as normal controls, while those in the other four groups were infected with schistosoma japonicum to induce the model of liver fibrosis. Besides, the mice in group C, D and E were treated with praziquantel, rosiglitazone, and praziquantel plus rosiglitazone, respectively. HE staining was used to observe the pathological changes of liver tissues under light microscope, and Western blot and real-time fluorescent quantitative polymerase chain reaction (RFQ-PCR) were performed to detect the activity of NF-κB and mRNA expression of PPARγ.
RESULTS: The inflammatory and fibrotic degrees were obviously alleviated in group E, which were the lightest among those groups with schistosomiasis (P < 0.05). The activity of NF-κB was the highest in group B (141.11 ± 15.37), significantly higher than that in group A, C, D and E (78.89 ± 18.12, 112.89 ± 20.17, 108.89 ± 20.47, 88.89 ± 19.34)(P < 0.05). The level of PPARγ mRNA was markedly higher in group A [-16.557±(-3.022)], D [-18.217±(-4.498)] and E [-18.212±(-3.909)] than that in group B [-27.315±(-6.348)] and C [-25.647±(-5.694)] (P < 0.05).
CONCLUSION: NF-κB and PPARγ may be involved in the pathogenesis of liver fibrosis due to schistosoma japonicum infection. Rosiglitazone, a ligand of PPARγ, is obviously effective in the treatment of this disease by up-regulating PPARγ expression and reducing NF-κB activity.
- Citation: Chen H, Zhang JH, Liu WQ, He YW. Effect of rosiglitazone on the activity of hepatic nuclear factor-kappa B and expression of peroxisome proliferator-activated receptor-γ in mice with liver fibrosis due to schistosoma japonicum infection. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 741-745
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/741.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.741
血吸虫性肝纤维化是晚期血吸虫病肝脏严重的病理改变, 目前国内外尚无理想的抗纤维化药物. 有文献报道过氧化物酶体增殖物激活受体γ(peroxisome proliferators activator receptors gamma, PPARγ)的配体, 有较好的抗肝纤维化作用[1]. 但其具体机制尚不完全清楚, 也未见其对血吸虫病肝纤维化的作用进行研究. 本文研究肝组织核因子-κB(NF-κB)和PPARγ在日本血吸虫病肝纤维化小鼠肝脏的表达, 及PPARγ配体罗格列酮对其表达的影响, 为PPARγ配体抗血吸虫病肝纤维化的作用机制提供参考资料.
昆明小鼠50只, 体质量16-22 g, 购于华中科技大学同济医学院动物实验中心. 随机分为5组, 每组10只, 除正常对照组外, 模型组均经皮感染日本血吸虫尾蚴40条. 罗格列酮片为葛兰素史克有限公司产品. 蛋白质分子量标准混合物(MBI公司预染的marker, 范围为21-118 kDa), NF-κB兔抗小鼠mAb(Santa Cruz公司), 碱性磷酸酶标记的山羊抗兔二抗(北京中山公司). PPARγ引物购自上海博亚生物技术有限公司, SYBR GreenⅠ荧光染料购自美国Biotium公司, TRIzol溶液购自美国GIBCO公司. PCR仪: 上海枫岭生物技术有限公司生产的FTC-2000型实时荧光定量PCR仪.
1.2.1 动物分组: (1)正常对照组: 常规喂养4 wk后灌服等量的生理盐水至10 wk末; (2)感染对照组: 感染尾蚴4 wk后灌服等量的生理盐水至10 wk末; (3)吡喹酮治疗组: 感染尾蚴4 wk后用吡喹酮500 mg/(kg•d)灌胃, 杀虫治疗2 d后改为等量的生理盐水灌胃治疗至10 wk末; (4)罗格列酮治疗组: 感染尾蚴4 wk后用罗格列酮4 mg/(kg•d)灌胃治疗至10 wk末. (5)罗格列酮加吡喹酮治疗组: 感染尾蚴4 wk后用吡喹酮灌胃(剂量同前)治疗2 d, 用罗格列酮4 mg/(kg•d)灌胃治疗至10 wk末. 最后断颈法处死小鼠, 取部分肝组织置液氮中保存备检, 另一部分置于甲醛中固定, 常规石蜡切片, HE染色作病理形态学观察.
1.2.2 组织病理学观察: 肝组织病理学检查采用世界卫生组织肝硬化分类及命名标准[2], 病理切片光镜检查记录肝纤维化程度. 低倍镜下观察, 每张切片随机取10个视野计平均值. " - "汇管区无明显肝纤维组织;" + "汇管区较多纤维组织增生, 局限;"+ + "汇管区有大量纤维组织增生,呈窄带状, 并向肝小叶伸展;"+ + + "汇管区大量纤维组织增生, 呈宽带状, 并伸展包绕肝小叶,且见中央静脉偏位现象.
1.2.3 肝组织核蛋白的提取: 肝组织匀浆, 过滤后4℃ 5000 r/min离心10 min, 弃上清液. 快速将沉淀的细胞重悬于200 μL的buffer A缓冲液中, 4℃ 5000 r/min离心10 min, 弃上清液. 将细胞重悬于100 μL的buffer C缓冲液中, 冰浴10 min. 4℃ 15 000 r/min离心20 min, 取上清液-70℃分装保存.
1.2.4 Western blot检测NF-κB活性: 考马斯亮兰G-250法测定蛋白浓度. 取核蛋白提取物20 μg进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE电泳), 转膜, 封闭, 加入一抗(NF-κB兔抗小鼠单克隆抗体)孵育. 洗涤后加入碱性磷酸酶标记的二抗(山羊抗兔抗体), 孵育, 充分洗涤, NBT/BCIP显色液显色, PBS终止. SPSS软件分析条带积分光密度值(A), 进行定量分析.
1.2.5 mRNA提取: 每份标本取100 mg组织加入玻璃匀浆器中, 加入TRIzol溶液1 mL提取总RNA, 以总RNA为模板, 逆转录合成cDNA.
1.2.6 实时荧光定量PCR反应检测PPARγ mRNA: 应用SYBR GreenⅠ荧光染料技术行实时定量PCR反应, 以适量cDNA为模板, 以磷酸甘油醛脱氢酶(GAPDH)为内参照, PCR扩增PPARγ基因片断. PPARγ引物设计, 上游: 5'-TTTCAAGGGTGCCAGTTTCG-3', 下游: 5'-TCTTTATTCATCAGGGAGGC-3'. GAPDH引物设计, 上游: 5'-GATGGTGAAGGTCGGTGTG-3', 下游: 5'-GAGGTCAATGAAGGGGTCG-3'. PCR反应参数: 预变性94℃ 5 min, 然后94℃变性30 s, 53℃退火30 s, 72℃延伸30 s, 共45个循环, 最后72℃延伸10 min. 在延伸的过程中搜集荧光信号. 于每次扩增的同时设置无cDNA的阴性对照, 将PCR产物做熔解曲线, 65℃, TOUCH-DOWN PCR, 每个循环温度上升0.2℃, 150个循环, 证实以上PCR反应产物特异性良好. 计算方法: 待测样品相对值 = 2ΔΔCt; ΔΔCt = ΔCt待测样品-ΔCtβ-actin; Ct = Ct阴性对照-Ct待测样品. 本实验统计ΔΔCt值以比较各组PPARγ mRNA的表达(表1).
统计学处理 采用SPSS11.5软件分析. 计量资料结果以均数±标准差(mean±SD)表示, 采用方差分析, 以P<0.05为差异有统计学意义. 病理切片分级程度按" - "、"+ "、"+ + "、"+ + + "分别计为0, 1, 2, 3, 用q值检验作方差分析.
血吸虫尾蚴感染组小鼠, 肝内汇管区及虫卵肉芽肿周围纤维增生明显, 大部分虫卵肉芽肿出现坏死病灶及纤维化, 肝血窦扩张充血, 细胞颗粒变性, 大量炎性细胞浸润. 吡喹酮治疗组及罗格列酮治疗组小鼠肝脏汇管区及肉芽肿内少量纤维组织增生, 肝细胞颗粒变性少, 可见炎性细胞浸润. 罗格列酮加吡喹酮治疗组肝脏病变更轻, 肝细胞排列清晰, 少量炎性细胞浸润, 肝脏汇管区及肉芽肿内纤维组织增生不明显. 肝纤维化程度比较: 感染对照组, 吡喹酮治疗组, 罗格列酮治疗组, 罗格列酮加吡喹酮治疗组各组q值分别为2.31±0.63, 1.49±0.77, 1.38±0.60, 及0.78±0.53. 罗格列酮加吡喹酮治疗组肝纤维化程度较其他模型组轻(P<0.05).
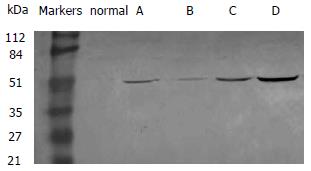
感染对照组NF-κB活性最强, 与其余各组比较均有显著性差异(P<0.05). 罗格列酮加吡喹酮治疗组和正常对照组NF-κB活性明显弱于其余各组(P<0.05), 此两组比较无显著性差异. 吡喹酮治疗组和罗格列酮治疗组NF-κB活性比较无显著性差异, 但均明显弱于感染对照组, 强于罗格列酮加吡喹酮治疗组和正常对照组(P<0.05, 表1, 图1).
感染对照组及吡喹酮治疗组PPARγ mRNA表达较正常对照组及罗格列酮治疗组、罗格列酮加吡喹酮治疗组显著减弱(P<0.05), 罗格列酮治疗组及罗格列酮加吡喹酮治疗组虽比正常对照组值低, 但差异无统计学意义(P>0.05, 表1).
PPARγ是一类由配体激活的核转录因子, 是重要的肝脏代谢功能调节分子, 其功能改变与一些肝脏疾病有相关性[3-5]. 众所周知, 肝星状细胞(hepatic stellate cell, HSC)的激活是肝纤维化发生发展的中心环节[6-8]. 最近研究证实, 静止状态人类HSC表达PPARγ, 而活化状态的HSC表达明显减少, PPARγ在维持HSC作为静止状态的表型上具有重要作用, PPARg表达减少与HSC激活密切相关[9-11]. 肝脏星状细胞活化时, PPARγ表达及其与PPAR反应元件结合成分减少. 用PPARγ配体可逆转这一反应, PPARγ与配体结合后被激活, 与 PPAR反应元件结合而发挥转录调控作用[12]. PPARγ及其配体在肝纤维化形成中的作用已成为肝纤维化研究领域里的一个新热点, 但其具体机制尚不完全清楚.
我们用日本血吸虫尾蚴感染小鼠建立肝纤维化模型, 在肝纤维化早期采用PPARγ配体罗格列酮治疗, 观察肝组织病理形态学变化, 显示罗格列酮可显著减轻肝脏纤维组织增生. 并通过检测PPARγ mRNA在各组小鼠肝组织的表达, 发现感染对照组及吡喹酮治疗组肝组织PPARγ mRNA表达较正常对照组显著减弱, 用PPARγ配体罗格列酮治疗可明显提高PPARγ mRNA的表达. NF-κB是一种具有转录激活功能的蛋白质, 细胞处于静止状态时, 与NF-κB抑制蛋白单体结合呈非活性状态. 当机体受到外界刺激时, 如氧化应激、细胞因子等, NF-κB即被激活, 与靶基因的κB序列结合启动基因转录. NF-κB作为一种重要的炎症前基因的急早期转录调控子, 在肝组织的炎症反应、氧化应激、细胞凋亡和再生中发挥者重要作用[13-14]. 最近研究显示, 在肝纤维化形成过程中, NF-κB通过对肝细胞, HSC和肝脏库弗氏细胞的调节, 对肝纤维化形成起重要调控作用. 研究发现, 静息状态下和新分离的HSC核内缺乏NF-κB, 而活化的、a-SMA阳性的HSC中出现了NF-κB的核转位活性, 同时有细胞间黏附分子, IL-6等基因的表达, 表明NF-κB可能参与了HSC激活的调节[15], 研究还发现, NF-κB具有抗HSC凋亡的作用[16]. 但目前NF-κB在HSC中的作用尚存在一定争议.
我们发现, 感染对照组小鼠肝脏NF-κB的活性显著高于正常对照组, 罗格列酮治疗后NF-κB的活性明显降低, 说明NF-κB参与了肝纤维化的形成, PPARγ配体罗格列酮能抑制NF-κB的活性. 另外, 本实验还显示, 吡喹酮治疗也能降低NF-κB的活性, 提示吡喹酮在驱虫治疗的同时减轻炎性反应而诱导一定的抗纤维化效应. 如果在驱虫治疗的同时应用有效的抗纤维化药物治疗能提高血吸虫病肝纤维化治疗的疗效.
总之, PPARγ及NF-κB在血吸虫病肝纤维化形成中起一定作用. PPARγ配体罗格列酮有明显的抗日本血吸虫病肝纤维化效应, 其抗纤维化机制与PPARγ配体激活PPARγ表达的同时抑制NF-κB的活性, 从而抑制HSC的激活有一定关系.
血吸虫病肝纤维化是晚期血吸虫病肝脏严重的病理改变, 目前国内外尚无理想的抗纤维化药物. PPARγ是一类由配体激活的核转录因子, 其功能改变与一些肝脏疾病有相关性. PPARγ与配体结合后被激活, 在肝纤维化形成中的作用已成为肝纤维化研究领域里的一个新热点, 但其具体机制尚不完全清楚, 但亟待解决.
本文首次研究了NF-κB和PPARγ在日本血吸虫病肝纤维化小鼠肝脏的表达, 及PPARγ配体罗格列酮对其表达的影响. 目前, 国内外尚未见PPARγ及其配体对血吸虫病肝纤维化的作用进行研究.
本研究证实PPARγ配体罗格列酮有明显的抗日本血吸虫病肝纤维化效应, 为抗血吸虫病肝纤维化治疗的进一步研究提供新的思路和途径.
本文研究PPARγ配体罗格列酮对血吸虫病肝纤维化的影响, 为 PPARγ配体抗血吸虫病肝纤维化作用机制提供参考资料. 文章目明确, 设计合理, 方法正确, 结果可信.
电编: 李琪 编辑:王晓瑜
| 1. | Yuan GJ, Zhang ML, Gong ZJ. Effects of PPARg agonist pioglitazone on rat hepatic fibrosis. World J Gastroenterol. 2004;10:1047-1051. [PubMed] |
| 2. | Anthony PP, Ishak KG, Nayak NC, Poulsen HE, Scheuer PJ, Sobin LH. The morphology of cirrhosis. Recommendations on definition, nomenclature, and classification by a working group sponsored by the World Health Organization. J Clin Pathol. 1978;31:395-414. [PubMed] |
| 3. | Inoue M, Ohtake T, Motomura W, Takahashi N, Hosoki Y, Miyoshi S, Suzuki Y, Saito H, Kohgo Y, Okumura T. Increased expression of PPARgamma in high fat diet-induced liver steatosis in mice. Biochem Biophys Res Commun. 2005;336:215-222. [PubMed] |
| 4. | Berkenstam A, Gustafsson JA. Nuclear receptors and their relevance to diseases related to lipid metabolism. Curr Opin Pharmacol. 2005;5:171-176. [PubMed] |
| 5. | Yang L, Chan CC, Kwon OS, Liu S, McGhee J, Stimpson SA, Chen LZ, Harrington WW, Symonds WT, Rockey DC. Regulation of peroxisome proliferator-activated receptor-gamma in liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2006;291:G902-G911. [PubMed] |
| 6. | Bartley PB, Ramm GA, Jones MK, Ruddell RG, Li Y, McManus DP. A contributory role for activated hepatic stellate cells in the dynamics of Schistosoma japonicum egg-induced fibrosis. Int J Parasitol. 2006;36:993-1001. [PubMed] |
| 9. | Zheng S, Chen A. Activation of PPARgamma is required for curcumin to induce apoptosis and to inhibit the expression of extracellular matrix genes in hepatic stellate cells in vitro. Biochem J. 2004;384:149-157. [PubMed] |
| 11. | Sung CK, She H, Xiong S, Tsukamoto H. Tumor necrosis factor-alpha inhibits peroxisome proliferator-activated receptor gamma activity at a posttranslational level in hepatic stellate cells. Am J Physiol Gastrointest Liver Physiol. 2004;286:G722-G729. [PubMed] |
| 12. | Kawaguchi K, Sakaida I, Tsuchiya M, Omori K, Takami T, Okita K. Pioglitazone prevents hepatic steatosis, fibrosis, and enzyme-altered lesions in rat liver cirrhosis induced by a choline-deficient L-amino acid-defined diet. Biochem Biophys Res Commun. 2004;315:187-195. [PubMed] |
| 13. | Dela Pena A, Leclercq I, Field J, George J, Jones B, Farrell G. NF-kappaB activation, rather than TNF, mediates hepatic inflammation in a murine dietary model of steatohepatitis. Gastroenterology. 2005;129:1663-1674. [PubMed] |
| 14. | Lv P, Luo HS, Zhou XP, Chireyath Paul S, Xiao YJ, Si XM, Liu SQ. Thalidomide prevents rat liver cirrhosis via inhibition of oxidative stress. Pathol Res Pract. 2006;202:777-788. [PubMed] |
| 15. | Muhlbauer M, Weiss TS, Thasler WE, Gelbmann CM, Schnabl B, Scholmerich J, Hellerbrand C. LPS-mediated NFkappaB activation varies between activated human hepatic stellate cells from different donors. Biochem Biophys Res Commun. 2004;325:191-197. [PubMed] |