修回日期: 2007-01-01
接受日期: 2007-01-18
在线出版日期: 2007-03-08
目的: 研究食管癌中肿瘤特异性抗原MAGE-A1, Ki-67的表达及其相关性, 探讨他们与食管癌生物学行为及生存时间的关系.
方法: 免疫组化SP法, 利用鼠抗人MAGE-A1, Ki-67单克隆抗体检测60例食管癌标本中MAGE-A1, Ki-67表达水平.
结果: 60例食管癌中MAGE-A1表达率为83.3%(50/60), 高表达率为10%(6/60), 低表达率为73.3%(44/60), 正常组织表达率为0%, 食管癌和正常组织之间的表达具有显著性差异(P<0.001). Ki-67表达率为93.3%(56/60), 高表达率为70%(42/60), 低表达率为23.3%(14/60), 正常组织表达率为13.3%(4/30), 食管癌和正常组织之间的表达具有显著性差异(P<0.001). MAGE-A1与分化程度有关(P<0.05), Ki-67与年龄、分化程度、病理类型有关(P<0.05). MAGE-A1阳性表达的高低与Ki-67阳性表达的高低呈负相关(r = -2.91, P<0.05). MAGE-A1阳性患者的生存时间明显高于阴性者.
结论: MAGE-A1在食管癌中有较高的表达, 并且与细胞增殖相关, 正常组织不表达, MAGE-A1阳性患者的预后好, 有望作为免疫治疗的靶点.
引文著录: 李佳, 潘林娜, 张志燕, 李曼. MAGE-A1在食管癌中的表达及其与肿瘤细胞增殖的关系. 世界华人消化杂志 2007; 15(7): 706-711
Revised: January 1, 2007
Accepted: January 18, 2007
Published online: March 8, 2007
AIM: To investigate the expression of melanoma antigen A1 (MAGE-A1) and Ki-67 in esophageal cancer (EC) and their correlations with the clinical pathological features and survival time of EC patients.
METHODS: The expression of MAGE-A1 and Ki-67 was detected by SP immunohistochemical technique using mouse anti-human MAGE-A1 and Ki-67 antibodies in formalin-fixed and paraffin-embedded sections from 60 EC patients.
RESULTS: The positive rate of MAGE-A1 expression was 83.3% (50/60) in EC, with a high expression rate of 10% (6/60) and low expression rate of 73.3% (44/60), while the positive rate of MAGE-A1 expression was 0% in the normal esophageal tissues, significantly lower than that in EC tissues (P < 0.001). The positive rate of Ki-67 expression was 93.3% (56/60) in EC, with a high expression rate of 70% (42/60) and low expression rate of 23.3% (14/60), while the positive rate of Ki-67 expression was 13.3% (4/30) in esophageal normal tissues, significantly lower than that in EC tissues (P < 0.001). There was a negative correlations between the positive expression of MAGE-A1 and Ki-67 (r = -2.91, P < 0.05). Besides, MAGE-A1 expression was also correlated with the differentiation degrees of carcinoma (P < 0.05), and Ki-67 expression was correlated with the age of patients, differentiation degrees and pathological type of carcinoma (P < 0.05). The survival time was higher for patients with the positive expression of MAGE-A1 than that for patients with the negative MAGE-A1 expression (P < 0.05).
CONCLUSION: MAGE-A1 is highly expressed in EC patients, which is correlated with the proliferation of tumor cells. The patients with positive MAGE-A1 expression have a favorable prognosis.
- Citation: Li J, Pan LN, Zhang ZY, Li M. Expression of melanoma antigen A1 and its relationship with tumor cell proliferation in esophageal carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 706-711
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/706.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.706
恶性肿瘤的治疗研究一直是医学界的重要课题, 食管癌在我国是高发的恶性肿瘤, 其恶性程度较高, 患者生存期较短, 现有的治疗方法如常规的手术、放疗、化疗等疗效不好, 因此建立特异的肿瘤免疫疗法, 作为一种辅助治疗手段有助于推动肿瘤的治疗研究, 黑色素瘤抗原基因(melanoma antigen, MAGE)由于其表达产物具有较高的肿瘤特异性成为当前研究肿瘤学的热点. 1991年van der Bruggen et al[1]使用基因转染技术发现了黑色素瘤细胞系上的MAGE-A1基因, 该MAGE基因是肿瘤特异性抗原基因, 只在各种不同组织类型的肿瘤组织中表达, 在正常组织(除胎盘组织和男性生殖细胞)不表达[2-10]. MAGE基因编码的抗原可以与HLA(人类白细胞抗原)的Ⅰ类分子结合, 被CTL(细胞毒T淋巴细胞)特异识别, 产生CTL对肿瘤细胞的特异杀伤作用[11-12]. Ki-67是一种与细胞增殖密切相关的核内蛋白. 因其只表达于增殖细胞各期中, 静止期细胞阴性, 并具有半衰期短的特点, 而被作为评价细胞生长分数的有效指标, Rose et al[13]比较数种增殖标志物, 认为Ki-67抗体较适合作为常规的免疫组化研究, 目前Ki-67广泛应用于临床及基础研究.
本课题通过检测人食管癌(esophageal cancer)石蜡标本及食管正常组织中MAGE-A1蛋白与Ki-67蛋白表达状况, 研究MAGE-A1的表达与肿瘤增殖程度及机体的抗肿瘤免疫状态之间的相关性, 初步探讨MAGE-A1基因在此方面可能具有的调控或影响机制.
经病理检查确诊食管癌标本(取自哈尔滨医科大学附属肿瘤医院2002年存档蜡块)60例, 男58例, 女2例, 年龄43-70(中位57.73)岁, 按组织学分级: 低分化20例, 中分化24例, 高分化16例. 30例食管正常黏膜作为对照. 所有标本均经中性甲醛固定、石蜡包埋, 4 μm切片用于HE染色和免疫组化染色. MAGE-A1鼠抗人单克隆抗体(LAB VISION公司), Ki-67鼠抗人单克隆抗体(福州迈新生物技术开发有限公司), MaxvisionTM试剂盒(福州迈新生物技术开发有限公司).
1.2.1 免疫组化SP法: 具体步骤参照试剂盒说明书进行.
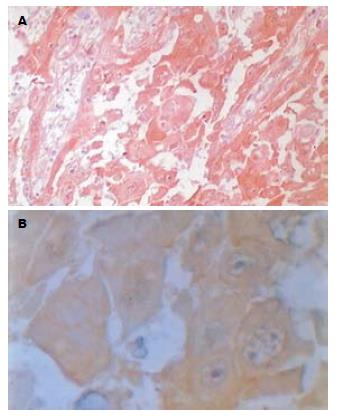
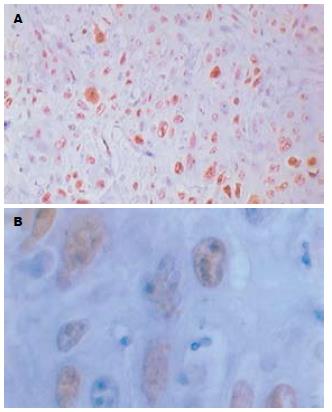
1.2.2 免疫组化结果判断: (1)MAGE-A1: 以细胞质内出现棕黄色颗粒为阳性. 其免疫反应分数(immunoreactive score, INS)参照Soslow et al[14]标准略加修改. 免疫反应分数根据染色强度(percentage of positive cell, PP)来判定, 即IRS = SI×PP. SI: 0分为无色, 1分为浅黄色, 2分为棕黄色, 3分为棕褐色; PP: 0分为阴性, 1分为阳性细胞≤10%, 2分为11%-50%, 3分为51%-100%; IRS = 0为阴性, ≤3分为低表达, >3分为高表达; 双盲法观察组织切片全部视野, 采用半定量积分法[15]判断结果: 首先确定阳性定位, 然后按照下面的标准进行评分, ①阳性细胞数: ≤5%为0分, 6%-25%为1分, 26%-50%为2分, 51%-75%为3分, >76%为4分; ②阳性强度: 无色为0分, 淡黄色为1分, 黄色为2分, 棕黄色为3分. 将①②两者积分相乘, 0分为阴性, >0分为阳性. (2) Ki-67: 以细胞核内有棕黄色颗粒为阳性. 参考Mehdi et al[16]方法, 随机选10个视野, 每个视野(放大400倍)计数100个细胞, 共计1000个细胞. 计算出每张切片上阳性细胞百分数, 阳性细胞所占百分比<1%为阴性, ≤25%为低表达, 阳性细胞所占百分比>25%为高表达. 参照文献[17]制定免疫组化半定量标准每张切片随机观察5个高倍视野, 每个视野计数100个肿瘤细胞, 阳性细胞数<10%为阴性, ≥10%为阳性.
统计学处理 采用SPSS13.0 for Windows统计学软件. 统计学分析用两独立样本比较的秩和检验、chi-square分析、相关性分析采用Spearman秩相关检验.
MAGE-A1蛋白阳性部位定位于肿瘤细胞胞质, 其染色强度从浅黄色到棕黄色不等(图1). 周围正常组织和肿瘤间质无MAGE-A1表达. MAGE-A1阳性表达率83.3%(50/60), 高表达率为10%(6/60), 低表达率为73.3%(44/60). 平均秩为56.50, 正常组织表达率为0%, 平均秩为23.50, MAGE-A1在食管癌和正常组织之间的表达有显著性差异(bP<0.001, 表1). Ki-67蛋白表达于胞核, 呈棕黄色. 腺癌及鳞癌癌巢周边部位Ki-67阳性细胞比其中心部位的更密集(图2). 阳性表达率为93.3%(56/60), 高表达率为70%(42/60), 低表达率为23.3%(14/60). 平均秩(Mean Rank)为58.43, 正常组织表达率为13.3%(4/30), 平均秩(Mean Rank)为19.53, Ki-67在食管癌和正常组织中的表达有显著性差异(bP<0.001, 表1).
采用chi-square分析发现, MAGE-A1的表达强度与食管癌患者分化程度有明显相关性(P<0.05), 其中低分化与高分化组、中分化与高分化组间的表达有显著性差异, Ki-67的表达强度与食管癌患者年龄(P<0.001)、病理(P<0.05)、分化程度(P<0.001)有明显相关性, 其中分化程度中低分化与中分化组, 低分化与高分化组间表达有显著性差异(表2).
采用Spearman秩相关检验发现, 食管癌中MAGE-A1和Ki-67两者的表达有相关关系, 并且为负相关关系(r = -2.91, P<0.05, 表3).
| Ki-67的表达 | n | MAGE-A1 的表达 | r | P | ||
| 阴性(n) | 低表达(n) | 高表达(n) | ||||
| 阴性 | 4 | 0 | 4 | 0 | -2.91 | 0.024 |
| 低表达 | 14 | 2 | 10 | 2 | ||
| 高表达 | 42 | 8 | 30 | 4 | ||
利用SPSS13.0软件, 根据患者生存时间及生存状态(由于食管癌患者生存时间较短, 此次主要比较3 年生存率, 两个因素采用阴性、阳性分类方法)做生存曲线. MAGE-A1阴性16例, 平均生存期16.125 mo, 中位生存时间15 mo, 阳性44例, 平均生存期23.386 mo, 中位生存时间20 mo(Log Rank = 4.70, P<0.05), MAGE-A1阴性、阳性对食管癌患者生存时间的影响有显著性差异. Ki-67生存曲线分析(Log Rank = 0.4, P>0.05), 尚不能认为Ki-67阴性、阳性对食管癌患者的远期生存的影响有显著性差异.
把各个临床因素分别作生存曲线分析, 发现年龄、分期、淋巴结转移对食管癌患者的远期生存时间的影响均有显著性差异, 把这些有意义的因素作为协变量运用逐步回归法进行筛选(95%可信区间, 筛选水平 = 0.05), 进行cox模型分析(表4), 从此复合多因素的结果看, 只有年龄P>0.05, 其余3者P<0.05, 是否可以认为把4者综合考虑, 年龄没有其他3者对患者生存的影响大. 其他因素, 如病理类型、分化程度等作为独立的因素影响食管癌患者的生存时间尚未构成统计学上的差异.
| B | SE | Wald | df | Sig. | Exp(B) | 95.0% CI for Exp(B) | ||
| Lower | Upper | |||||||
| MAGE-A1 | -1.200 | 0.358 | 11.249 | 1 | 0.001 | 0.301 | 0.149 | 0.607 |
| 年龄 | 0.000 | 0.020 | 0.000 | 1 | 1.000 | 1.000 | 0.962 | 1.039 |
| TNM 分期 | 1.029 | 0.299 | 11.815 | 1 | 0.001 | 2.798 | 1.556 | 5.032 |
| 淋巴结转移 | 1.043 | 0.378 | 7.603 | 1 | 0.006 | 2.836 | 1.352 | 5.951 |
人类MAGE(melanoma anigen)基因家族包含23个成员, MAGE-A1是MAGE家族中最早发现的基因, 其编码的蛋白产物在细胞质内被蛋白水解酶裂解, 形成两个可以被递呈系统识别的与MHC分子HLA-A1和HLA-Cw16.01结合的肽段, 由抗原加工相关转运物(transporter associated with antigen processing, TAP)转送至内质网后, 与HLA-I类分子结合形成复合物, 被递呈至细胞表面, 自体细胞毒性T淋巴细胞(CTL)通过识别抗原肽和HLA-I类分子复合体, 诱导特异性免疫杀伤肿瘤细胞效应[18-26], 除MAGE-D基因在人体正常成熟组织普遍表达外, 其他MAGE基因编码产物则在许多恶性肿瘤组织中有较高的表达, 但是在正常组织(除了睾丸和胎盘外)均不表达, 通过RT-PCR技术检测发现, 人类半数以上各种组织来源的恶性肿瘤中均至少表达一种MAGE基因, 但癌旁组织鲜见表达. 因而MAGE抗原肽是一种CTL介导的肿瘤特异性免疫治疗的理想靶分子.
本实验检测MAGE-A1在食管癌中的表达情况, 据相关文献报道, MAGE-A1在食管癌中表达的阳性率为62%[27], 53%[28]. 本结果显示MAGE-A1在食管癌中表达阳性率高(83.3%), 在正常组织中不表达, 这种差异的可能原因是所采标本的病期不同, 因为在食管癌不同发展阶段中肿瘤抗原表达可能不同, 也可能是本实验例数少产生一定的误差, 本结果提示在食管癌现有治疗方法不好的基础上, 有望利用MAGE-A1编码抗原作为食管癌免疫治疗攻击靶点并且可覆盖多数病例, 并有较好的特异性, 值得尝试. van der Bruggen et al[1]在研究中发现, MAGE-1基因阳性表达的黑色素瘤细胞系也必须同时表达HLA-A1, 才能诱发CTL细胞的杀伤作用, 否则不能激活CTL细胞. 可通过在体外合成MAGE编码蛋白与HLA-I类分子结合成多肽复合物用于临床抗肿瘤免疫治疗. Marchand et al[29]的临床尝试性实验均证实了MAGE抗原用于免疫治疗无明显副作用, 能有效刺激机体的免疫系统, 发挥一定的抗癌作用. 因此选用适当的病例, 应用MAGE基因家族的表达产物对恶性肿瘤患者进行免疫治疗, 将具有重要的临床应用价值和广阔的应用前景.
MAGE-A1和Ki-67的表达之间具有负相关性(r = -2.91, P<0.05), 表明MAGE-A1阳性表达的肿瘤细胞比其阴性表达者可能具有较低增殖活性; MAGE-A1高表达的肿瘤细胞没有其低表达的增殖旺盛, 这提示MAGE-A1在肿瘤组织的增殖调控方面可能具有重要作用. 有研究认为, MAGE家族中的MAGE-B4[30]也可能在细胞周期调控中发挥重要作用, 推测该家族基因并不仅仅作为肿瘤特异性抗原存在, 他和组织细胞的正常增殖、分化也有非常密切的关系. 我们认为, MAGE-A1表达和肿瘤细胞增殖之间可能具有某种负调控关系. 肿瘤组织中MAGE-A1基因甲基化程度增加, 致使MAGE-A1高表达是否导致肿瘤细胞增殖活性的下调, 还是肿瘤细胞的高增殖状态诱发MAGE-A1基因高甲基化程度增加, 致使MAGE-A1高表达目前尚无定论. 另外, Ki-67阳性细胞在鳞癌癌巢外周部位比中心部位分布更密集, 提示外周的癌细胞具有更高的增殖活性.
本实验还表明MAGE-A1的表达和分化程度有相关性, Ki-67的表达与年龄、病理类型、分化程度有相关性. 对MAGE-A1和Ki-67阴性、阳性作生存曲线并进一步进行的生存分析, MAGE-A1阴性、阳性对食管癌患者生存时间的影响有显著性差异, 与Zambon et al[31]报道一致, 其报道48例食管癌中不表达任何基因的患者组(23例, 48%)平均生存期22 mo, 而表达一种或多种MAGE基因的患者组(17例, 35%)平均生存期57 mo, 明显高于抗原阴性者, 推测其原因, 可能是由于MAGE抗原阳性的患者体内存在识别自体肿瘤细胞的CTL, 肿瘤细胞被特异性CTL识别杀伤, 从而减少或延缓了肿瘤的复发与转移, 而MAGE抗原阴性的肿瘤细胞不被CTL识别杀伤, 肿瘤易复发转移, 生存率也相对低. 进一步的多因素cox回归生存分析结果显示, MAGE-A1、TNM分期、淋巴结转移对生存时间的影响有意义, 提示能否把他们考虑为影响预后的独立作用因素.
总之, 合并MAGE-A1的各方面优势, 其作为免疫治疗的靶点并进行进一步的研究值得尝试.
恶性肿瘤是当代威胁人类健康的最严重的疾病, 具有病期越晚治疗越难, 预后越差的特点, 因此寻找肿瘤特异性抗原(tumor-specific antigen, TSA)对于肿瘤的早期发现、早期诊断、早期治疗非常重要. 黑色素瘤抗原(MAGE) 是首先从黑色素瘤中发现的, 其在正常组织中几乎不表达, 主要表达于以 黑色素瘤为主的恶性肿瘤组织中, MAGE-A1是第一个发现的黑色素瘤抗原, 其表达和肿瘤的发生、发展及预后关系十分密切, 黑色素瘤抗原及其产物可用于肿瘤的分子学诊断和免疫治疗.
对于包括MAGE在内的肿瘤特异性抗原的研究目前还处于探索阶段. 目前应用MAGE基因编码的抗原肽进行临床免疫治疗多仅限于黑色素瘤, 而对其他类型的肿瘤能否产生同等水平的疗效尚在动物实验和临床观察阶段. 随着人类基因工程的逐渐完成, 编码蛋白质的基因序列将被全部解析, 利用已知序列、结构的抗原多肽进行的抗肿瘤生物预防和治疗技术, 对肿瘤患者的治疗及高危人群的预防将是最终的成熟的方法.
Marchand et al的临床尝试性实验 均证实了MAGE抗原用于免疫治疗无明显副作用, 能有效刺激机体的免疫系统, 发挥一定的抗癌作用.因此选用适当的病例, 应用MAGE基因家族的表达产物对恶性肿瘤患者进行免疫治疗, 将具有重要的临床应用价值和广阔的应用前景.
本实验在探讨MAGE-A1在肿瘤组织中的表达, 同以前的研究进行对比, 证实其作为免疫治疗靶点的可行性外, 还研究了MAGE-A1和Ki-67的表达之间的关系, 提示MAGE-A1在肿瘤组织的增殖调控方面可能具有重要作用. 进一步的生存分析也在提示患者预后方面做了详细的阐述.
MAGE-A1在肿瘤特异性免疫治疗中具有特异性靶位的潜在价值, 对基因治疗和免疫治疗的探索可以产生深远的影响. 还可以制成基因芯片, 进行免疫监视和免疫检测, 可监视肿瘤细胞的浸润生长状态, 以采取合适的干预措施, 在分子病理学诊断中的作用也不容忽视.
瘤特异性抗原(tumor special antigen, TSA): 是瘤细胞特有的或只存在于某些瘤细胞而不存在于正常细胞的新抗原. 这类抗原是人们于1950年代末在遗传背景基本相同的小鼠 (可排除正常组织相容性抗原的影响) 即同系小鼠中通过移植排异的实验方法发现的.
本文研究了MAGE-A1在食管癌中的表达及其与肿瘤细胞增殖的关系, 有一定新颖性, 设计科学, 结论可靠
电编: 张敏 编辑:王晓瑜
| 1. | van der Bruggen P, Traversari C, Chomez P, Lurquin C, De Plaen E, Van den Eynde B, Knuth A, Boon T. A gene encoding an antigen recognized by cytolytic T lymphocytes on a human melanoma. Science. 1991;254:1643-1647. [PubMed] |
| 2. | Eura M, Chikamatsu K, Ogi K, Nakano K, Masuyama K, Ishikawa T. Expression of genes MAGE-1, -2, and -3 by human maxillary carcinoma cells. Anticancer Res. 1995;15:55-59. [PubMed] |
| 3. | Chen CH, Huang GT, Lee HS, Yang PM, Yan MD, Chen DS, Sheu JC. High frequency of expression of MAGE genes in human hepatocellular carcinoma. Liver. 1999;19:110-114. [PubMed] |
| 4. | Brasseur F, Marchand M, Vanwijck R, Herin M, Lethe B, Chomez P, Boon T. Human gene MAGE-1, which codes for a tumor-rejection antigen, is expressed by some breast tumors. Int J Cancer. 1992;52:839-841. [PubMed] |
| 5. | Shichijo S, Tsunosue R, Masuoka K, Natori H, Tamai M, Miyajima J, Sagawa K, Itoh K. Expression of the MAGE gene family in human lymphocytic leukemia. Cancer Immunol Immunother. 1995;41:90-103. [PubMed] |
| 6. | Inoue H, Mori M, Honda M, Li J, Shibuta K, Mimori K, Ueo H, Akiyoshi T. The expression of tumor-rejection antigen "MAGE" genes in human gastric carcinoma. Gastroenterology. 1995;109:1522-1525. [PubMed] |
| 7. | Gajjar NA, Cochran AJ, Binder SW. Is MAGE-1 expression in metastatic malignant melanomas really helpful? Am J Surg Pathol. 2004;28:883-888. [PubMed] |
| 8. | Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G. T-cell recognition of melanoma-associated antigens. J Cell Physiol. 2000;182:323-331. [PubMed] |
| 10. | 周 迈, 彭 吉润, 王 红霞, 钟 朝辉, 郭 晏同, 潘 秀英, 冷 希圣. 利用质谱技术对肝癌组织中自然呈递的MAGE表位进行鉴定. 世界华人消化杂志. 2005;13:1395-1399. [DOI] |
| 11. | Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G. T-cell recognition of melanoma-associated antigens. J Cell Physiol. 2000;182:323-331. |
| 12. | Gaugler B, Van den Eynde B, van der Bruggen P, Romero P, Gaforio JJ, De Plaen E, Lethe B, Brasseur F, Boon T. Human gene MAGE-3 codes for an antigen recognized on a melanoma by autologous cytolytic T lymphocytes. J Exp Med. 1994;179:921-930. [PubMed] |
| 13. | Rose DS, Maddox PH, Brown DC. Which proliferation markers for routine immunohistology? A comparison of five antibodies. J Clin Pathol. 1994;47:1010-1014. [PubMed] |
| 14. | Soslow RA, Dannenberg AJ, Rush D, Woerner BM, Khan KN, Masferrer J, Koki AT. COX-2 is expressed in human pulmonary, colonic, and mammary tumors. Cancer. 2000;89:2637-2645. [PubMed] |
| 15. | 曹 立宇, 张 洪福, 龚 西騟, 孟 刚. 大肠肿瘤中p53和bcl-2蛋白的表达. 临床与实验病理学杂志. 2000;16:214. |
| 16. | Mehdi SA, Etzell JE, Newman NB, Weidner N, Kohman LJ, Graziano SL. Prognostic significance of Ki-67 immunostaining and symptoms in resected stage I and II non-small cell lung cancer. Lung Cancer. 1998;20:99-108. [PubMed] |
| 18. | Hu X, Chakraborty NG, Sporn JR, Kurtzman SH, Ergin MT, Mukherji B. Enhancement of cytolytic T lymphocyte precursor frequency in melanoma patients following immunization with the MAGE-1 peptide loaded antigen presenting cell-based vaccine. Cancer Res. 1996;56:2479-2483. [PubMed] |
| 19. | Ottaviani S, Zhang Y, Boon T, van der Bruggen P. A MAGE-1 antigenic peptide recognized by human cytolytic T lymphocytes on HLA-A2 tumor cells. Cancer Immunol Immunother. 2005;54:1214-1220. [PubMed] |
| 20. | Liu G, Ying H, Zeng G, Wheeler CJ, Black KL, Yu JS. HER-2, gp100, and MAGE-1 are expressed in human glioblastoma and recognized by cytotoxic T cells. Cancer Res. 2004;64:4980-4986. [PubMed] |
| 21. | Yu JS, Liu G, Ying H, Yong WH, Black KL, Wheeler CJ. Vaccination with tumor lysate-pulsed dendritic cells elicits antigen-specific, cytotoxic T-cells in patients with malignant glioma. Cancer Res. 2004;64:4973-4979. [PubMed] |
| 22. | Ringhoffer M, Muller CR, Schenk A, Kirsche H, Schmitt M, Greiner J, Gschwend JE. Simultaneous expression of T-cell activating antigens in renal cell carcinoma: implications for specific immunotherapy. J Urol. 2004;171:2456-2460. [PubMed] |
| 23. | Corbiere V, Nicolay H, Russo V, Stroobant V, Brichard V, Boon T, van der Bruggen P. Identifica-tion of a MAGE-1 peptide recognized by cytolytic T lymphocytes on HLA-B*5701 tumors. Tissue Antigens. 2004;63:453-457. [PubMed] |
| 24. | Kobayashi T, Lonchay C, Colau D, Demotte N, Boon T, van der Bruggen P. New MAGE-4 antigenic peptide recognized by cytolytic T lymphocytes on HLA-A1 tumor cells. Tissue Antigens. 2003;62:426-432. [PubMed] |
| 25. | Grobholz R, Verbeke CS, Schleger C, Kohrmann KU, Hein B, Wolf G, Bleyl U, Spagnoli GC, Coplan K, Kolb D. Expression of MAGE antigens and analysis of the inflammatory T-cell infiltrate in human seminoma. Urol Res. 2000;28:398-403. [PubMed] |
| 26. | Yamada A, Kawano K, Harashima N, Niiya F, Nagai K, Kobayashi T, Mine T, Ushijima K, Nishida T, Itoh K. Study of HLA class I restriction and the directed antigens of cytotoxic T lymphocytes at the tumor sites of ovarian cancer. Cancer Immunol Immunother. 1999;48:147-152. [PubMed] |
| 27. | Inoue H, Mori M, Li J, Mimori K, Honda M, Nakashima H, Mafune K, Tanaka Y, Akiyoshi T. Human esophageal carcinomas frequently express the tumor-rejection antigens of MAGE genes. Int J Cancer. 1995;63:523-526. [PubMed] |
| 28. | Quillien V, Raoul JL, Heresbach D, Collet B, Toujas L, Brasseur F. Expression of MAGE genes in esophageal squamous-cell carcinoma. Anticancer Res. 1997;17:387-391. [PubMed] |
| 29. | Marchand M, Weynants P, Rankin E, Arienti F, Belli F, Parmiani G, Cascinelli N, Bourlond A, Vanwijck R, Humblet Y. Tumor regression responses in melanoma patients treated with a peptide encoded by gene MAGE-3. Int J Cancer. 1995;63:883-885. [PubMed] |
| 30. | Osterlund C, Tohonen V, Forslund KO, Nordqvist K. Mage-b4, a novel melanoma antigen (MAGE) gene specifically expressed during germ cell differentiation. Cancer Res. 2000;60:1054-1061. [PubMed] |