修回日期: 2007-01-01
接受日期: 2007-01-10
在线出版日期: 2007-03-08
目的: 研究重症急性胰腺炎(SAP)大鼠早期给予添加益生元的微生态肠内营养后对肠屏障损害和内毒素易位的作用及其机制.
方法: 根据SAP营养代谢特点配制专用EN配方(EN-S), 并添加低聚半乳糖益生元制成微生态肠内营养配方(RPE-EN). 64只SD大鼠被随机分成8组(n = 8): 假手术对照4 d组, 假手术对照7 d组, SAP+EN-S治疗4 d组、SAP+EN-S治疗7 d组、SAP+PRE-EN治疗4 d组、SAP+PRE-EN治疗7 d组、SAP+PN治疗4 d组、SAP+PN治疗7 d组. 采用胰被膜下均匀注射38 g/L牛磺胆酸钠法建立SAP大鼠模型, 营养治疗在模型建立成功后即开始. 分别在第4天和第7天处死大鼠, 分别采用偶氮基质显色法和辣根过氧化物酶检测血浆内毒素和二胺氧化酶(DAO)水平, 采用TUNEL法检测小肠上皮细胞凋亡, 并计算凋亡指数(AI).
结果: EN-S、PRE-EN及PN组的血浆内毒素(4 d组: 158.7±23.9, 110.4±14.4, 202.0±30.3 EU/L vs 39.6±13.1 EU/L; 7 d组: 140.5±20.9, 88.16±30.4, 210.2±30.3 EU/L vs 40.7±12.4 EU/L)、DAO (4 d组: 5.17±0.62, 3.44±0.59, 7.29±0.68 kU/L vs 2.01±0.34 kU/L; 7 d组: 4.09±0.49, 2.83±0.96, 7.57±1.01 kU/L vs 2.12±0.42 kU/L)和AI (4 d组: 50.5%±9.7%, 48.9%±8.5%, 63.5%±6.7% vs 22.6%±3.3%; 7 d组: 41.6%±7.8%, 33.8%±5.1%, 64.7%±10.4% vs 23.1%±5.4%)显著高于假手术对照组(P<0.01), 而EN-S和PRE-EN组的内毒素、DAO和AI显著低于相同时间点的PN组(P<0.01); PRE-EN组的内毒素、DAO水平显著低于相同时间点的EN-S组(P<0.01), 而AI显著低于EN-S 7 d组(P<0.05); EN-S和PRE-EN 7 d组与4 d组相比, DAO水平和AI显著降低, 内毒素水平有降低趋势, 但未检出显著性差异.
结论: 添加益生元的微生态EN有助于维护SAP大鼠肠屏障功能, 减少肠上皮细胞凋亡, 减少内毒素易位的发生; EN在维护SAP大鼠肠屏障功能方面的作用优于PN.
引文著录: 王慧, 钟燕, 蔡东联, 耿珊珊, 韩婷, 陈凌云. 添加益生元肠内营养对重症急性胰腺炎肠屏障损害和内毒素易位的作用. 世界华人消化杂志 2007; 15(7): 694-699
Revised: January 1, 2007
Accepted: January 10, 2007
Published online: March 8, 2007
AIM: To explore the effect of micro-ecological enteral nutrition (EN) with prebiotics on the intestinal barrier dysfunction and endotoxin translocation in rats with severe acute pancreatitis (SAP).
METHODS: SAP specific enteral nutrition formula (EN-S) was prepared based on the nutritional and metabolic characteristic of SAP, and the micro-ecological EN formula was prepared with EN-S plus prebiotics (PRE-EN). Sixty-four Spraugue Dawley rats were divided randomly and averagely into 8 groups: sham operation control 4-day group, sham operation control 7-day group, SAP with EN-S 4-day group, SAP with EN-S 7-day group, SAP with PRE-EN 4-day group, SAP with PRE-EN 7-day group, SAP with PN 4-day group, and SAP with PN 7-day group, named as group A, B, C, D, E, F, G and H, respectively. The rat model of SAP was established by injection of 38 g/L sodium taurocholate (1 mL) beneath the pancreatic capsule. The nutritional therapy began after SAP model was established. The rats were killed on day 4 and 7, respectively. The serum levels of endotoxin and diamine oxidase (DAO) were detected. The apoptosis of intestinal mucosal epithelial cells were analyzed with terminal deoxynucleotidyl-transferase mediated dUTP-biotin nick and labeling (TUNEL) method, and the apoptosis index (AI) was calculated.
RESULTS: At each time point, the levels of plasma endotoxin and DAO, and the value of AI were significantly higher in group C (158.7 ± 23.9 EU/L, 5.17 ± 0.62 kU/L, 50.5% ± 9.7%), D (140.5 ± 20.9 EU/L, 4.09 ± 0.49 kU/L, 41.6% ± 7.8%), E (110.4 ± 14.4 EU/L, 3.44 ± 0.59 kU/L, 48.9% ± 8.5%), F (88.16 ± 30.4 EU/L, 2.83 ± 0.96 kU/L, 33.8% ± 5.1%), G (202.0 ± 30.3 EU/L, 7.29 ± 0.68 kU/L, 63.5% ± 6.7%) and H (210.2 ± 30.3 EU/L, 7.57 ± 1.01 kU/L, 64.7% ± 10.4%) than those in group A (39.6 ± 13.1 EU/L, 2.01 ± 0.34 kU/L, 22.6% ± 3.3%) and B (40.7 ± 12.4 kU/L, 2.12 ± 0.42 kU/L, 23.1% ± 5.4%) (P < 0.01), and the above indexes were also markedly lower in group C, D, E and F than those in group G and H (P < 0.01). The levels of endotoxin and DAO in group E and F were markedly lower than those in group C and D, and AI value was significantly lower in group F than that in group D (P < 0.05). As compared with those on day 4, the level of DAO and the value of AI in EN-S and PRE-EN groups were significantly decreased on day 7 (P < 0.01), and there was a decreasing trend without significance for plasma endotoxin level.
CONCLUSION: Micro-ecological EN with prebiotics is beneficial in maintaining intestinal barrier function, decreasing the apoptosis of intestinal epithelial cells and the occurrence of endotoxin translocation. EN is superior to PN in maintaining intestinal barrier function.
- Citation: Wang H, Zhong Y, Cai DL, Geng SS, Han T, Chen LY. Enteral nutrition with prebiotics on intestinal barrier dysfunction and endotoxin translocation in severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(7): 694-699
- URL: https://www.wjgnet.com/1009-3079/full/v15/i7/694.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i7.694
重症急性胰腺炎(severe acute pancreatitis, SAP)患者后期的细菌和内毒素易位以及多器官功能衰竭是导致患者死亡的主要原因[1-3], 其发生与肠屏障破坏有密切关系. 肠外营养(parenteral nutrition, PN)用于SAP治疗的主要弊端是无法给肠屏障提供良好的保护, 容易导致后期并发症的出现, 因此早期给予SAP患者肠内营养(enteral nutrition, EN)近年来被重新受到重视[4-6]. 微生态EN是在普通EN的基础上添加某些微生态调节剂(包括益生菌、益生元和合生素), 以增强对肠屏障功能的保护作用. 一直以来人们多关注于对益生菌的研究而忽略了益生元类物质在临床的应用价值. 低聚糖类益生元作为一类重要的微生态调节剂, 可以促进肠内益生菌生长, 对维护肠屏障功能受损具有一定作用[7-9]. 在众多低聚糖中被称为双歧杆菌生长因子的低聚半乳糖(galacto-oligosaccharides, GOS)是很有发展前景的一种. 本研究根据SAP营养代谢特点研制合成专用的EN配方(EN-S), 并在该配方基础上添加GOS益生元制成微生态EN制剂(EN-PRE), 通过对SAP模型大鼠肠上皮细胞凋亡分析和血浆内毒素与二胺氧化酶(diamine oxidase, DAO)检测, 研究该EN-S, EN-PRE和PN在肠屏障功能损害和内毒素易位发生中的作用效果.
健康♂清洁级SD大鼠64只, 6-7周龄, 体质量250±8 g(由第二军医大学实验动物中心提供). 动物适应性喂养7 d后进行实验. 此期间自由进食和饮水. 950 g/L水解乳清单白(美国GRANDE公司), 低聚半乳糖GOS(西安德施普生物制品有限公司), 内毒素鲎试剂盒(上海市医学化验所), 辣根过氧化物酶(Sigma公司), 邻茴香胺甲醇溶液(Sigma公司), 尸胺二氢氯化物(Sigma公司), TUNEL原位检测试剂盒(Roche公司), 肠内营养泵(flocate 800型肠内输注泵, 荷兰Nutricia公司), 静脉推注泵(Flo-Gard 6201, Baxter公司), 台式高速低温离心机(Beckman公司), UV754分光光度计(上海第三分析仪器厂).
1.2.1 动物分组及模型建立: 64只SD大鼠被随机分成8组(n = 8只): 假手术对照4 d组, 假手术对照7 d组, SAP+EN-S治疗4 d组、SAP+EN-S治疗7 d组、SAP+PRE-EN治疗4 d组、SAP+PRE-EN治疗7 d组、SAP+PN治疗4 d组、SAP+PN治疗7 d组. 实验前大鼠禁食12 h以上, 自由饮水. 采用25 g/L硫喷妥钠腹腔注射麻醉, 无菌条件下经上腹正中切口进腹, 暴露胰腺, 用1 mL注射器从胰尾部开始被膜下多点缓慢均匀注入38 g/L牛磺胆酸钠1 mL, 使整个胰腺均匀隆起, 胰腺组织可在短时间内出现充血、水肿, 继则可见包膜下胰腺组织点状或小片状出血, 约2 min后轻轻把胰腺复位, 分层缝合腹部切口. 对照组切开腹腔后, 轻翻胰腺后缝合切口. 胰腺病理学检查证实模型组发生出血坏死.
1.2.2 喂养途径建立: 胃十二指肠置管方法: 经胃幽门区, 置入已用生理盐水充盈的外径1.5 mm无菌硅胶管, 远端位于空肠屈氏韧带以下5 cm左右, 在胃部荷包缝合固定, 经皮下隧道将硅胶管自颈部引出, 用自制背扣固定于颈部皮肤, 连接于肠内营养输注泵. 颈外静脉插管方法: 钝行分离出颈外静脉, 经颈外静脉置入已用生理盐水充盈的外径为1.2 mm无菌硅胶管, 用丝线结扎固定, 随后将硅胶管由颈背部皮下隧道引出, 导管穿过弹簧, 用自制背扣固定于颈部皮肤, 并连接于静脉推注泵.
1.2.3 营养给予方式: 各EN组待术后动物清醒后6 h给予少量生理盐水冲洗肠管, 12 h时起肠内滴注EN制剂, 从最初1.0 mL/h的滴速逐渐增加, 至术后36 h滴速达到2.0 mL/h, 50 mL/d, 之后维持此速度; PRE-EN组动物每天营养液内添加1.0 g GOS益生元; PN组静脉营养液滴注速度在术后36 h内从1.0 mL/h增加至2.0 mL/h, 50 mL/d.
1.2.4 标本收集及测定: 分别在造模后第4天和第7天处死动物, 腹主动脉取血, 将血液置于抗凝管中, 2500 r/m离心15 min, 同时取1 cm回肠组织, 40 g/L中性福尔马林固定. 内毒素检测采用鲎试剂盒, 用偶氮基质显色法检测. 血浆二胺氧化酶采用分光光度法测定[10], 在样品管中先后加入标本、0.2 mol/L pH7.2的磷酸缓冲液、辣根过氧化物酶、邻茴香胺甲醇和尸胺二氢氯化物. 在37℃水浴中孵育30 min后, 用紫外分光光度计在436 nm处测DAO活性. 肠上皮细胞凋亡检测, 将经福尔马林固定的标本常规石蜡切片, 二甲苯脱蜡入水, 双蒸水洗, 0.01 mol/L PBS洗涤3次, 每次5 min, 取标记溶液(含有核苷酸的混合液的反应液)100 μL做二张阴性对照片, 将酶浓缩溶液(TdT)50 μL与标记溶液450 μL混合, 置37℃温箱1 h; 0.01 mol/L PBS洗涤3次, 每次5 min, 滴加converter-AP, 37℃温箱中30 min, 0.01 mol/L PBS 缓冲液洗涤3次, 每次5 min, BCIP/NBT显色, 双蒸水洗涤, GVA封片. 计数每100个上皮细胞中凋亡细胞个数, 即凋亡指数(apoptotic index, AI), 每张切片各任选3个视野, 求其平均值.
统计学处理 采用SPSS11.5软件进行统计分析, 实验结果以mean±SD表示, 运用方差分析统计, P<0.01或P<0.05为有统计学意义.
在第4天和第7天两个时间点, 与假手术对照组相比, 各SAP组的血浆内毒素浓度显著升高(P<0.01), 其中PN组水平最高; EN-S和PRE-EN组水平显著低于PN组(P<0.01), EN-S组水平显著高于对应时间点的PRE-EN组(P<0.01); EN-S和PRE-EN 7 d组与对应的4 d组相比, 水平呈降低趋势但无显著性差异, 而PN 7d组与4 d组相比水平呈升高趋势(P>0.05)(表1).
| 分组 | 内毒素水平(EU/L) | DAO浓度(kU/L) | AI(%) | |||
| 4 d | 7 d | 4 d | 7 d | 4 d | 7 d | |
| 假手术对照 | 39.6±13.1 | 40.7±12.4 | 2.01±0.34 | 2.12±0.42 | 22.6±3.3 | 23.1±5.4 |
| SAP+EN-S | 158.7±23.9bdf | 140.5±20.9bdf | 5.17±0.62bdf | 4.09±0.49bdfh | 50.5±9.7bf | 41.6±7.8bdfh |
| SAP+PRE-EN | 110.4±14.4bf | 88.16±30.4bf | 3.44±0.59bf | 2.83±0.96bfh | 48.9±8.5bf | 33.8±5.1bfh |
| SAP+PN | 202.0±30.3b | 210.2±30.3b | 7.29±0.68b | 7.57±1.01b | 63.5±6.7b | 64.7±10.4b |
在第4天和第7天两个时间点, 各SAP组的血浆DAO浓度显著高于假手术对照组(P<0.01), 其中PN组水平最高; EN-S和PRE-EN组水平显著低于PN组(P<0.01), EN-S组显著高于对应时间点的PRE-EN组(P<0.01); EN-S和PRE-EN 7 d组与对应的4 d组相比, 水平显著降低(P<0.01), 而PN组无此差异(表1).
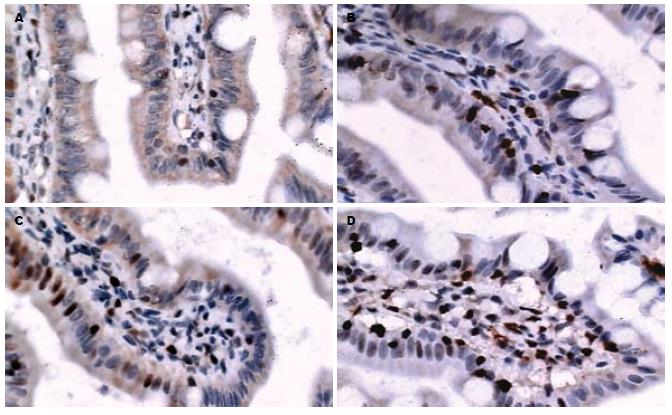
显微镜下观察原位凋亡检测结果显示, 与假手术对照组相比, 各SAP组隐窝处可见较多的凋亡上皮细胞分布, PN组的凋亡细胞数量最多, PRE组的数量少于EN-S组(图1). 各SAP组的AI显著高于假手术对照组(P<0.01), EN-S和PRE-EN组显著低于PN组(P<0.01); EN-S和PRE-EN 7 d组显著低于4 d组(P<0.05), 而PN 4 d和7 d组相比无显著性差异; 在第7天时, PRE-EN组的AI显著低于EN-S组(P<0.05)(表1).
肠上皮细胞层构成机体的最前沿防御屏障, 具有抵御肠腔内有害微生物和潜在致病菌侵入外周脏器的作用. 由多种原因导致的SAP患者肠屏障功能破坏是全身继发感染及MODS发生的主要原因, 直接导致疾病的死亡率增加[11-13]. 如何维护患者肠屏障功能的完整性一直是临床上一个非常重要而且棘手的问题. 随着EN作用被重新认识, 多项研究已证实早期空肠EN是安全的, 而且有助于维持SAP患者肠屏障功能、减少内毒素和细菌易位的发生[14-16]. 本研究根据SAP营养需要和代谢特点, 研制适用于SAP的EN-S制剂, 前期研究已证实该配方具有改善SAP大鼠蛋白质代谢和电解质平衡的作用[17]. 本研究我们在该EN配方中添加一类重要的微生态调节剂--GOS益生元, 通过观察对SAP大鼠血浆内毒素、DAO和肠黏膜上皮细胞凋亡的观察, 探讨其对肠屏障的保护作用.
研究结果显示与假手术对照组相比, 各SAP组的血浆内毒素浓度显著升高. 内毒素是主要由肠道G-菌产生的一种大分子分解产物, 正常情况下, 完整的肠屏障可以将内毒素局限于肠腔内[18]. 但当肠屏障受损时, 则会穿过受损的肠屏障进入外周血循环, 激活单核巨噬细胞系统, 使其释放多种炎性介质, 大多数SAP患者外周血中都可以检测出内毒素, 而且这些患者90%以上都可能死于内毒素血症[19-21]. 本研究中, 与PN组相比, 不论是EN-S还是PRE-EN都可以显著降低血浆内毒素水平, 而且PRE-EN组的水平显著低于EN-S组, 说明在EN中添加GOS益生元可以有效改善SAP的内毒素血症. 另一方面随着营养治疗时间的延长, EN-S组和PRE-EN组的内毒素水平出现降低的趋势, 而PN组则相反, 提示早期EN可减轻肠内毒素的吸收.
DAO是人类和所有哺乳动物肠黏膜上层绒毛细胞胞质中具有高度活性的细胞内酶, 而在其他组织中则含量少、活性低. 肠黏膜细胞受损、坏死后该酶释放入血, 或随坏死脱落的肠黏膜细胞进入肠腔内, 导致血浆和肠腔DAO活性增高. DAO在外周血中活性稳定, 因而可以反映肠黏膜屏障的完整性和损伤程度[22-23]. 导致体内DAO活性发生改变的因素可能包括[24]: (1)与营养途径有关: 动物研究发现胃肠长期无负荷状态会导致肠黏膜萎缩, 血浆DAO活性升高; (2)肠急性缺血: DAO活性改变与肠缺血有关, 把大鼠肠系膜动脉夹闭60 min后肠DAO活性降低66%, 而血浆DAO活性则显著增高. 本研究结果表明, EN-S和PRE-EN与PN组相比, DAO水平显著降低, PRE-EN组水平显著低于EN-S组, 说明EN尤其是添加益生元的PRE-EN有助于减少SAP时的肠黏膜受损程度.
动物研究发现, SAP时肠黏膜上皮细胞凋亡与肠道黏膜功能受损有关, 与对照组相比, SAP组的凋亡指数显著增加, 尤其是隐窝部凋亡细胞的增加, 可使细胞总体数目减少, 细胞间紧密连接分离, 使内毒素、细菌等大分子物质容易通过, 发生内毒素和细菌易位[25-26]. 有研究通过抑制SAP大鼠的胱门蛋白酶(一种参与细胞凋亡的关键酶)发现可以显著减少肠上皮细胞凋亡, 改善肠通透性, 减少内毒素易位的发生, 并降低动物的死亡率[27]. 导致SAP肠上皮凋亡的可能原因如下: 内脏血流灌注减少, 肠黏膜缺血缺氧; 肠蠕动减慢, 肠上皮受损, 细菌容易黏附并穿过肠上皮, 引起炎症反应以及细胞因子的产生; 细菌黏附分子表达的异常, 致使上皮细胞与细胞基质间连接破坏以及氧自由基的作用等. 本研究结果显示, 各SAP组的AI显著高于对照组, EN-S和PRE-EN组显著低于PN组, PRE-EN 7 d组显著低于EN-S 7 d组, 提示EN在改善及缓解上皮细胞凋亡方面的作用优于PN, 而且添加GOS益生元有助于进一步提高EN在缓解凋亡方面的作用. 目前有关益生元调节细胞凋亡在肠屏障功能方面的作用尚未见报道, 但某些对结肠癌的实验研究发现, 益生元物质通过调节结肠上皮细胞凋亡, 起到一定的预防癌症形成作用[28].
本研究结果提示添加GOS益生元的微生态EN可以增强EN维持肠黏膜屏障完整性的作用, 其作用机制可能包括[29-30]: (1)GOS刺激肠内双歧杆菌和乳酸杆菌等有益菌的生长, 抑制有害菌增殖, 维持肠内菌丛平衡; (2)刺激肠管相关淋巴组织的活性以及免疫物质的生成, 增强肠免疫功能; (3)增强宿主吞噬细胞的活性, 提高机体特异性和非特异性抗感染能力; (4)作为肠道内益生菌的营养底物, 发酵后产生各种短链脂肪酸, 给肠上皮细胞提供能量和营养, 从而有利于肠上皮细胞再生, 促进屏障功能修复.
随着人们对免疫微生态营养支持在临床治疗中重要性的认识, 以及各种新型益生元产品的开发, 有关益生元在维持SAP等重症应激性疾病中的作用及其机制还值得进一步深入探讨.
重症急性胰腺炎(SAP) 是临床常见的危急重症, 由于肠屏障功能受损, 肠源性细菌和内毒素易位引起继发感染, 所导致的多器官功能障碍综合征是患者死亡的主要原因, 目前尚缺乏有效的治疗手段. 近年来, 添加微生态调节剂的肠内营养在维护肠屏障功能完整性方面的作用被提升到较 高 地位. 微生态调节剂主要包括益生菌(probiotics)、益生元(prebiotics)及两者共同构成的合生素(synbiotics), 他们在保护肠屏障功能方面的作用既有共性, 也有区别. 与活菌制剂相比, 益生元不会对机体产生任何毒副作用, 同时还具有可溶性食物纤维的基本特性; 具有良好的耐消化性, 不易被唾液、胰液、肠液中的酶类分解, 可以到达结肠, 被结肠内细菌代谢. 目前关于益生元对肠屏障功能作用研究报道较少, 而且相关作用机制不明确, 尚需深入研究.
如何维护肠屏障功能的完整性一直是临床多种应激性疾病治疗的关键和难点, 免疫微生态制剂正成为解决该问题的一个重要武器而受到越来越多的关注.
近年来有研究发现在SAP患者肠内营养中应用益生元具有改善临床预后的作用, 动物实验也发现具改善肠屏障的作用, 但对其作用机制研究不明确, 关对肠上皮细胞凋亡的调节作用未见报道.
本研究通过SAP大鼠模型, 证实在内营养中添加低聚半乳糖益生元可以通过调节道上皮细胞凋亡, 起到防止内毒素易位和维持肠 黏膜屏障完整性的作用.
本研究通过动物实验研究添加益生元肠内营养对SAP肠屏障的保护作用机制, 为SAP患者寻求新的有效的营养辅助治疗途径, 为临床应用包括益生元在内的微生态肠内营养制剂提供理论依据.
益生元: 益生元的概念是Gibson et al(1995年)首先提出来的, 是指一些不被宿主消化的食物成分, 能选择性刺激肠内双歧杆菌等有益菌代谢和增殖, 从而起着增进宿主健康的物质, 常称为双歧因子, 常见的有各种低聚糖类, 如低聚半乳糖(galacto-oligosaccharides,GOS)、低聚果糖、低聚木糖、低聚棉子糖、低聚麦芽糖等, 通过促进益生菌生长, 抑制有害菌, 可以起到与益生菌类似的生理作用, 达到调整肠管微生态平衡的目的.
本文研究了添加益生元肠内营养对重症急性胰腺炎肠屏障损害和内毒素易位的作用, 新颖度高, 内容详实, 结果可信, 有较高的科学价值.
电编: 张敏 编辑:张焕兰
| 1. | Manes G, Kahl S, Schulz HU, Lippert H, Ferrara EC, Malfertheiner P. Early bacterial infection of the pancreas and course of disease in cerulein-induced acute pancreatitis in rats. Dig Liver Dis. 2006;38:423-428. [PubMed] |
| 3. | Rau BM, Bothe A, Kron M, Beger HG. Role of early multisystem organ failure as major risk factor for pancreatic infections and death in severe acute pancreatitis. Clin Gastroenterol Hepatol. 2006;4:1053-1061. [PubMed] |
| 4. | Kumar A, Singh N, Prakash S, Saraya A, Joshi YK. Early enteral nutrition in severe acute pancreatitis: a prospective randomized controlled trial comparing nasojejunal and nasogastric routes. J Clin Gastroenterol. 2006;40:431-434. [PubMed] |
| 5. | McClave SA, Chang WK, Dhaliwal R, Heyland DK. Nutrition support in acute pancreatitis: a systematic review of the literature. JPEN J Parenter Enteral Nutr. 2006;30:143-156. [PubMed] |
| 6. | Zhao H, Lu HG, Shi YB, Zhao LM, Bai C, Wang X. Role of enteral nutrition supplemented with ebselen and EHEC in pancreatitis-associated multiple organ dysfunction in rats. Inflamm Res. 2006;55:423-429. [PubMed] |
| 7. | Swanson KS, Grieshop CM, Flickinger EA, Bauer LL, Chow J, Wolf BW, Garleb KA, Fahey GC Jr. Fructooligosaccharides and Lactobacillus acidophilus modify gut microbial populations, total tract nutrient digestibilities and fecal protein catabolite concentrations in healthy adult dogs. J Nutr. 2002;132:3721-3731. [PubMed] |
| 8. | Shoaf K, Mulvey GL, Armstrong GD, Hutkins RW. Prebiotic galactooligosaccharides reduce adherence of enteropathogenic Escherichia coli to tissue culture cells. Infect Immun. 2006;74:6920-6928. [PubMed] |
| 9. | Kotzampassi K, Giamarellos-Bourboulis EJ, Voudouris A, Kazamias P, Eleftheriadis E. Benefits of a synbiotic formula (Synbiotic 2000Forte) in critically Ill trauma patients: early results of a randomized controlled trial. World J Surg. 2006;30:1848-1855. [PubMed] |
| 11. | Xu GF, Lu Z, Gao J, Li ZS, Gong YF. Effect of ecoimmunonutrition supports on maintenance of integrity of intestinal mucosal barrier in severe acute pancreatitis in dogs. Chin Med J (Engl). 2006;119:656-661. [PubMed] |
| 12. | Leveau P, Wang X, Sun Z, Borjesson A, Andersson E, Andersson R. Severity of pancreatitis-associated gut barrier dysfunction is reduced following treatment with the PAF inhibitor lexipafant. Biochem Pharmacol. 2005;69:1325-1331. [PubMed] |
| 13. | Assimakopoulos SF, Alexandris IH, Scopa CD, Mylonas PG, Thomopoulos KC, Georgiou CD, Nikolopoulou VN, Vagianos CE. Effect of bombesin and neurotensin on gut barrier function in partially hepatectomized rats. World J Gastroenterol. 2005;11:6757-6764. [PubMed] |
| 15. | Makola D, Krenitsky J, Parrish C, Dunston E, Shaffer HA, Yeaton P, Kahaleh M. Efficacy of enteral nutrition for the treatment of pancreatitis using standard enteral formula. Am J Gastroenterol. 2006;101:2347-2355. [PubMed] |
| 16. | Kumar A, Singh N, Prakash S, Saraya A, Joshi YK. Early enteral nutrition in severe acute pancreatitis: a prospective randomized controlled trial comparing nasojejunal and nasogastric routes. J Clin Gastroenterol. 2006;40:431-434. [PubMed] |
| 18. | Ferrier L, Berard F, Debrauwer L, Chabo C, Langella P, Bueno L, Fioramonti J. Impairment of the intestinal barrier by ethanol involves enteric microflora and mast cell activation in rodents. Am J Pathol. 2006;168:1148-1154. [PubMed] |
| 19. | Matsuda N, Nishihira J, Takahashi Y, Kemmotsu O, Hattori Y. Role of macrophage migration inhibitory factor in acute lung injury in mice with acute pancreatitis complicated by endotoxemia. Am J Respir Cell Mol Biol. 2006;35:198-205. [PubMed] |
| 20. | Qiao SF, Lu TJ, Sun JB, Li F. Alterations of intestinal immune function and regulatory effects of L-arginine in experimental severe acute pancreatitis rats. World J Gastroenterol. 2005;11:6216-6218. [PubMed] |
| 21. | Marotta F, Barreto R, Wu CC, Naito Y, Gelosa F, Lorenzetti A, Yoshioka M, Fesce E. Experimental acute alcohol pancreatitis-related liver damage and endotoxemia: synbiotics but not metronidazole have a protective effect. Chin J Dig Dis. 2005;6:193-197. [PubMed] |
| 22. | Yasuda T, Takeyama Y, Ueda T, Shinzeki M, Sawa H, Nakajima T, Kuroda Y. Breakdown of intestinal mucosa via accelerated apoptosis increases intestinal permeability in experimental severe acute pancreatitis. J Surg Res. 2006;135:18-26. [PubMed] |
| 23. | Deng Q, Wu C, Li Z, Xiong D, Liang Y, Lu L, Sun X. The prevention of infection complicating acute necrotizing pancreatitis:an experimental study. Zhonghua Wai Ke Za Zhi. 2000;38:625-629. [PubMed] |
| 25. | Takase K, Takeyama Y, Nishikawa J, Ueda T, Hori Y, Yamamoto M, Kuroda Y. Apoptotic cell death of renal tubules in experimental severe acute pancreatitis. Surgery. 1999;125:411-420. [PubMed] |
| 27. | Rahman SH, Ammori BJ, Holmfield J, Larvin M, McMahon MJ. Intestinal hypoperfusion contributes to gut barrier failure in severe acute pancreatitis. J Gastrointest Surg. 2003;7:26-35; discussion 35-36. [PubMed] |
| 28. | Hughes R, Rowland IR. Stimulation of apoptosis by two prebiotic chicory fructans in the rat colon. Carcinogenesis. 2001;22:43-47. [PubMed] |
| 29. | Quigley EM, Quera R. Small intestinal bacterial overgrowth: roles of antibiotics, prebiotics, and probiotics. Gastroenterology. 2006;130:S78-90. [PubMed] |