修回日期: 2006-12-01
接受日期: 2006-12-18
在线出版日期: 2007-02-28
目的: 观察缩胆囊素和胰泌素对胰管压力及胰腺血流量的影响, 以探讨急性胆源性胰腺炎的发病机制.
方法: 6只负鼠静脉灌注缩胆囊素和胰泌素5 mg/kg, 分别胰管插管, 并连接到压力感受器上测定胰管压力, 激光多普勒测定胰腺血流量.
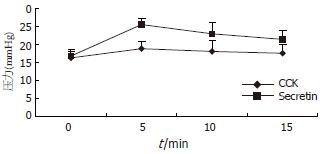
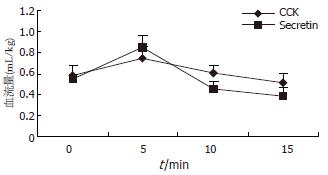
结果: 在注射缩胆囊素和胰泌素后5 min, 胰管压力分别由16.2±1.8 mmHg和16.8±1.7 mmHg上升到18.9±2.1 mmHg和25.6±1.9 mmHg, 在随后的5-15 min期间, 胰管压力在此水平缓慢的下降并维持在较高的水平, 分别为17.6±2.4 mmHg和21.5±2.5 mmHg (P<0.002和P<0.001); 胰腺血流量分别由0.58±0.09 mL/100 g和0.55±0.04 mL/100 g上升到0.75±0.11 mL/100 g和0.85±0.12 mL/100 g, 在随后的5-15 min期间, 随着胰管压力上升, 胰腺血流量反而缓慢的下降并维持在较低的水平, 分别为0.51±0.09 mL/100 g和0.39±0.11 mL/100 g (P<0.001), 与缩胆囊素相比, 胰泌素的这种作用更为明显(P<0.05).
结论: 缩胆囊素和胰泌素可增加胰管压力, 并使胰腺血流量在开始增加, 增加的胰管压力反而使胰腺血流量下降, 提示在胰管有梗阻的情况下, 这两种激素可能是急性胆源性胰腺炎发生并发展的重要始动因素之一.
引文著录: 石承先, ChenJWC, ToouliJ. 缩胆囊素和胰泌素对负鼠胰管压力和胰腺血流量的影响. 世界华人消化杂志 2007; 15(6): 638-640
Revised: December 1, 2006
Accepted: December 18, 2006
Published online: February 28, 2007
AIM: To investigate the effects of cholecystokinin (CCK) and secretin on pancreatic duct pressure (PDP) and pancreatic blood flow (PBF) in Australian brush-tailed possums.
METHODS: CCK and secretin (5 mg/kg) were intravenously injected into 6 brush-tailed possums respectively. Pancreatic duct of the possums were cannulated and PDP was measured by Maclab recording system separately. PBF was measured using laser Doppler flowmetry.
RESULTS: Five minutes after CCK and secretin injection, PDP increased from 16.2 ± 1.8 and 16.8 ± 1.7 mmHg to 18.9 ± 2.1 and 25.6 ± 1.9 mmHg, and maintained high levels (17.6 ± 2.4 mmHg and 21.5 ± 2.5 mmHg) at the 15th minute (P < 0.002 and P < 0.001); PBF increased from 0.58 ± 0.09 and 0.55 ± 0.04 mL/100 g to 0.75 ± 0.11 and 0.85 ± 0.12 mL/100 g, respectively, at the beginning after CCK and secretin injection. However, CCK and secretin made a continual PDP increase along with PBF decrease till maintaining a low level (0.51 ± 0.09 mL/100 g and 0.39 ± 0.11 mL/100 g, P < 0.001) within 15 minutes, but the influence of secretin was more significant than that of CCK (P < 0.05).
CONCLUSION: PDP can be increased by CCK and secretin injection, resulting in an increase of PBF, which may be the initial factor in the pathogenesis and development of acute biliary pancreatitis.
- Citation: Shi CX, Chen J, Toouli J. Effects of cholecystokinin and secretin on pancreatic duct pressure and pancreatic blood flow in Australian brush-tailed possums. Shijie Huaren Xiaohua Zazhi 2007; 15(6): 638-640
- URL: https://www.wjgnet.com/1009-3079/full/v15/i6/638.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i6.638
研究发现, 急性胆源性胰腺炎(ABP)常存在胰管高压和胰腺血液循环障碍, 并且ABP的类型与胰管压力有关[1-3], 胰腺血液循环障碍又可能是导致ABP时胰腺坏死的主要原因之一[3]. 我们的实验显示, 胰管压力与胰腺血流量有关[4-5]. 暴饮暴食常是诱发ABP的重要原因之一. 饮食中的脂肪或蛋白质等可刺激肠道分泌缩胆囊素(cholecystokinin)和胰泌素(secretin), 两者均可增加胰液分泌[6]. 但是, 缩胆囊素和胰泌素是否对胰管压力和胰腺血流量有影响尚不清楚. 在本研究中, 我们观察缩胆囊素和胰泌素对负鼠胰管压力和胰腺血流量是否有作用, 以探讨ABP的某些发病机制.
6只负鼠按报道的方法[7]准备. 首先使用氯胺酮20 mg/kg(澳大利亚卡特兰公司)和Xylazine 10 mg/kg(澳大利亚卢木普公司)肌肉注射麻醉负鼠, 然后左下肢静脉插管, 作为应用输液泵静脉输入戊巴比妥钠15-20 mg/(kg•h)维持麻醉. 左股动脉插管并将此连接到压力感受器(爱尔兰共和国全斯派克公司)作术中监测血压. 气管插管并用小动物呼吸机(美国菲力蒲公司)维持负鼠通气. 用电热毯(美国哈维德仪器公司)保温. 剖腹探查, 分别将十二指肠和胰腺轻轻固定于平板上, 以利于作胰管插管和测定胰腺血流量. 6只负鼠胰管的直径1-1.5 mm, 近Oddi括约肌一侧切开, 向胰腺侧插入外直径1.2 mm内直径0.8 mm的聚乙烯导管, 其周用9-0的尼龙线固定, 并连接到压力感受器上, 以测定胰管压力. 右下肢静脉插管用于灌注缩胆囊素和胰泌素.
1.2.1 测定胰管压力: 聚乙烯导管一端插入胰管内, 另一端连接到压力感受器上, 并在胰腺水平调整零点. 准备60 min稳定后, 开始分别灌注缩胆囊素和胰泌素, 缩胆囊素和胰泌素用量分别为5 μg/kg, 分开静脉灌注, 再分别观察30 min, 同时记录胰管压力.
1.2.2 测定胰腺血流量: 在实验中, 使用激光多普勒(瑞典派力麦德公司)测定胰腺血流量. 首先用Vetland胶将该仪器的探头黏附于胰头表面, 在调整25%的基础水平和保持温度的条件下测定. 该仪器的输出端连接到记录系统. 准备60 min稳定后, 开始分别灌注缩胆囊素和胰泌素, 再分别观察30 min, 同时记录胰腺血流量. 胰腺血流量以每100 g组织mL/min表示. 所有感受器都连接到Maclab记录系统(澳大利亚爱迪仪器公司). 实验结束时, 使用致死量的戊巴比妥钠处死动物.
统计学处理 所有资料以平均数±标准差(mean±SD)表示. 比较用t检验.
从Maclab记录系统中采集1 min记录的平均值, 采集点分别在注射缩胆囊素和胰泌素后5, 10和15 min 3个点.
在胰管梗阻(胰管插管)的情况下, 分别在注射缩胆囊素和胰泌素后5 min, 胰管压力分别由16.2±1.8 mmHg和16.8±1.7 mmHg上升到18.9±2.1 mmHg和25.6±1.9 mmHg, 在随后的5-15 min期间, 胰管压力在此水平缓慢的下降并维持在较高的水平, 分别为17.6±2.4 mmHg和21.5±2.5 mmHg, 与使用缩胆囊素和胰泌素前相比明显升高(P<0.002和P<0.001), 与缩胆囊素相比,胰泌素的这种增加胰管压力的作用更为明显(P<0.05)(图1).
在胰管梗阻(胰管插管)的情况下, 分别在注射缩胆囊素和胰泌素后5 min, 胰腺血流量分别由5.8±0.9 mL/kg和5.5±0.4 mL/kg上升到7.5±1.1 mL/kg和8.5±1.2 mL/kg, 在随后的5-15 min期间, 随着胰管压力上升, 胰腺血流量在此水平反而下降并维持在较低的水平, 分别为5.1±0.9 mL/kg和3.9±1.1 mL/kg, 与使用缩胆囊素和胰泌素前相比显著降低(P<0.001), 与缩胆囊素相比, 胰泌素的这种作用更为明显(P<0.05)(图2).
ABP常存在胰管高压, 重型ABP的胰管压力比轻型ABP的胰管压力高[1-2]. 暴饮暴食是ABP的主要原因之一. 暴饮暴食尤其是其中的脂肪或蛋白质等可刺激肠道分泌缩胆囊素和胰泌素. 缩胆囊素和胰泌素可以促使胰腺分泌[6]. 本实验显示, 在胰管梗阻(胰管插管)的情况下, 缩胆囊素和胰泌素可明显增加胰管压力, 其中胰泌素的这种增加胰管压力的作用更为明显. 这提示暴饮暴食诱发ABP, 其中的重要原因之一可能是食物中的脂肪等可刺激肠道分泌缩胆囊素和胰泌素, 在胰管梗阻的情况下, 可能通过增加胰腺分泌进而增加胰管压力, 从而诱发ABP. ABP有较低的胰腺血流量, 一般减少30%-50%[3,8]. 除了细胞因子的作用外[11-14], 胰腺坏死的主要原因之一可能是胰腺血流量减少[9-10,15]. 本研究表明, 缩胆囊素和胰泌素在开始时可以增加胰腺血流量, 但是, 在胰管有梗阻时缩胆囊素和胰泌素使胰管压力增加的同时反而减少了胰腺血流量, 这可能是ABP时发生胰腺血液循环障碍的另一重要原因. 这与我们过去的实验证明胰管压力与胰腺血流量呈相反关系相一致[4-5]. 这些结果提示, 缩胆囊素和胰泌素可增加胰管压力, 由此而使胰腺血流量下降, 在胰管有梗阻的情况下, 这两种激素可能是餐后ABP发生并发展的重要始动因素之一.
急性胆源性胰腺炎(ABP) 常存在不同程度的胰管梗阻和胰管高压与胰腺血液循环障碍, 暴饮暴食常是诱发ABP的重要原因之一. 饮 食中的脂肪或蛋白质等可刺激肠道分泌, 其中缩胆囊素和胰泌素是重要的胃肠道激素, 已知这两种激素可引起胰液分泌和胆囊收缩等, 但是, 缩胆囊素和胰泌素在胰管梗阻下是否对胰管压力和胰腺血流量有影响尚不清楚, 并在饮食诱发 ABP的发生与发展方面的作用有待研究.
研究发现, 引起ASP的主要原因,一方面可能是胰腺炎诱发细胞因子与炎症介质的释放和胰腺血液循环障碍发生作用, 另一方面肠细菌移位导致感染引起的二次打击.此外, 重型ABP的胰管压力比轻型ABP的胰管压力高, 胰管减压使可能发生ASP者仅为轻型ABP, 说明胰管压力在ASP的发生与发展方面起着一定的作用.
本文观察缩胆囊素和胰泌素对负鼠胰管压力和胰腺血流量的影响,有比较重要的发现, 对探讨ABP的发病机制有理论意义.
电编: 张敏 编辑:王晓瑜
| 1. | Fujiwara H. Pressure measurement in pancreatic duct and biliary duct system in dogs with acute pancreatitis. Kobe J Med Sci. 1991;37:47-55. [PubMed] |
| 3. | Yotsumoto F, Manabe T, Ohshio G. Bradykinin involvement in the aggravation of acute pancreatitis in rabbits. Digestion. 1993;54:224-230. [PubMed] |
| 5. | Shi CX, Chen JW, Carati CJ, Schloithe AC, Toouli J, Saccone GT. Effects of acute pancreatic duct obstruction on pancreatic perfusion: implication of acute pancreatic duct decompression. Scand J Gastroenterol. 2002;37:1328-1333. [PubMed] |
| 6. | Soicia E. The pathology of the gastrointestinal endocrine system. Endocrinol Metab Clin North Am. 1993;22:796. |
| 7. | Chen JW, Shi CX, Teng MJ, Schloithe AC, Toouli J, Saccone GT. Scorpion venom stimulates biliary/duodenal motility and pancreatic exocrine secretion. Neurogastroenterol Motil. 2004;16:447-454. [PubMed] |
| 8. | Klar E, Messmer K, Warshaw AL, Herfarth C. Pancreatic ischaemia in experimental acute pancreatitis: mechanism, significance and therapy. Br J Surg. 1990;77:1205-1210. [PubMed] |
| 9. | Spormann H, Sokolowski A, Letko G. Effect of temporary ischemia upon development and histological patterns of acute pancreatitis in the rat. Pathol Res Pract. 1989;184:507-513. [PubMed] |
| 10. | Yotsumoto F, Manabe T, Ohshio G, Imanishi K, Ando K, Kyogoku T, Hirano T, Tobe T. Role of pancreatic blood flow and vasoactive substances in the development of canine acute pancreatitis. J Surg Res. 1993;55:531-536. [PubMed] |
| 12. | 张 莹, 石 承先, 黄 平, 任 娟娟, 李 玉祥. 丹参对重症急性胰腺炎大鼠诱导型一氧化氮合成酶mRNA的表达与器官损伤的影响. 中国中西医结合杂志. 2005;25:1012-1015. |
| 14. | Cosen-Binker L, Binker M, Cosen R, Negri G, Tiscornia O. Relaxin prevents the development of severe acute pancreatitis. World J Gastroenterol. 2006;12:1558-1568. |
| 15. | Demirag A, Pastor C, Morel P, Jean-Christophe C, Sielenkamper A, Guvener N, Mai G, Berney T, Frossard JL, Buhler LH. Epidural anaesthesia restores pancreatic microcirculation and decreases the severity of acute pancreatitis. World J Gastroenterol. 2006;12:915-920. |