修回日期: 2006-12-01
接受日期: 2006-12-22
在线出版日期: 2007-02-28
目的: 探讨以壳聚糖为佐剂的H. pylori疫苗对H. pylori感染的免疫治疗作用.
方法: 建立BALB/c小鼠H. pylori感染的动物模型后, 随机分为5组: 空白对照组、H. pylori抗原组、H. pylori抗原+壳聚糖酸溶液组、H. pylori抗原+壳聚糖颗粒组、H. pylori抗原+霍乱毒素(CT)组. 各组于第0, 7, 14, 21天灌胃免疫1次. 4 wk后, 采用定量H. pylori培养和病理改良Giemsa染色法检测胃黏膜内H. pylori感染情况、HE染色检测胃黏膜炎症程度、用间接ELISA法检测唾液和胃黏膜内抗H. pylori IgA和血清中抗H. pylori IgG.
结果: 以壳聚糖为佐剂的H. pylori疫苗对H. pylori感染的清除率为58.33%, 与以CT为佐剂组相似(45.45%); 在H. pylori未清除小鼠, 以壳聚糖为佐剂组H. pylori的定植密度显著低于其他各组(F = 24.16, P<0.05-0.001); 含佐剂组胃黏膜急性炎症程度显著低于对照组和单纯H. pylori抗原组(H = 21.873, P<0.05-0.001), 以壳聚糖为佐剂组胃黏膜的慢性炎症程度显著低于对照组、单纯H. pylori抗原组和以CT为佐剂组(H = 20.213, P<0.05-0.001). 含佐剂组唾液和胃黏膜内抗H. pylori IgA(唾液: 3.28±1.38, 2.81±1.56, 3.03±1.52; 胃黏膜: 60.18±19.87, 63.01±20.92, 61.16±22.25)及血清抗H. pylori IgG(12.73±3.95, 12.06±4.84, 11.83±4.31)显著高于对照组(唾液: 1.19±0.63, 胃黏膜: 15.56±6.24, 血清: 6.56±3.50)和单纯抗原组(唾液: 1.32±0.30, 胃黏膜: 27.25±6.56, 血清: 7.86±4.02)(P<0.05-0.001).
结论: 以壳聚糖为佐剂的H. pylori疫苗对H. pylori感染具有免疫治疗作用, 并可成功诱导黏膜局部的特异性体液免疫应答.
引文著录: 谢勇, 龚燕锋, 周南进, 陈江, 吕农华, 梅承誉, 侯晓华. 以壳聚糖为佐剂的幽门螺杆菌疫苗的免疫治疗作用. 世界华人消化杂志 2007; 15(6): 561-567
Revised: December 1, 2006
Accepted: December 22, 2006
Published online: February 28, 2007
AIM: To investigate the roles of H. pylori vaccine with chitosan as adjuvant in the immunological therapy of H. pylori infection.
METHODS: Female BALB/c mice infected H. pylori were randomly divided into group A, B, C, D and E, which were treated with phosphate buffered saline (PBS), H. pylori antigen, H. pyloriantigen plus chitosan solution, H. pylori antigen plus chitosan particles, and H. pylori antigen plus cholera toxin (CT), respectively. The vaccine was orally given once a week for 4 weeks. At the 4th week after the last immunization, these mice were killed and gastric mucosa were embedded in paraffin, then assayed with Giemsa and HE staining. At the same time, quantitative H. pylori culture was performed, and enzyme-linked immunosorbnent assay (ELISA) was used to detect anti-H. pylori IgA in saliva and gastric mucosa and anti-H. pylori IgG in serum.
RESULTS: In the groups with chitosan as adjuvant, the eradication of H. pylori was achieved in 58.33% mice, which was in accordance with that in the group with CT as adjuvant (45.45%), and the colonization density of H. pylori in the groups with chitosan as adjuvant was significantly lower than that in the other groups (F = 24.166, P < 0.05-0.001). The degrees of acute inflammation in gastric mucosal were significantly lower in mice with adjuvant than those in group A and B (H = 21.873, P < 0.05-0.001); the degrees of chronic inflammation in gastric mucosal were significantly lower in the groups with adjuvant chitosan than those in the other groups (H = 20.213, P < 0.05-0.001). The levels of specific anti-H. pylori IgA in gastric mucosa (60.18 ± 19.87, 63.01 ± 20.92, 61.16 ± 22.25) and saliva (3.28 ± 1.38, 2.81 ± 1.56, 3.03 ± 1.52), and specific anti-H. pylori IgG (12.73 ± 3.95, 12.06 ± 4.84, 11.83 ± 4.31) in sera in the groups with adjuvant were significantly higher than those in group A (saliva:1.19 ± 0.63, gastric mucosa: 15.56 ± 6.24, serum: 6.56 ± 3.50) and group B (saliva: 1.32 ± 0.30, gastric mucosa: 27.25 ± 6.56, serum: 7.86 ± 4.02) (P < 0.05-0.001).
CONCLUSION: H. pylori vaccine with chitosan as adjuvant can eradicate or significantly reduce H. pylori colonization in the gastric mucosa of mice and induce local specific humoral immune response in gastric mucosa successfully.
- Citation: Xie Y, Gong YF, Zhou NJ, Chen J, Lv NH, Mei CY, Hou XH. Immune therapeutic effect of Helicobacter pylori vaccine with chitosan adjuvant. Shijie Huaren Xiaohua Zazhi 2007; 15(6): 561-567
- URL: https://www.wjgnet.com/1009-3079/full/v15/i6/561.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i6.561
已有研究证实幽门螺杆菌(Helicobacter pylori, H. pylori)疫苗接种可保护动物免受H. pylori感染[1-3], 然而治疗性疫苗的研究相对较少. H. pylori抗原经黏膜免疫需要有效的黏膜佐剂, 目前最为有效且最常用的佐剂是霍乱毒素(CT)和大肠杆菌不耐热毒素(LT), 但其对人体的毒副作用大, 不能应用于人类, 目前尚无一种高效、无毒、完全适用于人类的黏膜佐剂. 筛选有效而又无毒副作用的黏膜佐剂是H. pylori疫苗研究难点与热点. 壳聚糖是甲壳素的脱乙酰化产物, 他具有良好的生物学特性, 无毒、无刺激性、无抗原性、组织相容性良好、在体内可降解吸收[4]. 国外学者研究表明壳聚糖可有效的促进局部(特别是黏膜局部)的免疫反应, 增强抗原传递系统功能, 具有免疫佐剂的效应[5-8]. 我们以前的研究已证实以壳聚糖为佐剂的H. pylori疫苗对H. pylori感染具有免疫保护作用[9-10], 但是他对H. pylori感染是否具有免疫治疗作用尚不清楚, 本研究观察了以壳聚糖为佐剂的H. pylori疫苗对H. pylori感染的免疫治疗作用, 并初步探讨了其作用机制.
♀清洁级BALB/c小鼠, 6-8周龄, 平均体质量22.5 g, 购自中科院上海实验动物中心, 并在SPF级实验室(江西省药物研究所)内饲养. 88.5%脱乙酰度壳聚糖, 上海其胜生物制品有限公司产品. 空肠弯曲菌琼脂基础、布氏肉汤培养基础, 中国腹泻病控制上海试剂供应研究中心产品. 兔抗鼠IgA和辣根过氧酶标记的羊抗鼠IgA, 美国Zymed-Laboratories inc.产品. 辣根过氧酶标记的羊抗鼠IgG, 美国Sigma-Aldrich inc.产品. 链霉卵白素-过氧化物酶系列试剂盒, 北京中山生物技术有限公司产品, 霍乱毒素(CT), 美国Sigma产品. H. pylori国际标准菌株SS1由中国H. pylori菌株库提供.
1.2.1 H. pylori的培养及H. pylori抗原的制备: 采用H. pylori标准菌株SS1, 将其接种在含75 mL/L无菌绵羊血的空肠弯曲菌选择性培养琼脂基础上, 微需氧条件下培养2-3 d, 用布氏肉汤洗脱细菌收集, 并在660 nm波长下测细菌密度, 1A值为1011 CFU/L. H. pylori SS1标准菌株培养2-3 d后, 以PBS洗脱, 并洗涤3次, 超声粉碎后, 在4℃下以8000 g离心30 min, 取上清, 蛋白定量后, 置-85℃冰箱备用.
1.2.2 壳聚糖颗粒和酸溶液的制备: 88.5%脱乙酰度壳聚糖与生理盐水配成10 g/L的溶液, 再经超声(输出功率80 Hz)处理2次, 每次5 min, 间隔1 min, 以600 r/min离心10 min后取其上清, 并以400目网筛过滤, 再以1400 g离心10 min后收集其沉淀物, 即为壳聚糖小颗粒[11]. 将88.5%脱乙酰度壳聚糖按30 g/L的比例溶解于8 mL/L乙酸盐水中即成壳聚糖酸溶液[12].
1.2.3 BALB/c小鼠H. pylori感染动物模型的建立: 6-8周龄的清洁级的BALB/c小鼠, 给予含1×1012/L的H. pylori SS1活菌液, 0.5 mL/只灌胃, 隔日1次, 共5次. 末次灌胃12 wk后, 取4只小鼠杀死后取胃黏膜进行病理检查和H. pylori培养, 二者皆证实H. pylori感染模型已建立.
1.2.4 免疫治疗: 将小鼠按随机表格随机分为5组: 空白对照组: PBS溶液, 12只; H. pylori抗原组, 11只; H. pylori抗原+壳聚糖酸溶液组, 12只; H. pylori抗原+壳聚糖颗粒组, 12只; H. pylori抗原+CT组, 11只. H. pylori抗原1.2 mg/只/次, CT 5 μg/只/次, 壳聚糖颗粒500 μg/只/次, 壳聚糖酸溶液在所需各组中配成含壳聚糖5 g/L的终溶液. 已确立H. pylori感染的小鼠, 在末次灌菌12 wk时, 分别按上述分组和剂量于第0, 7, 14, 21天灌胃各免疫1次, 0.4 mL/只/次, 含有壳聚糖颗粒组, 灌胃前先经超声以20 Hz的输出功率混匀[11]. 末次免疫后4 wk, 禁食、禁水24 h后, 先腹腔内注射20 g/L毛果芸香碱0.4 mL, 收集唾液后, 摘除眼球取血, 处死小鼠, 无菌条件下, 取胃黏膜用于H. pylori培养、免疫学检测和病理学检测.
1.2.5 胃黏膜内H. pylori的测定: 采用定量H. pylori培养和病理改良Giemsa染色法测定. 二者皆阴性记为阴性, 两者之一阳性记为阳性. H. pylori定量培养: 胃黏膜在无菌条件下称重, 加布氏肉汤0.3 mL匀浆, 按一定比例(1:1, 1:4, 1:8)稀释, 取0.5 mL涂布于含75 mL/L无菌羊血的空肠弯曲菌琼脂基上, 微需氧条件下培养2-3 d. 鉴定细菌后, 计算H. pylori菌落数, 结果以菌落数/g(湿质量组织)表示. Giemsa染色: 胃黏膜石蜡切片改良Giemsa染色. 在高倍镜下观察, 根据胃黏膜内H. pylori多少分别计0-4分[13].
1.2.6 胃黏膜病理组织学检测: 石蜡切片, HE染色, 根据固有层急炎性症细胞(中性粒细胞)和慢性炎症细胞(淋巴细胞和浆细胞)的浸润程度按Sakagami 的标准分为0-3级[13].
1.2.7 胃黏膜内和唾液H. pylori抗体的检测: 采用间接ELISA法, 血清1:100稀释, 唾液1:5稀释, 胃黏膜匀浆上清液1:2稀释. 结果在血清和唾液以A待测标本/A标准阴性之比表示. 胃黏膜内抗H. pylori IgA以每g胃黏膜湿质量A待测标本/A标准阴性表示.
统计学处理 计数资料采用卡方检验(精确概率法), 等级资料采用多个样本比较的秩和检验(Kruskal-Wallis法); 计量资料, 胃黏膜内H. pylori定量培养的菌落数为偏态分布资料, 采用几何均数, 其余资料为算术均数, 多组间的比较采用方差分析, 两两间的比较采用q检验. 应用SPSS11.0统计软件处理, P值<0.05为差异有统计学意义.
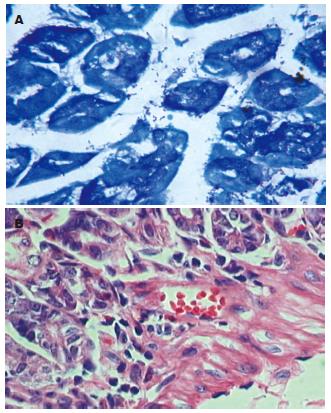
H. pylori末次灌胃12 wk后, 处死4只小鼠, 取胃黏膜H. pylori培养和Giemsa染色, H. pylori均阳性(图1A); 病理学检测证实有胃黏膜炎症存在(图1B), 证实H. pylori已定植.
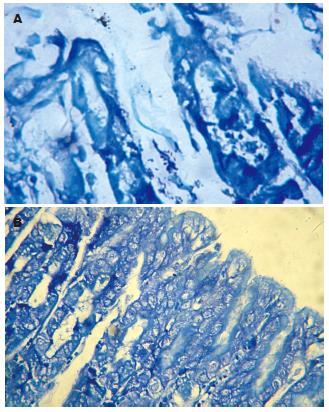
各组的H. pylori免疫清除率有显著差异(P<0.001), 其中以壳聚糖为佐剂组显著高于对照组和单纯H. pylori抗原组(P<0.05和0.005), 以CT为佐剂组显著高于对照组(P<0.05)(表1). 各组的H. pylori感染程度有明显差异(P<0.005), 进一步进行两两比较发现含佐剂H. pylori定植密度显著低于对照组(P<0.05-0.001); 以壳聚糖为佐剂组H. pylori的定植密度还显著低于单纯H. pylori抗原组(P<0.05)(图2, 表1). 对H. pylori未清除小鼠进行H. pylori定量培养, 各组H. pylori定植密度有显著差异(F = 24.166, P<0.001), 进一步进行两两比较发现对照组的H. pylori定植密度显著高其他各组(P<0.001),以壳聚糖为佐剂的各组H. pylori定植密度显著低于单纯H. pylori抗原组和以CT为佐剂组(P<0.05-0.01)(表2).
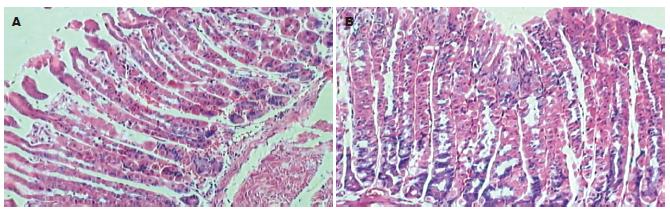
各组胃黏膜慢性炎症程度有显著差异(H = 20.213, P<0.001), 其中含壳聚糖各组的慢性炎症程度显著低于不含壳聚糖各组(P<0.05-0.001)(图3, 表3). 各组胃黏膜急性炎症程度有显著差异(H = 21.873, P<0.001), 含佐剂各组的急性炎症程度显著低于对照组和单纯H. pylori抗原组(P<0.05-0.001)(表3).
H. pylori疫苗不仅具有免疫保护作用, 有些疫苗也同时具有免疫治疗作用. 动物实验研究发现, 以H. pylori全菌抗原为基础的疫苗对H. pylori感染动物模型有一定的治疗效果[14-18]. Nystrom et al[16]用H. pylori的溶解物加CT口服免疫已感染H. pylori小鼠后, 可明显减少H. pylori在胃内定植, 并成功的诱导了抗H. pylori的特异性体液免疫反应和TH1免疫反应. 本研究发现以壳聚糖和CT为佐剂的H. pylori疫苗经口服免疫可治疗H. pylori感染, 其对H. pylori感染的清除率达58.33%-45.45%, 并且在H. pylori未根除的小鼠H. pylori在胃黏膜内的定植密度也显著低于对照组和无佐剂组, 表明以壳聚糖和CT为佐剂的H. pylori疫苗对H. pylori感染具有免疫治疗作用. 治疗性免疫的成功有十分重要的意义, 因为他证明了疫苗接种的成功不是因为在H. pylori感染之前诱导了免疫应答, 而是因为疫苗接种必定诱导了数量上或质量上与H. pylori慢性感染所不同的免疫应答, 打破了H. pylori感染所致的机体免疫耐受.
迄今为止, 所有证明有效的疫苗都需要一个合适的抗原呈递系统, 即存在佐剂依赖性或载体依赖性, 单纯的H. pylori抗原不能诱导保护性免疫应答, 目前H. pylori疫苗常用的黏膜佐剂是CT和LT, 但其对人体的毒副作用大, 不能应用于人类. 许多研究表明, 壳聚糖可有效促进局部(特别是黏膜局部)免疫应答, 增强抗原呈递系统的功能, 具有免疫佐剂效应. 国外学者报道壳聚糖作为脑膜炎球菌和支气管炎博德特菌疫苗的黏膜佐剂可成功的诱导保护性免疫反应[19-20]. 本研究发现以壳聚糖为佐剂的H. pylori疫苗其对H. pylori感染的免疫清除率可达58.33%, 与以CT为佐剂的H. pylori疫苗的免疫清除率(45.45%)相近, 明显高于单纯H. pylori抗原组及对照组, 提示壳聚糖可替代CT, 作为H. pylori疫苗的黏膜佐剂. H. pylori定量检测发现, 在H. pylori未根除小鼠, 以壳聚糖为佐剂的H. pylori疫苗组小鼠胃黏膜内H. pylori的定植密度显著低于以CT为佐剂组, 说明壳聚糖的佐剂效应优于CT.
人体感染H. pylori后虽可产生免疫应答, 血清中可检出高滴度抗H. pylori IgG抗体, 但这种免疫应答不足以清除胃黏膜表面的H. pylori, 感染终身存在. IgG因其可激活补体及诱导粒-单细胞在感染部位聚集, 释放炎性介质及活性氧等损害胃上皮细胞, 而被认为有引起免疫损伤作用, 但近来有学者认为IgG亦具有免疫保护作用[21], 目前尚无定论. 我们的研究发现, 以壳聚糖和CT为佐剂的H. pylori疫苗可刺激小鼠产生抗H. pylori IgG, 虽然这一免疫应答是否具有免疫治疗作用有待进一步证实, 但说明壳聚糖作为H. pylori疫苗的免疫佐剂可诱导全身体液免疫应答, Bacon et al[22]将壳聚糖与亚单位流感病毒疫苗合用, 发现壳聚糖可明显提高局部和血清抗体反应, 这与本研究结果一致.
本研究发现, 以壳聚糖为佐剂组唾液和胃黏膜内抗H. pylori IgA含量显著高于对照组和无佐剂组, 与以CT为佐剂组无差别, 说明壳聚糖可替代CT作为H. pylori疫苗的黏膜佐剂. IgA是黏膜免疫应答中的保护性抗体, 由黏膜固有层浆细胞分泌, 作为机体黏膜屏障可抵御外源抗原分子侵入、中和胞外病原微生物、结合抗原形成免疫复合物由吞噬细胞吞噬清除, 他可非特异地针对某一病原体, 而发挥局部防御作用, IgA在H. pylori疫苗的免疫保护作用中也起着重要作用. Goto et al[23]用H. pylori SS1全菌抗原以不同剂量与CT联合免疫接种于C57BL/6小鼠, 并用H. pylori活菌进行攻击, 发现与攻击前相比粪便和唾液中抗H. pylori特异性IgA水平明显升高, 并发现局部sIgA与H. pylori疫苗的免疫保护作用有良好相关性. Lee et al[24]以LT为佐剂与尿素酶共同作用于小鼠, 结果产生抗尿素酶sIgA抗体, 使60%-100%小鼠获得保护性免疫而抵御H felis攻击. 本研究以壳聚糖为佐剂的H. pylori疫苗, 可诱导胃黏膜局部产生特异性抗H. pylori IgA, 这可能在其免疫清除H. pylori感染中起重要作用.
H. pylori治疗性疫苗的研究相对较少. H. pylori抗原经黏膜免疫需要有效的黏膜佐剂, 传统的黏膜佐剂对人体的毒副作用大, 不能应用于人类. 壳聚糖无毒、无刺激性、无抗原性、组织相容性良好、在体内可降解吸收. 研究表明壳聚糖可有效的促进局(特别是黏膜局)的免疫反应, 增强抗原传递系统功能, 具有免疫佐剂的效应, 因此其有望成为H. pylori疫苗的黏膜佐剂.
H. pylori疫苗的研究是近年来幽门螺杆菌相关性疾病防治研究中的重点和热点, 目前H. pylori蛋白疫苗研究所面临的最大挑战就是选择 高效无毒的黏膜佐剂, 这一问题一直是限制H. pylori疫苗发展的“瓶颈”. 人们正在积极寻找高效无毒的新型佐剂, 以期突破这一限制H. pylori疫苗发展的“瓶颈”.
现已普遍认为H. pylori疫苗是在全球范围内控制H. pylori感染的最有效方法, 治疗性H. pylori的研发具有重要的临床应用价值, 以无毒副作用的壳聚糖为佐剂的H. pylori疫苗如研制成功将具有良好的应用前景.
治疗性疫苗的研发具有重要的临床应用价值, 作者以壳聚糖作为免疫佐剂, 成功诱导幽门螺杆菌感染小鼠产生抗H. pylori IgG抗、抗H. pylori IgA, 为今后临床应用提供了前景.设计合理, 分析客观.
电编: 李琪 编辑:张焕兰
| 1. | Jeremy AH, Du Y, Dixon MF, Robinson PA, Crabtree JE. Protection against Helicobacter pylori infection in the Mongolian gerbil after prophylactic vaccination. Microbes Infect. 2006;8:340-346. [PubMed] |
| 2. | 焦 志勇, 陈 旻湖, 朱 森林, 李 国庆, 胡 品津. 表达ureB/hlyE融合蛋白的重组减毒鼠伤寒沙门疫苗菌预防幽门螺旋杆菌感染. 世界华人消化杂志. 2005;13:787-789. [DOI] |
| 4. | Synowiecki J, Al-Khateeb NA. Production, properties, and some new applications of chitin and its derivatives. Crit Rev Food Sci Nutr. 2003;43:145-171. [PubMed] |
| 5. | van der Lubben IM, Verhoef JC, Borchard G, Junginger HE. Chitosan and its derivatives in mucosal drug and vaccine delivery. Eur J Pharm Sci. 2001;14:201-207. [PubMed] |
| 6. | Huo Z, Sinha R, McNeela EA, Borrow R, Giemza R, Cosgrove C, Heath PT, Mills KH, Rappuoli R, Griffin GE. Induction of protective serum meningococcal bactericidal and diphtheria-neutralizing antibodies and mucosal immunoglobulin A in volunteers by nasal insufflations of the Neisseria meningitidis serogroup C polysaccharide-CRM197 conjugate vaccine mixed with chitosan. Infect Immun. 2005;73:8256-8265. [PubMed] |
| 7. | Borges O, Borchard G, Verhoef JC, de Sousa A, Junginger HE. Preparation of coated nanoparticles for a new mucosal vaccine delivery system. Int J Pharm. 2005;299:155-166. [PubMed] |
| 8. | Read RC, Naylor SC, Potter CW, Bond J, Jabbal-Gill I, Fisher A, Illum L, Jennings R. Effective nasal influenza vaccine delivery using chitosan. Vaccine. 2005;23:4367-4374. [PubMed] |
| 9. | 谢 勇, 龚 燕锋, 周 南进, 陈 江, 周 小江, 吕 农华, 王 崇文. 胃黏膜局部免疫反应在以壳聚糖为佐剂的幽门螺杆菌疫苗免疫保护中的作用. 中华医学杂志. 2005;85:2629-2635. |
| 10. | Yong Xie, Yanfeng Gong, Jianng Chen, Shuiyin Xiong, Nonghua Lu, Chongwen Wang. The study of adjuvant efficacy of chitosan in H. pylori vaccine and its mechanism of immunological protection. J gastroenterology hepatology. 2004;19:A367. |
| 11. | Shibata Y, Foster LA, Metzger WJ, Myrvik QN. Alveolar macrophage priming by intravenous administration of chitin particles, polymers of N-acetyl-D-glucosamine, in mice. Infect Immun. 1997;65:1734-1741. [PubMed] |
| 12. | Westerink MA, Smithson SL, Srivastava N, Blonder J, Coeshott C, Rosenthal GJ. ProJuvant (Pluronic F127/chitosan) enhances the immune response to intranasally administered tetanus toxoid. Vaccine. 2001;20:711-723. [PubMed] |
| 13. | Sakagami T, Dixon M, O'Rourke J, Howlett R, Alderuccio F, Vella J, Shimoyama T, Lee A. Atrophic gastric changes in both Helicobacter felis and Helicobacter pylori infected mice are host dependent and separate from antral gastritis. Gut. 1996;39:639-648. [PubMed] |
| 14. | Losonsky GA, Kotloff KL, Walker RI. B cell responses in gastric antrum and duodenum following oral inactivated Helicobacter pylori whole cell (HWC) vaccine and LT(R192G) in H. pylori seronegative individuals. Vaccine. 2003;21:562-565. [PubMed] |
| 15. | Kotloff KL, Sztein MB, Wasserman SS, Losonsky GA, DiLorenzo SC, Walker RI. Safety and immunogenicity of oral inactivated whole-cell Helicobacter pylori vaccine with adjuvant among volunteers with or without subclinical infection. Infect Immun. 2001;69:3581-3590. [PubMed] |
| 16. | Nystrom J, Raghavan S, Svennerholm AM. Mucosal immune responses are related to reduction of bacterial colonization in the stomach after therapeutic Helicobacter pylori immunization in mice. Microbes Infect. 2006;8:442-449. [PubMed] |
| 17. | Chui SY, Clay TM, Lyerly HK, Morse MA. The development of therapeutic and preventive vaccines for gastric cancer and Helicobacter pylori. Cancer Epidemiol Biomarkers Prev. 2005;14:1883-1889. [PubMed] |
| 18. | 白 杨, 梁 燕玲, 刘 秀丽, 施 理, 王 继德, 张 兆山, 周 殿元, 张 亚历. 黏附素保守区疫苗防治鼠幽门螺杆菌感染. 世界华人消化杂志. 2005;13:468-471. [DOI] |
| 19. | Kang ML, Kang SG, Jiang HL, Shin SW, Lee DY, Ahn JM, Rayamahji N, Park IK, Shin SJ, Cho CS. In vivo induction of mucosal immune responses by intranasal administration of chitosan microspheres containing Bordetella bronchiseptica DNT. Eur J Pharm Biopharm. 2006;63:215-220. [PubMed] |
| 20. | Baudner BC, Verhoef JC, Giuliani MM, Peppoloni S, Rappuoli R, Del Giudice G, Junginger HE. Protective immune responses to meningococcal C conjugate vaccine after intranasal immunization of mice with the LTK63 mutant plus chitosan or trimethyl chitosan chloride as novel delivery platform. J Drug Target. 2005;13:489-498. [PubMed] |
| 21. | Bogstedt AK, Nava S, Wadstrom T, Hammarstrom L. Helicobacter pylori infections in IgA deficiency: lack of role for the secretory immune system. Clin Exp Immunol. 1996;105:202-204. [PubMed] |
| 22. | Bacon A, Makin J, Sizer PJ, Jabbal-Gill I, Hinchcliffe M, Illum L, Chatfield S, Roberts M. Carbohydrate biopolymers enhance antibody responses to mucosally delivered vaccine antigens. Infect Immun. 2000;68:5764-5770. [PubMed] |
| 23. | Goto T, Nishizono A, Fujioka T, Ikewaki J, Mifune K, Nasu M. Local secretory immunoglobulin A and postimmunization gastritis correlate with protection against Helicobacter pylori infection after oral vaccination of mice. Infect Immun. 1999;67:2531-2539. [PubMed] |
| 24. | Lee CK, Weltzin R, Thomas WD Jr, Kleanthous H, Ermak TH, Soman G, Hill JE, Ackerman SK, Monath TP. Oral immunization with recombinant Helicobacter pylori urease induces secretory IgA antibodies and protects mice from challenge with Helicobacter felis. J Infect Dis. 1995;172:161-172. [PubMed] |