修回日期: 2006-12-01
接受日期: 2006-12-18
在线出版日期: 2007-02-28
目的: 观察阳离子脂质体介导的CD/5-FC自杀基因体系协同γ-IFN在正常免疫力小型动物体内对肿瘤的抑制效应及远端旁观者效应.
方法: 采用阳离子脂质体介导CD基因质粒瞬时转染小鼠肝癌H22及空质粒转染的H22细胞, 分别接种于KM鼠双侧前腋下皮下; 向小鼠体内注射5-FC及γ-IFN, 观察在γ-IFN协同作用下对转染CD基因瘤体的抑制作用和远距离空质粒转染瘤体的抑制即远端旁观者效应.
结果: 5-FC对转染CD基因侧瘤体抑制明显, 抑制率为79.39%; 在γ-IFN的协同下CD/5-FC的抑瘤作用得到了增强, 抑制率为93.47%, 与无γ-IFN协同作用相比, 对癌细胞抑制率明显增强(t = 3.49, P = 0.0036); 存在远端旁观者效应, 远端未转染瘤体的抑制率为54.42%; 在γ-IFN的协同下远端旁观者效应得到显著增强, 抑制率达到88.43%, 同无γ-IFN相比有差异有显著性(t = 2.86, P = 0.0212).
结论: 体内CD/5-FC自杀基因体系联合γ-IFN对肝癌细胞有更好的抑制效应, 对肝癌的治疗有很好的应用前景.
引文著录: 刘国彦, 姚娇, 罗琪. CD/5-FC自杀基因体系在正常免疫力动物体内的抑瘤及旁观者效应. 世界华人消化杂志 2007; 15(6): 554-560
Revised: December 1, 2006
Accepted: December 18, 2006
Published online: February 28, 2007
AIM: To investigate the anticancer and distant bystander effect of CD/5-FC suicide gene system combined with g-IFN in normal mice.
METHODS: H22 cells instantly transfected with cytosine deaminase (CD) gene plasmid (lipo-CD) or empty plasmid, mediated by cation liposome, were subcutaneously inoculated into the left or right axilla of Kunming mice, respectively. Then the mice were injected with 5-FC and g-interferon (γ-IFN) once per day, and the anticancer effect and distant bystander effects were compared when g-IFN was used or not.
RESULTS: 5-FC obviously inhibited the growth of tumors transfected with lipo-CD, and the inhibitory efficiency was 79.39%. When in combination with g-IFN, the inhibitory efficiency (93.47%) was strengthened significantly (t = 3.49, P = 0.0036). There was a notable bystander effect in CD/5-FC suicide gene system in vivo, and the suppressive rate was 54.42% for the distant tumor cells without transfection. When in combination with γ-IFN, the inhibition rate (88.43%) was strengthened greatly (t = 2.86, P = 0.0212).
CONCLUSION: CD/5-FC suicide system combined with g-IFN has more significant anticancer effects and may be used as a promising method in the treatment of liver cancer.
- Citation: Liu GY, Yao J, Luo Q. Tumor inhibition and bystander effect of CD/5-FC suicide gene system in normal mice. Shijie Huaren Xiaohua Zazhi 2007; 15(6): 554-560
- URL: https://www.wjgnet.com/1009-3079/full/v15/i6/554.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i6.554
基因治疗肿瘤是现代医学研究中的前沿课题, 自杀基因治疗是其中的热点之一. "旁观者效应"(bystander effect, BE)使得该治疗被广泛看好和倾注研究热情, CD/5-FC自杀基因体系的研究在体外、裸鼠体内、小型到大型正常免疫力动物体内的实验环境和条件是完全不一样的, 实验结果则可能迥然不同, 正常的免疫力可能会使得旁观者效应进一步增强, 有助于抑杀肿瘤细胞, 我们通过研究CD/5-FC自杀基因体系在正常免疫力的小型动物KM鼠体内对肝癌H22的杀伤及远距离旁观者效应, 并观察在γ-IFN协同作用下的变化, 提供了更接近临床的自杀基因治疗的实验依据.
小鼠肝癌H22细胞购自中国医学科学院药物研究所. 该细胞株可以对应接种于KM鼠(昆明鼠)体内. 细胞在小鼠体内腹水培养及传代. ♂KM(昆明鼠)体质量18-20 g, 购自军事医学科学院实验动物中心. 阳离子脂质体lipofectamine-TM购自Invitrogen公司; 5-FC购自Sigma公司; 干扰素(γ-IFN)购自Sigma公司. 质粒pCDNA3.1-CD由本课题组保存, 包含Neor和Ampr及CD基因(胞嘧啶脱氨酶基因), 具有CMV启动子和来自SV40病毒的启动子、增强子、及终止信号, 转入哺乳动物细胞后能在哺乳动物细胞中获得一定水平的表达. 在真核与原核细胞中分别用含G418和氨苄青霉素的培养基进行选择性培养. 转染该质粒的真核细胞可合成真核细胞没有的胞嘧啶脱氨酶, 从而转化5-FC为5-FU.
将小鼠随机分为A, B, C, D四组. 各小鼠的左侧瘤加编号1区分(转染CD质粒), 右侧加编号2区分(未转染CD质粒), 则接种瘤体可分为A1, A2, B1, B2, C1, C2, D1, D2八组. 其中A组为对照组, 腹腔及皮下均注射生理盐水: B组腹腔给生理盐水, 皮下给IFN 1万U; C组腹腔给5-FC 500 mg/kg, 皮下给生理盐水; D组腹腔给5-FC 500 mg/kg, 皮下给IFN 1万U. 由种瘤24 h后开始给药, 均每日1次, 连续注射15 d.
1.2.1 接种的H22细胞: 取KM鼠腹水传代的H22细胞, 用生理盐水洗2次, 均分成甲乙两液, 甲液中加入瞬时转染液, 细胞数/脂质体/pCDNA3.1-CD质粒为: 1×105个/20 μL/10 μg. 室温放置15 min, 用生理盐水稀释细胞到1×109/L, 乙液直接加生理盐水配成细胞浓度1×109/L.
1.2.2 KM鼠H22肝癌模型的建立: 小鼠左前肢腋下皮下注射配好的H22细胞甲液0.1 mL, 小鼠右前肢腋下皮下注射配好的H22细胞乙液0.1 mL.
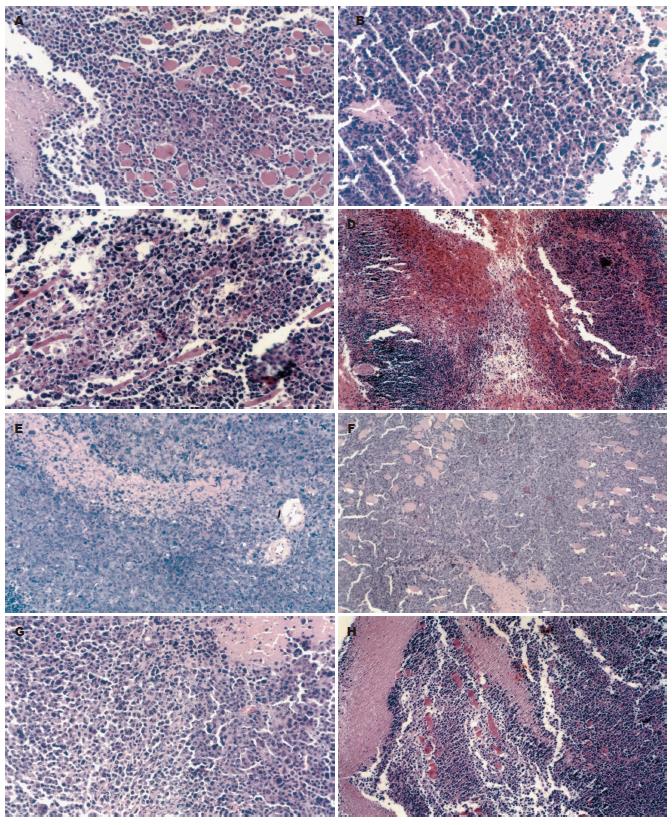
1.2.3 CD/5-FC对H22细胞杀伤效率的测定: 按照公式a•b2/2计算体积, 绘制4组小鼠共8组瘤子的生长曲线, 取时间点第3、6、9、12、15天; 称取第16天所有瘤体的质量(g)进行比较. (注: CD+, CD-分别为转染CD基因及未转染CD基因). 肿瘤抑制率 = [对照组质量(CD+)-试验组质量(CD+)]/ 对照组质量(CD+); 旁观者效应=[对照组质量(CD-)-试验组质量(CD-)] /对照组质量(CD-). 比较转基因组A1, B1, C1, D1的肿瘤抑制率; 比较A2, B2, C2, D2四组BE. 将取下的瘤体常规福尔马林浸泡14 d, 做石蜡包埋, HE染色, 比较8组瘤体杀伤的病理学光镜下差异.
统计学处理 用SPSS10.0统计软件包进行处理, 组间采用方差分析后, 双侧t检验.
阳离子脂质体对细胞的毒性很小, 在本实验的A组中, 腹腔和皮下均为给生理盐水, 生长15 d, 最终瘤质量(g): A1 = 1.99±0.48、A2 = 2.12±0.49, 两者差异无显著性(t = 0.53, P = 0.61>0.05), 病理学观察也无差异. 均为实体瘤组织, 瘤细胞排列紧密, 多呈小圆形, 少数瘤巨细胞, 核分裂像多见, 瘤细胞形态良好. 故瞬时转染对细胞的生长可以认为没有影响(图1A-B).
A1, B1, C1, D1四组均为接种CD基因瞬时转染的H22细胞, CD+的H22细胞能够被5-FC杀死, 而且IFN能对CD+的H22细胞产生增强的免疫攻击, 导致H22细胞杀伤. A1组瘤质量(g)为1.99±0.48, C1组的瘤质量(g)为0.41±0.10, 两者的差异有显著性意义(t = 9.21, P<0.05), 抑制率为79.39%; IFN可以协同增加5-FC对H22细胞的杀伤效率, D1的瘤质量(g)为0.13±0.02, 抑制率为93.47%, 比较C1、D1组差异有显著性意义(t = 3.49, P = 0.0036<0.01); IFN可以直接导致CD+的 H22细胞的杀伤, B1的瘤质量(g)为0.58±0.21, 抑制率为71.02%, 同A1组比较瘤质量差异有显著性(t = 7.97, P<0.01), 但同C1相比较差异无显著性意义(t = 1.91, P = 0.0773>0.05). 说明免疫机制对该自杀基因导致肿瘤细胞直接抑杀中的重要作用. 由生长曲线可以直观这种显著的差异: 病理学光镜下可见: B1可见多数瘤细胞变性坏死, 灶状坏死; C1瘤组织部分瘤细胞坏死崩解, 周围瘤细胞变性; D1瘤组织, 瘤细胞广泛坏死, 多发灶状出血, 纤维组织和脂肪组织增生(图1C-E).
A2, B2, C2, D2四组为右侧前肢腋下皮下种植未瞬时转染的H22细胞, 5-FC对未转染细胞没有杀伤效果. A2组的瘤质量(g)为2.12±0.49, C2组瘤质量(g)为0.97±0.59, 比较两者差异有显著性(t = 4.26, P = 0.0008<0.01), 可得出CD/-5-FC有较好的远端BE, 抑制率为54.42%; 由A2, B2组比较可以观察到IFN对恶性肿瘤有较好的抑制作用, B2组瘤质量(g)为0.92±0.68, 同A2相比较差异有显著性(t = 4.02, P = 0.0015<0.01), 抑制率为56.43%, 由D2组可以观察到IFN对远端BE有很好的协同增强效应, D2组的瘤质量(g)为0.25±0.13, 同C2组相比较差异有显著性(t = 3.44, P = 0.0108<0.05), 抑制率达到88.43%. B2和C2比较差异无显著性意义(t = 0.3688, P=0.7232>0.05), 再次说明免疫机制在远距离BE中的重要作用. 由生长曲线可以直观肿瘤的远距离BE. 病理学光镜下可见: B2可见少数灶状或小片状坏死, 瘤细胞形态清晰, 瘤巨细胞数量较多; C2基本类似B2; D2多灶状坏死, 融合成片状(图1G-H).
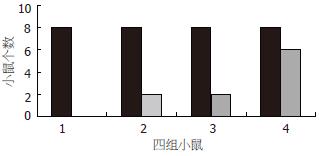
D2组IFN协同CD/5-FC自杀基因体系对H22瘤体的杀伤作用, 导致D2组的2例完全杀伤效果, 瘤体消失, D2的完全抑制数为该组25%. A2, B2, C2三组则无完全抑制例数.
A1(对照组)均全部出瘤, B1组有2例被完全抑制, C1组也有2例被完全抑制, D1组则有6例被完全抑制, A1对比B1、C1组差异有显著性(P<0.05), 说明CD/5-FC自杀基因体系在IFN的协同下对肿瘤的抑制有显著的增强(图2).
自杀基因疗法又称酶/药物前体疗法(enzyme prodrug therapy, VDEPT), 是用药物敏感基因感染肿瘤细胞提高肿瘤细胞对药物敏感而杀死肿瘤细胞, 其中CD/5-FC自杀基因系统是目前研究最快, 进展最多的自杀基因体系之一, CD基因编码大肠杆菌胞嘧啶脱氨酶, 使细胞内无毒性抗真菌药物5-氟胞嘧啶(5-FC)代谢为有细胞毒性的5-氟尿嘧啶(5-FU), 后者有明显的抗肿瘤活性.
CD/5-FC体系治疗肿瘤时可产生具有临床应用实际价值的BE[1-2], 即肿瘤细胞少量的转染可导致更多的肿瘤细胞被抑杀, 为肿瘤细胞的"根治性抑杀"带来希望. 谭宇蕙 et al[3]构建的大鼠肝癌细胞HSV-tk/GCV自杀基因系统体外旁观者效应的研究中, 当转染率为5%-10%就已有较低的BE. 陈海金 et al[4]研究慢病毒介导的KDR启动子驱动CD/TK双自杀基因系统对大肠肿瘤细胞选择性杀伤作用, 观察到双自杀基因在体外的显著的BE. 张雷 et al[5]研究比较了CD/5-FC系统和HSV-tk/GCV系统对人胰腺癌细胞的疗效, 发现两者都有很好的抗肿瘤活性, 但前者BE要显著大于后者; 其良好的BE与以下一些机制有关[6]: (1)细胞间缝隙连接(gap junctional intercellular communication GJIC)介导的细胞毒性药物或(和)凋亡小体传递[7-9]. 多数学者认为GJIC是自杀基因表达产物前药代谢为细胞毒性产物5-FU的良好通道. Kuriyama et al和Huber et al认为CD/5-FC的BE是由于5-FC的代谢产物5-FU通过非易化扩散自由进出细胞, 并不仅仅依靠GJIC[10-11]. BE使靶细胞内基因表达产物通过GJIC传递到周围细胞, 在杀伤周围细胞同时延长了自杀基因的表达和其自身的存活时间, 这无疑增强了BE[12]. (2)激活免疫机制. 肿瘤细胞被自杀基因杀伤后, 其残余碎片含有肽类物质, 这些肽类物质被浸润的巨嗜细胞等抗原递呈细胞摄取加工, 然后递呈给CD4+T淋巴细胞, 进而激活CD8+T淋巴细胞, 并使其增殖, 扩大其肿瘤杀伤作用及产生杀灭机体远处部位接种的肿瘤细胞. 具有弱免疫原性的靶细胞转入CD基因后, 能被5-FC抑杀, 而且能够产生免疫记忆, 故经5-FC抑杀后的肿瘤细胞可作为抗瘤疫苗[13-14]. 另外有人认为, CD蛋白本身可能是一种超抗原, 可激活免疫介导的抑瘤作用[15]. Hogge et al[16]和Shi et al[17]的研究表明自杀基因引起肿瘤细胞死亡后, 释放出肿瘤源性肽类被APC摄取, 然后激活CTL细胞, 局部表达的GM-CSF则显著增强这种抗原递呈能力, 从而增强杀伤和BE. Sakai et al[18]在肝细胞癌的HSV-TK/GCV治疗体系中, 联合使用单核趋化蛋白-1基因治疗, 可显著增强GCV的疗效. Chen et al[19]联合IL-2基因和HSV-TK基因用于结肠癌肝转移模型的治疗, 结果表明联合TK和IL-2基因较单个基因具有显著更好的效果. (3)瘤体缺血机制. Ram et al[20]认为处于分裂活跃状态的肿瘤血管内皮细胞, 在应用病毒载体转染时, 极易被导入自杀基因而受到前药的损伤, 导致肿瘤因供血障碍而出现缺血性坏死.
在体内试验研究中, 很多研究者认为完整的免疫功能对自杀基因的BE是必需的. Freeman et al[21]用HSV-TK转导的肿瘤细胞接种免疫全能的小鼠, 随后用GCV处理, 近90%的肿瘤细胞消退; 相反, 免疫缺陷的裸鼠(缺乏T细胞免疫)接种转导HSV-TK的肿瘤细胞并用GCV处理, 无明显肿瘤消退效应. 有免疫力动物组的免疫组化和RT-PCR则检测到TNF-alpha, IL-1, IL-6的mRNA及GM-CSF的存在; Caruso et al[22]发现在接种了自杀基因的免疫全能的小鼠肿瘤组织周围和肿瘤内有大量的巨噬细胞和T淋巴细胞浸润. 本课题在小型正常免疫力动物KM鼠体内CD/5-FC对H22细胞抑制的研究中, B1和C1组的比较、B2和C2组的比较差异无显著性意义, 表明正常免疫机制对转染自杀基因细胞的直接抑杀和BE有很强作用, BE的发生同免疫机制存在密切联系.
Consalvo et al[23]首先发现了远距离BE(distant bystander effect), 用CD转导的肿瘤细胞接种在鼠的一侧皮下, 给予5-FC后, 可使肺内的转移灶消退, 远距离BE的机制尚未阐明, Kianmanesh et al[24]提出可能与细胞杀死后释放抗原刺激机体的免疫系统有关. Nanni et al[25]的研究表明:联合转染CD及γ-IFN基因, 在体内表达CD及γ-IFN蛋白, 在不给予5-FC前药的条件下, 肿瘤细胞就被显著抑制, 体内试验远处肺转移癌被显著抑制, 但在裸鼠抑制则不明显. 这也支持免疫功能的健全在远距离BE中是必要的. 本研究就CD/5-FC(腹腔给药)协同鼠γ-IFN(皮下给药)在KM鼠体内对H22细胞的杀伤、抑制及远端BE做一研究, 采用在两个点瞬时转染CD基因和无CD基因的空质粒的方法观察远距离BE的发生, 结果表明, 在未给予前药5-FC但给予IFN的条件下, 体内转CD侧癌细胞被显著抑制, 且诱导免疫攻击远距离未转染的癌细胞, 也有抑制作用; 联合给予5-FC及γ-IFN, 对CD+癌细胞的抑制较仅给予5-FC有显著的增强, 且远距离BE也较单独因素(单独给5-FC或IFN)显著增强. 说明增强免疫力对提高CD/5-FC直接杀伤癌细胞和远距离BE是很有必要的. 免疫功能的介导是BE和远距离BE作用的主要机制之一, IFN作为一种已被广泛应用的成熟的廉价的生物因子, 可以作为CD/5-FC抑制恶性肿瘤很好的增强因子, 两者的联合, 对肿瘤的抑杀以及远距离BE的作用, 用于晚期恶性肿瘤的"根治性"治疗具有很好的应用前景.
目前自杀基因的抑癌体系现还存在很多不足, 如单自杀基因存在细胞及组织特异性和治疗的耐药性, 目的基因转染率过低等, 针对驱动子选择性的双自杀基因以及新转染方法的研究则成了该研究领域的热点. 如利用肿瘤特异性基因调控元件调控自杀基因表达, erbB-2, α-人乳白蛋白(hALA)启动子驱动自杀基因进行乳腺癌基因治疗, 甲胎蛋白(AFP)基因启动子用于肝癌自杀基因疗法, 癌胚抗原(CEA)基因启动子用于肠道肿瘤自杀基因疗法. 又如李强 et al[26]的研究表明: KDR启动子驱动双自杀基因靶向选择性地杀伤人胃癌SCG7901细胞, 并存在BE, 且较单自杀基因有更好的抑杀效果. Rogulski et al[27]试验表明转导CD/HSV-1TK融合基因的神经胶质瘤细胞易被杀灭, 该基因表达具有双重作用的融合蛋白(CDglyTK), 他导致的协同细胞毒作用是单用的2-3倍, 且可使表达细胞有更好的放射敏感性, 是单用CD/5-FC体系的2.44倍. Rogulski et al[28]的研究表明, 双自杀基因(CD-HSV-TK)治疗对大的肿瘤组织更加有效, 可使其体积减少99%, 显著降低肿瘤的压迫效应. 新的转染方法研究也是自杀基因治疗研究的热点和难点, Carrio et al[29]在胰腺癌动物模型中, 联合使用腺病毒和逆转录病毒两种载体进行HSV-tk/GCV治疗, 肿瘤体积缩小更为显著. Kanyama et al[30]使用日本嗜血病毒-脂质体系统携带CD基因重复转染胰腺癌细胞, 效果较为理想. 在慢病毒载体的研究, Gusella et al[31]己经成功将携带标记基因的慢病毒载体转导到BALB/C小鼠肾脏细胞. Follenzi et al[32]应用改良的慢病毒载体可有效地转导大鼠肝脏实质及非实质细胞、脾脏和骨髓细胞, 并可稳定表达标记基因. 陈海金 et al[4]则用慢病毒介导转染双自杀基因, 并有较高的转染效率和抑杀效果. 未来, 特异性的启动子、更好的基因转染方法、多自杀基因联合及辅助免疫增强生物因子将大大的提高了自杀基因的应用前景.
基因治疗是一种将外源性遗传物质导入目的器官、组织或细胞并显示出相应的生物学效应, 从而防治疾病的技术方法. 其中恶性肿瘤所使用的基因治疗方法包括自杀基因、抑癌基因, 反义核酸序列、细胞因子及免疫相关基因、药物抵抗基因等, 有“分子手术” 之称的自杀基因疗法已成为当前基因治疗领域的热点, 具有多种优势. 自杀基因/前体药物体系之所以是众多基因治疗方案中较有前途的一种方法, 主要特点是存在旁观者效应, 这种效应明显地增强了自杀基因对肿瘤的杀伤作用, 在相当程度上弥补了基因治疗方法转染效率低的难题. 这点的克服对恶性肿瘤的基因治疗尤为重要.
CD/5-FC体系是自杀基因研究领域的热点, 目前很多的自杀基因研究集中在新的自杀基因/前体药物的开发上以及基因转染、给药渠道上, 但目前接近临床的相关研究较少, 也是研究的重点和亟待解决的问题.
自杀基因治疗进入临床需要大量的正常免疫力动物实验, 现已有较多的体外自杀基因的相关研究和一些体内的相关研究, 本研究针对小型免疫全能动物体内远距离旁观者效应, 并结合 γ-IFN协同加强免疫力研究免疫力对抑杀肿瘤及远距离旁观者效应的作用, 提供了更加接近临床的实 验数据.
自杀基因: 为病毒和细菌等原核生物含有的一类基因, 其编码的酶能将无毒(或低毒)的药物前体转化为细胞毒性药物.将这类基因导入靶细胞, 使靶细胞对相应的药物前体产生杀伤敏感性的治疗策略被称为“自杀基因疗法”.旁观者效应: 即转入自杀基因的肿瘤细胞虽只有一部分, 但经药物前体治疗后却引起肿瘤整体抑制, 不但转基因的肿瘤细胞被杀灭, 且周围大量未转染的癌细胞也被杀死.
CD/5-FC自杀基因体系的研究在外、裸 鼠 体内、小型到大型正常免疫力动物内的实验环境和条件是完全不一样的, 实 验 结果则可能迥然不同. 本试 验 在小型免疫全能动物体内(KM鼠体内) 研究CD/5-FC(腹腔给药 ) 协同 鼠γ-IFN(皮下给药)对H 2 2 细胞的杀伤、抑制及远端旁观者效应, 实验表明: 增强免疫力对提高CD/5-FC直接杀伤癌细胞和远距离旁观者效应有显著性意义, 提供了更加接近临床的自杀基因治疗的实验数据, 具有重要的临床价值.
电编: 李琪 编辑:王晓瑜
| 1. | Moolten FL. Tumor chemosensitivity conferred by inserted herpes thymidine kinase genes: paradigm for a prospective cancer control strategy. Cancer Res. 1986;46:5276-5281. [PubMed] |
| 2. | Mullen CA. Metabolic suicide genes in gene therapy. Pharmacol Ther. 1994;63:199-207. [PubMed] |
| 3. | 谭 宇蕙, 吴 映雅, 杜 标炎, 胡 岳山, 赵 鹏, 李 杰芬. 大鼠肝癌细胞HSV-tk/GCV自杀基因系统的构建及其旁观者效应. 世界华人消化杂志. 2005;13:2069-2073. [DOI] |
| 6. | Deonarain MP, Epenetos AA. Targeting enzymes for cancer therapy: old enzymes in new roles. Br J Cancer. 1994;70:786-794. [PubMed] |
| 7. | Dilber MS, Abedi MR, Christensson B, Bjorkstrand B, Kidder GM, Naus CC, Gahrton G, Smith CI. Gap junctions promote the bystander effect of herpes simplex virus thymidine kinase in vivo. Cancer Res. 1997;57:1523-1528. [PubMed] |
| 8. | Ishii-Morita H, Agbaria R, Mullen CA, Hirano H, Koeplin DA, Ram Z, Oldfield EH, Johns DG, Blaese RM. Mechanism of 'bystander effect' killing in the herpes simplex thymidine kinase gene therapy model of cancer treatment. Gene Ther. 1997;4:244-251. [PubMed] |
| 9. | Mesnil M, Piccoli C, Tiraby G, Willecke K, Yamasaki H. Bystander killing of cancer cells by herpes simplex virus thymidine kinase gene is mediated by connexins. Proc Natl Acad Sci USA. 1996;93:1831-1835. [PubMed] |
| 10. | Kuriyama S, Masui K, Sakamoto T, Nakatani T, Kikukawa M, Tsujinoue H, Mitoro A, Yamazaki M, Yoshiji H, Fukui H. Bystander effect caused by cytosine deaminase gene and 5-fluorocytosine in vitro is substantially mediated by generated 5-fluorouracil. Anticancer Res. 1998;18:3399-3406. [PubMed] |
| 11. | Huber BE, Austin EA, Good SS, Knick VC, Tibbels S, Richards CA. In vivo antitumor activity of 5-fluorocytosine on human colorectal carcinoma cells genetically modified to express cytosine deaminase. Cancer Res. 1993;53:4619-4626. [PubMed] |
| 12. | Wygoda MR, Wilson MR, Davis MA, Trosko JE, Rehemtulla A, Lawrence TS. Protection of herpes simplex virus thymidine kinase-transduced cells from ganciclovir-mediated cytotoxicity by bystander cells: the Good Samaritan effect. Cancer Res. 1997;57:1699-1703. [PubMed] |
| 13. | Mullen CA, Coale MM, Lowe R, Blaese RM. Tumors expressing the cytosine deaminase suicide gene can be eliminated in vivo with 5-fluorocytosine and induce protective immunity to wild type tumor. Cancer Res. 1994;54:1503-1506. [PubMed] |
| 14. | Nielsen CS, Moorman DW, Levy JP, Link CJ Jr. Herpes simplex thymidine kinase gene transfer is required for complete regression of murine colon adenocarcinoma. Am Surg. 1997;63:617-620. [PubMed] |
| 15. | McLellan AD, Sorg RV, Williams LA, Hart DN. Human dendritic cells activate T lymphocytes via a CD40: CD40 ligand-dependent pathway. Eur J Immunol. 1996;26:1204-1210. [PubMed] |
| 16. | Hogge GS, Burkholder JK, Culp J, Albertini MR, Dubielzig RR, Yang NS, MacEwen EG. Preclinical development of human granulocyte-macrophage colony-stimulating factor-transfected melanoma cell vaccine using established canine cell lines and normal dogs. Cancer Gene Ther. 1999;6:26-36. [PubMed] |
| 17. | Shi FS, Weber S, Gan J, Rakhmilevich AL, Mahvi DM. Granulocyte-macrophage colony-stimulating factor (GM-CSF) secreted by cDNA-transfected tumor cells induces a more potent antitumor response than exogenous GM-CSF. Cancer Gene Ther. 1999;6:81-88. [PubMed] |
| 18. | Sakai Y, Kaneko S, Nakamoto Y, Kagaya T, Mukaida N, Kobayashi K. Enhanced anti-tumor effects of herpes simplex virus thymidine kinase/ganciclovir system by codelivering monocyte chemoattractant protein-1 in hepatocellular carcinoma. Cancer Gene Ther. 2001;8:695-704. [PubMed] |
| 19. | Chen SH, Chen XH, Wang Y, Kosai K, Finegold MJ, Rich SS, Woo SL. Combination gene therapy for liver metastasis of colon carcinoma in vivo. Proc Natl Acad Sci USA. 1995;92:2577-2581. [PubMed] |
| 20. | Ram Z, Walbridge S, Shawker T, Culver KW, Blaese RM, Oldfield EH. The effect of thymidine kinase transduction and ganciclovir therapy on tumor vasculature and growth of 9L gliomas in rats. J Neurosurg. 1994;81:256-260. [PubMed] |
| 21. | Freeman SM, Abboud CN, Whartenby KA, Packman CH, Koeplin DS, Moolten FL, Abraham GN. The "bystander effect": tumor regression when a fraction of the tumor mass is genetically modified. Cancer Res. 1993;53:5274-5283. [PubMed] |
| 22. | Caruso M, Panis Y, Gagandeep S, Houssin D, Salzmann JL, Klatzmann D. Regression of established macroscopic liver metastases after in situ transduction of a suicide gene. Proc Natl Acad Sci USA. 1993;90:7024-7028. [PubMed] |
| 23. | Consalvo M, Mullen CA, Modesti A, Musiani P, Allione A, Cavallo F, Giovarelli M, Forni G. 5-Fluorocytosine-induced eradication of murine adenocarcinomas engineered to express the cytosine deaminase suicide gene requires host immune competence and leaves an efficient memory. J Immunol. 1995;154:5302-5312. [PubMed] |
| 24. | Kianmanesh AR, Perrin H, Panis Y, Fabre M, Nagy HJ, Houssin D, Klatzmann D. A "distant" bystander effect of suicide gene therapy: regression of nontransduced tumors together with a distant transduced tumor. Hum Gene Ther. 1997;8:1807-1814. [PubMed] |
| 25. | Nanni P, De Giovanni C, Nicoletti G, Landuzzi L, Rossi I, Frabetti F, Giovarelli M, Forni G, Cavallo F, Di Carlo E. The immune response elicited by mammary adenocarcinoma cells transduced with interferon-gamma and cytosine deaminase genes cures lung metastases by parental cells. Hum Gene Ther. 1998;9:217-224. [PubMed] |
| 27. | Rogulski KR, Kim JH, Kim SH, Freytag SO. Glioma cells transduced with an Escherichia coli CD/HSV-1 TK fusion gene exhibit enhanced metabolic suicide and radiosensitivity. Hum Gene Ther. 1997;8:73-85. [PubMed] |
| 28. | Rogulski KR, Zhang K, Kolozsvary A, Kim JH, Freytag SO. Pronounced antitumor effects and tumor radiosensitization of double suicide gene therapy. Clin Cancer Res. 1997;3:2081-2088. [PubMed] |
| 29. | Carrio M, Romagosa A, Mercade E, Mazo A, Nadal M, Gomez-Foix AM, Fillat C. Enhanced pancreatic tumor regression by a combination of adenovirus and retrovirus-mediated delivery of the herpes simplex virus thymidine kinase gene. Gene Ther. 1999;6:547-553. [PubMed] |
| 30. | Kanyama H, Tomita N, Yamano T, Aihara T, Miyoshi Y, Ohue M, Sekimoto M, Sakita I, Tamaki Y, Kaneda Y. Usefulness of repeated direct intratumoral gene transfer using hemagglutinating virus of Japan-liposome method for cytosine deaminase suicide gene therapy. Cancer Res. 2001;61:14-18. [PubMed] |
| 31. | Gusella GL, Fedorova E, Hanss B, Marras D, Klotman ME, Klotman PE. Lentiviral gene transduction of kidney. Hum Gene Ther. 2002;13:407-414. [PubMed] |
| 32. | Follenzi A, Sabatino G, Lombardo A, Boccaccio C, Naldini L. Efficient gene delivery and targeted expression to hepatocytes in vivo by improved lentiviral vectors. Hum Gene Ther. 2002;13:243-260. [PubMed] |