修回日期: 2006-12-01
接受日期: 2006-12-01
在线出版日期: 2007-02-18
目的: 探讨慢性肝炎患者经过亚硒酸钠作用前后树突状细胞(DC)功能的改变及机制, 寻求改善DC功能的途径.
方法: 慢性乙肝患者28例外周血, 每份血分成2份, 不加亚硒酸钠处理的为A组, 加亚硒酸钠者为B组. 健康献血者12例为对照组(C). 采用MTT法通过MLR检测DC对同种异体淋巴细胞的增殖能力及ELISA法检测细胞因子IL-12的分泌. 用比色法检测3组DC内GSH-Px活性、MDA含量和膜流动性.
结果: A组与C组相比, DC分泌IL-12水平(12.46±0.17 ng/L vs 21.43±0.43 ng/L, P<0.05)和刺激自身淋巴细胞反应能力明显降低; B组比A组相比显著升高(16.93±0.32 ng/L vs 12.46±0.17 ng/L, P<0.05). DC细胞内GSH-Px活性A组明显低于C组(65.35±5.37 U/106细胞 vs 94.73±4.81 U/106细胞, P<0.05), B组高于A组和C组(107.13±3.42 U/106细胞 vs 65.35 ±5.37, 94.73±4.81 U/106细胞, P<0.05). MDA含量A组明显高于B组和C组(1.75±0.21 U/106细胞 vs 1.09±0.17, 0.82±0.13 U/106细胞, P<0.05). B组膜流动性与A组相比保持良好.
结论: 体外经亚硒酸钠作用后的乙肝患者的DC可有效的刺激淋巴细胞增殖反应, 并可提高IL-12分泌水平, 保持膜流动性, 增强对自由基损伤的抵抗能力.
引文著录: 陈显兵, 管小琴. 亚硒酸钠对慢性乙型肝炎患者外周血树突状细胞的作用及机制. 世界华人消化杂志 2007; 15(5): 528-532
Revised: December 1, 2006
Accepted: December 1, 2006
Published online: February 18, 2007
AIM: To observe the changes of dendritic cells separated from patients with chronic hepatitis B (CHB) after treatment of sodium selenite in order to find out an effective way for improving the function of dendritic cells.
METHODS: The peripheral blood was collected from 28 CHB patients, and each share of blood sample was assigned into 2 shares, one of which was treated with sodium selenite (group A) and the other served as positive control (group B). The blood from healthy individuals was used as normal control (group C). The effect of dendritic cells on the proliferation of allogeneic lymphocytes was examined by MTT assay using mixed lymphcyte reaction, and the secretion of interleukin-12 (IL-12) was measured by enzyme-linked immunosorbent assay (ELISA). Colorimetry was used to detect glutathione peroxidase (GSH-Px) activity, malondialdehyde content and membrane fluidity.
RESULTS: In comparison with those in group C, the level of IL-12 secretion (12.46 ± 0.17 ng/L vs 21.43 ± 0.43 ng/L, P < 0.05) and the proliferation of lymphocytes were significantly decreased in group A; however, as compared with those in group A, the level of IL-12 secretion (16.93 ± 0.32 ng/L vs 12.46 ± 0.17 ng/L, P < 0.05) and the proliferation of lymphocytes were increased in group B. The activity of GSH-Px in group A was markedly lower in group A (65.35 ± 5.37 U/106 cells vs 94.73 ± 4.81 U/106 cells, P < 0.05) than that in group C, and it was also remarkably higher in group B than that in group A or C (107.13 ± 3.42 U/106 cells vs 65.35 ± 5.37, 94.73 ± 4.81 U/106 cells, P < 0.05). MDA content was notably higher in group A than that in group B or C (1.75 ± 0.21 U/106 cells vs 1.09 ± 0.17, 0.82 ± 0.13 U/106 cells, P < 0.05). The membrane fluidity was relatively maintained in group B as compared with that in group A.
CONCLUSION: Dendritic cells treated with sodium selenite can effectively stimulate the proliferation of lymphocytes, enhance the secretion of IL-12, maintain the membrane fluidity, and increase the resistance of tissues to free radical-induced injury.
- Citation: Chen XB, Guan XQ. Effect of sodium selenite on the function of dendritic cells from patients with chronic hepatitis B and its mechanism. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 528-532
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/528.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.528
慢性乙型肝炎是乙肝病毒(HBV)持续感染造成的, 机体免疫功能低下是造成HBV持续感染的原因之一. 研究发现, 乙肝患者外周血单核细胞来源的树突状细胞(dendritic cells, DC)在数量、成熟状态和免疫功能上存在缺陷, 与HBV特异性的T细胞耐受形成有关[1]. 我们比较慢性乙型肝炎患者外周血单核细胞经常规细胞因子诱导的DC经硒处理后在免疫功能及丙二醛(MDA)、谷光甘肽过氧化物酶(GSH-PX)含量等方面的差别. 初步探讨慢性乙型肝炎患者DC功能缺陷的机制, 为以后基于DC的慢性乙型肝炎的免疫治疗提供理论基础. 硒又称抗肝细胞坏死因子, 在保护肝细胞、抗病毒、抗肿瘤等方面研究很多, 但对DC的保护和功能影响方面国内外尚未见公开报道.
本院附属医院、州传染病医院就诊慢性乙型肝炎患者28例, 年龄21-45(平均38.1)岁, 男17例, 女11例. 慢性乙型肝炎诊断符合2000年西安中华医学会传染病与寄生虫病学分会、肝病学分会联合修订标准[2], 排除HAV, HCV, HDV, HEV等病毒及其他原因(药物、酒精、中毒)造成的急慢性肝损伤. 健康自愿者12例, 年龄23-37(平均29.2)岁, 男8例, 女4例. 研究对象均无心脑肾等疾病, 及其他器官合并症. 所有患者及健康志愿者血液采集均经本人知情同意. 人重组粒细胞-单核细胞刺激集落因子(rhGM-CSF)、人重组白细胞介素4(rhIL-4)、干扰素α(IFN-α)、无血清培养基AIM-V购自美国Gibco公司, 淋巴细胞分离液(1.077 kg/L)购自天津TBD公司. 鼠抗人CD80(FITC)、CD86(PE) mAb, IL-12p70ELISA试剂盒购自晶美公司. 亚硒酸钠购自北京中联试剂公司AR级试剂. MDA, GSH-PX试剂盒购自南京建成公司. 荧光探剂DPH购自Sigma公司.
把乙肝患者外周血来源的DC分成2份, 一份直接培养诱导为乙肝组; 另一份加入亚硒酸钠(0.3 mmol/L)共培养为加硒组, 健康人外周血DC为对照组. 从外周血单核细胞中分离培养DC, 具体方法参照Romani et al[3]方法.
1.2.1 DC功能测定: 同种混合淋巴细胞反应(MLR): 每一标本均取同一个体淋巴细胞, 调整细胞浓度. 将收获的DC细胞, 用AIM-V悬浮, 先用丝裂霉素25 mg/L处理45 min, Hank's洗3遍, 调整浓度为1×108/L, 加入效应细胞孔中, 淋巴细胞: DC数量分别为10:1, 20:1, 50:1, 阴性孔不加DC, 每组设5个复孔, 培养3 d. MTT法检测细胞活性: 加入MTT(5 g/L) 20 μL, 培养4 h, 吸去上清加入150 μL二甲亚砜(DMSO), 振荡10 min, 使结晶充分溶解, 用酶联免疫检测仪于570 nm处, 测A值并记录结果, 用5孔均值表示DC刺激淋巴细胞增殖能力表示. IL-l2P70检测: 采用IL-12P70 ELISA试剂盒检测, 严格按照说明书操作, 酶标仪读数, 作标准曲线, 确定含量.
1.2.2 MDA和GSH-Px活力测定: 第7天培养的DC调整细胞浓度为1×109/L. 取100 μL加入900 μL的PBS缓冲液, 置-70℃冰箱中反复冻融2次, 致细胞完全破裂, 然后于4℃下8000 g离心15 min, 去胞核碎片, 取上清液分别按MDA和GSH-Px试剂盒说明书操作, 分别532 nm(MDA)和412 nm(GSH-Px)波长下测光密度(A值), 计算GSH-Px活力单位(GSH-PX活力 = (非酶管A值-酶管A值)/(标准管A值-空白管A值)×标准管浓度 × 稀释倍数 × 样本测试前稀释倍数). GSH-Px活力单位规定为: 1×105个DC细胞的上清液在37℃反应5 min, 扣除非酶反应, 使GSH浓度降低1 μg分子为一个酶活力单位.
MDA的值表示为1×105个DC细胞的上清液的含量. MDA含量计算公式: MDA含量 (μmol/L) = (测定管吸光度-测定空白管吸光度)/(标准管吸光度-标准空白管吸光度)×标准品浓度×样本测试前稀释倍数.
1.2.3 DC膜流动性的测定: 收集各组细胞, 用Beccerica[4]法测定膜流动性. 各组细胞悬于AIM-V培养基中, 细胞浓度为1×109/L. 加等量2×106 mol/L的荧光探剂DPH(Sigma产品), 于25℃温育30 min, 在MPF-4型荧光分光光度计上, 432 nm(发射光)/362 nm(激发光)条件下, 测定荧光偏振度(ρ), 并计算成微黏度(η). η值与膜流动性呈反比.
统计学处理 用SAS9.0程序进行方差分析, 结果以均数±标准差(mean±SD)表示, P<0.05表示差异显著, P>0.05表示无显著差异.
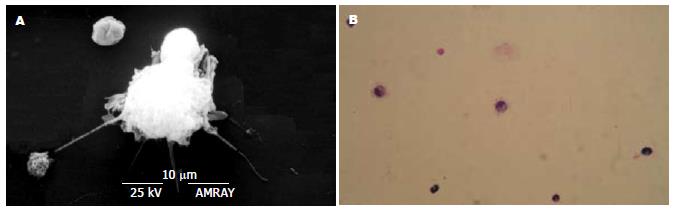
倒置显微镜下观察诱导的DC呈悬浮生长, 于培养的1-2 d可见细胞呈单层均匀分布, 于3-4 d, 可见细胞呈积聚趋势, 簇状生长, 形成大小不等的DC细胞集落, 形态较不规则, 可见DC细胞表面有许多"毛刺". 培养至7 d, 可见到大量具有树突状突起的悬浮细胞. 并随着培养时间的延长, 细胞变大, 突起更明显. 同时观察到贴壁拉长的"巨噬细胞", 同样也随培养时间的延长, 细胞逐渐变大. 透射电镜观察到成熟的DC表面有多量突起, 胞核偏位, 核内染色质疏松, 常染色质多, 异染色质少, 附于核膜下及核仁周围, 核仁明显. 胞质有丰富线粒体和粗面内质网. 扫描电境观察到DC表面呈沟回状, 具有较多的细长突起. Wright-Giemsa染色见DC细胞大小不一、细胞体有明显突起, 细胞核较大, 形态各异, 细胞核内染色质疏松程度不一(图1).
同种混合淋巴细胞反应时, 少量的DC即可刺激自身淋巴细胞增殖, A值明显高于未加DC组. 乙肝组在在不同的比例下(1:10、1:20、1:50)刺激自身淋巴细胞增殖的能力比对照组明显降低, 加硒组明显高于乙肝组(P<0.01). 乙肝组DC分泌的IL-l2P70的水平明显低于对照组, 加硒组IL-l2P70的水平高于乙肝组(P<0.01)(表1).
我国是HBV感染的高发区, 约3千万为慢性乙型肝炎患者. HBV感染所形成的免疫功能低下是HBV感染慢性化的因素之一, 因此打破HBV感染后的免疫低下状态是治疗慢性乙型肝炎的关键[5]. 目前认为, DC是至今发现的抗原呈递细胞中功能最为强大的一类, 且是一种专职的抗原提呈细胞, 能对抗原进行捕获、加工、处理, 并通过外周血或淋巴管从淋巴组织中迁徙至靶器官中, 诱导活性T淋巴细胞的增殖, 进而形成有效的免疫保护力[6]. 研究发现, 慢性乙型肝炎患者外周血的DC功能往往是有缺陷性的, DC功能的缺陷是造成慢性病毒性肝炎感染者体内缺乏有效的CTL应答[7-8], 其DC在增殖数量和刺激淋巴细胞增殖能力上较正常人明显降低, 产生的IL-12水平亦下降, 认为DC功能损害是造成免疫反应低下、HBV持续感染的重要原因之一[9-10].
Arima et al[11]原位杂交PCR和原位RT-PCR检测发现慢性乙型肝炎患者约占20%-40%DC中含有HBV DNA和HBV RNA. HBV DNA在DC中定位表明, 在慢性乙型肝炎患者体内DC是HBV的肝外储存场所之一; DC中HBV RNA的定位则表明, DC可能也是HBV相关蛋白质合成场所. 病毒性肝炎的发病机制非常复杂, 自由基及其引发的脂质过氧化反应也是其分子病理学基础之一. 自由基参与了机体生理活动的某些有益环节, 如参与吞噬细胞杀菌过程以及核糖核苷的还原等, 但过多的自由基会导致细胞、亚细胞和分子结构的破坏, 并随着破坏层次逐渐扩展造成功能损伤, 因此构成很多疾病的病理学基础[12]. 大量研究发现, 自由基可诱导巨噬细胞、T细胞、B细胞凋亡. 影响Th1细胞产生IL-2; 而对Th2细胞产生的IL-4, IL-10则影响不大[13]. 慢性肝炎患者血中脂质过氧化物(LPO)含量明显升高, 外周血单个核细胞(PBMC)产生IL-2活性水平及其膜上IL-2受体表达能力下降, 而自由基攻击、脂质过氧化损伤可能是产生上述现象的原因之一[13-14]. 我们在实验中发现, 乙肝组DC细胞内脂质过氧化产物-丙二醛与对照组比较明显升高, 与上述观点相符. 另有文献报道硒可以改善肝脏的过氧化状态, 提高DC的抗氧化能力, 提示过量自由基与DC功能下降有一定的联系. 临床流行病学研究表明, 各型肝病患者均不同程度缺硒或血硒水平低下, 并与病情相关[14]. 有学者提出HBV、HCV存在及表达硒蛋白GSH-PX基因的理论[15-16], 进一步从基因及蛋白质水平证明HCV、HBV感染DC细胞后, 改变硒蛋白GSH-PX表达, 与硒结合蛋白相互作用从而干扰脂质过氧化作用, 影响DC的功能. 硒既能通过GSH-PX活性降低分解过氧化物及利用谷胱苷肽的还原作用发挥抗氧化作用, 又能增强维生素E的抗氧化功能, 从而阻止过氧化物对细胞膜、线粒体、及溶酶体膜上的脂质产生破坏性的过氧化反应, 保护细胞膜的完整性、稳定性及细胞的正常生理功能.
本实验显示, 慢性乙肝患者DC细胞内的GSH-PX活性降低, 从而进一步印证了HBV感染DC存在过氧化损伤及抗氧化损伤的能力减弱; 体外加入适当剂量的硒后GSH-PX活性升, 高提示补硒可以提高DC的抗氧化损伤的作用, 从而改善DC的功能. 我们在体外培养慢性乙型肝炎患者外周血DC中加硒后, 结果显示, 经硒作用后的乙肝患者的DC在刺激自身淋巴细胞增殖反应的中显示硒能够明显提高DC对淋巴细胞的增殖反应. 同时经硒作用后的DC分泌的细胞因子IL-12的量也明显升高. 提示硒在一定程度上能够恢复DC的功能. 有关硒的作用机制目前尚不清楚, 有研究认为, 硒通过改善免疫功能(如NK细胞活性, 细胞毒性、细胞活性及抗体形成)增加宿主的抵抗力,主要通过以下两个方面影响免疫细胞的功能[17-18]: 一方面, 硒可能直接在mRNA转录水平影响免疫活性细胞表面某些受体, IL-2R、转铁蛋白受体等表达; 另一方面与硒的抗氧化作用有关,硒和含硒酶可抑制细胞膜脂质过氧化损伤, 保护细胞的结构及膜的流动性, 维护细胞的功能表达.
近年来硒与免疫的关系日益受到大家重视. 硒对机体的非特异性免疫、细胞免疫和体液免疫均存在重要影响. 硒的摄入量如果不足时可损坏机体免疫系统的发育和功能. 补充适当剂量的硒可使细胞免疫, 体液免疫, 非特异性免疫功能得到改善, 有利于细胞毒性T淋巴细胞(CTL)的诱导, 并明显加强CTL的细胞毒活性, 能刺激蛋白质及抗体的产生, 还可以影响吞噬细胞的杀菌活力, 显著提高吞噬过程中吞噬细胞的存活率和吞噬率.
此外, 国内外有研究发现反转录病毒含有编码硒蛋白的UGA密码子, 提示硒与病毒复制有关[19]. 在病毒复制过程中, 硒的需要量增加导致硒缺乏时细胞的抗氧化作用降低, 并产生过量的毒害宿主细胞的氧自由基. 同时硒缺乏导致病毒基因组的氧化性损害, 诱导病毒致病性的突变. 认为补硒可预防某些病毒的复制, 还可能预防或调节病毒性疾病的病程[20].
HBV感染所形成的免疫功能低下是HBV感染慢性化的因素之一, 因此打破HBV感染后的免疫低下状态是治疗慢性乙型肝炎的关键. 目前认为, DC是至今发现的抗原呈递细胞中功能最为强大的一类, 慢性乙型肝炎患者外周血的DC功能往往是有缺陷性的, DC功能的缺陷是造成慢性病毒性肝炎感染者体内缺乏有效的CTL应答.
DC如何打破HBV感染后的免疫低下状态是治疗慢性乙型肝炎的研究课题之一, 本研究认为补硒可以提高DC的抗氧化损伤的作用, 从而改善D C的功能.结果可信, 结论较科学.
电编: 李琪 编辑:张焕兰
| 3. | Romani N, Reider D, Heuer M, Ebner S, Kampgen E, Eibl B, Niederwieser D, Schuler G. Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability. J Immunol Methods. 1996;196:137-151. [PubMed] |
| 4. | Beccerica E, Piergiacomi G, Curatola G, Ferretti G. Changes of lymphocyte membrane fluidity in rheumatoid arthritis: a fluorescence polarisation study. Ann Rheum Dis. 1988;47:472-477. [PubMed] |
| 5. | Lok AS. Chronic hepatitis B. N Engl J Med. 2002;346:1682. |
| 6. | Coombes BK, Mahony JB. Dendritic cell discoveries provide new insight into the cellular immunobiology of DNA vaccines. Immunol Lett. 2001;78:103-111. [PubMed] |
| 9. | Abe M, Kajino K, Akbar SM, Yamamura K, Onji M, Hino O. Loss of immunogenecity of liver dendritic cells from mouse with chronic hepatitis. Int J Mol Med. 2002;9:71-76. [PubMed] |
| 10. | Wang FS, Xing LH, Liu MX, Zhu CL, Liu HG, Wang HF, Lei ZY. Dysfunction of peripheral blood dendritic cells from patients with chronic hepatitis B virus infection. World J Gastroenterol. 2001;7:537-541. [PubMed] |
| 11. | Arima S, Akbar SM, Michitaka K, Horiike N, Nuriya H, Kohara M, Onji M. Impaired function of antigen-presenting dendritic cells in patients with chronic hepatitis B: localization of HBV DNA and HBV RNA in blood DC by in situ hybridization. Int J Mol Med. 2003;11:169-174. [PubMed] |
| 13. | Taylor-Robinson AW, Liew FY, Severn A, Xu D, McSorley SJ, Garside P, Padron J, Phillips RS. Regulation of the immune response by nitric oxide differentially produced by T helper type 1 and T helper type 2 cells. Eur J Immunol. 1994;24:980-984. [PubMed] |
| 15. | Zhang W, Cox AG, Taylor EW. Hepatitis C virus encodes a selenium-dependent glutathione peroxidase gene. Implications for oxidative stress as a risk factor in progression to hepatocellular carcinoma. Med Klin (Munich). 1999;94 Suppl 3:2-6. [PubMed] |
| 16. | Chrobot AM, Szaflarska-Szczepanik A, Drewa G. Antioxidant defense in children with chronic viral hepatitis B and C. Med Sci Monit. 2000;6:713-718. [PubMed] |
| 17. | Foster LH, Sumar S. Selenium in health and disease: a review. Crit Rev Food Sci Nutr. 1997;37:211-228. [PubMed] |
| 18. | Kiremidjian-Schumacher L, Roy M. Selenium and immune function. Z Ernahrungswiss. 1998;37 Suppl 1:50-56. [PubMed] |
| 19. | Aho H, Schwemmer M, Tessman D, Murphy D, Mattei G, Engel W, Adham IM. Isolation, expression, and chromosomal localization of the human mitochondrial capsule selenoprotein gene (MCSP). Genomics. 1996;32:184-90. [PubMed] |
| 20. | Levander OA, Beck MA. Interacting nutritional and infectious etiologies of Keshan disease. Insights from coxsackie virus B-induced myocarditis in mice deficient in selenium or vitamin E. Biol Trace Elem Res. 1997;56:5-21. [PubMed] |