修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-02-18
目的: 探讨原发于胃的恶性纤维组织细胞瘤(MFH)的临床病理学特征.
方法: 报道2个胃MFH病例, 描述其临床表现、组织学及免疫组化特征, 并复习国内外文献.
结果: 2例均为男性, 年龄34及71岁. 肿物体积大, 均位于胃体后壁. 切面灰白色, 编织状, 质韧, 肿物位于黏膜下, 累及胃壁全层, 黏膜面形成溃疡. 镜下示: 梭形纤维母细胞样肿瘤细胞呈交织状及束状排列, 胞质红染, 核卵圆形, 大而异型, 并见较多单核及多核瘤巨细胞, 其间见组织细胞样瘤细胞散在分布, 可见数量不等的炎细胞散在分布. 免疫表型: Vimentin弥漫阳性, A1-ACT、CD68及Lysozyme部分细胞阳性.
结论: 胃MFH是一种罕见的肿瘤, 病理特征和软组织MFH相同, 鉴别诊断有赖于免疫组化标记.
引文著录: 白辰光, 柯儒斌, 杨蕾, 马大烈. 胃恶性纤维组织细胞瘤临床病理特征. 世界华人消化杂志 2007; 15(5): 518-521
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: February 18, 2007
AIM: To study the clinical and pathological features of malignant fibrous histiocytoma (MFH) in the stomach.
METHODS: The clinical and pathological data of 2 patients with primary malignant fibrous histiocytoma of the stomach were analyzed, and the related literatures were reviewed.
RESULTS: The first case was a 71-year-old man with epigastralgia and dark stools. The second case was a 34-year-old man with epigastralgia and vomiting. The tumors in both cases were big in size, offwhite in color and located in the submucosal layer of posterior wall of gastric corpus. Histologically, it was composed of a mixture of pleomorphic fibroblast-like spindle cells, focally arranged in a storiform pattern, oval or round histiocyte-like cells and inflammatory cells. Immunohistochemically, the tumor cells expressed vimentin, CD68, lysozyme and alpha-1-antitrypsin, but were negative for other markers.
CONCLUSION: MFH of the stomach is rare, and its pathological feature is similar to MFH of the soft tissue. The diagnosis of gastric MFH depends on immunohistochemical labeling.
- Citation: Bai CG, Ke RB, Yang L, Ma DL. Primary malignant fibrous histiocytoma of the stomach: 2-case reports and review of the literatures. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 518-521
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/518.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.518
恶性纤维组织细胞瘤(malignant fibrous histiocytoma, MFH)是一种间叶源性恶性肿瘤, 好发于四肢软组织和体腔, 偶见于内脏器官[1-2]. 原发于胃的MFH极为少见, 国内外罕有报道[3-9]. 我们在总结胃间叶源性恶性肿瘤时发现2例胃MFH, 现作一报道, 并复习文献总结其临床病理特征.
例1: 患者男性, 71岁. 2004-03因"头晕、乏力1 mo, 上腹不适、黑便1 wk"入我院治疗. 入院检查: 血色素5.0 g, 胃镜示胃体肿物. 术中见: 肿物位于胃体后壁, 黏膜面溃疡, 侵及浆膜, 大小7.5 cm×4.5 cm, 侵犯胰体尾. 遂行姑息性全胃切除术. 例2: 患者男性, 34岁. 2004-10因"上腹不适伴进食呕吐"入当地医院治疗. 当地诊断: 胃窦部占位伴幽门梗阻. 后行手术, 但未能切除肿物. 12 mo以"胃饱胀, 进食呕吐4 mo, 腹部巨大肿物术后1 mo余"入我院治疗. 入院检查: 触诊发现剑突下及一6 cm×2.5 cm包块. MRI示胃体肿物. 术中见: 肿物位于胃体后壁, 侵及浆膜, 大小10 cm×10 cm, 侵犯胰体尾及脾脏, 累及肝十二指肠韧带. 遂行根治性全胃切除术加胰体尾、脾脏切除术.
标本经40 g/L甲醛固定, 常规脱水, 石蜡包埋, 4 μm厚切片, 光镜观察. 免疫组化染色采用EnVision微波二步法, 所用一抗均购自福州迈新生物技术有限公司, EnVision试剂盒为丹麦DAKO公司产品.
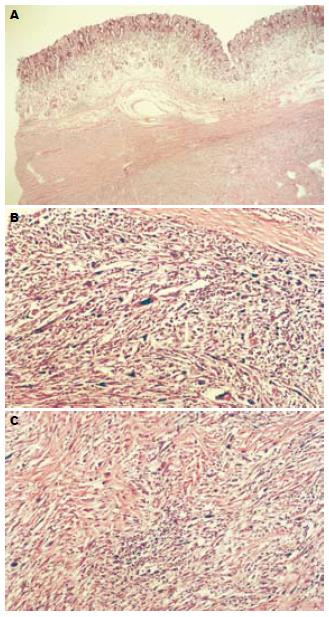
2例均为全胃切除标本, 肿物均位于胃体后壁, 大小分别为8 cm×4.5 cm×4 cm及12 cm×8 cm×8 cm. 切面灰白色, 编织状, 质韧, 肿物位于黏膜下(图1A), 累及胃壁全层, 黏膜面形成溃疡. 镜检梭形纤维母细胞样肿瘤细胞呈交织状及束状排列, 胞质红染, 核卵圆形, 大而异型, 并见较多单核及多核瘤巨细胞, 其间见圆形及卵圆形组织细胞样瘤细胞散在分布(图1B), 肿瘤组织累及胃壁全层, 可见数量不等的炎细胞散在分布(图1C). vimentin, PDGFRA弥漫阳性, α1抗糜蛋白酶(α1ACT), CD68及溶菌酶(lysozyme)部分细胞阳性, CD34, CD117, desmin, SMA, S-100, CD57, NSE, PCK(AE1/AE3), EMA, MCA和CR均阴性, P53高水平表达, PCNA低水平表达.
MFH来源于原始间叶细胞, 以往认为是由组织细胞和成纤维细胞组成的高度恶性肿瘤, 在软组织恶性肿瘤中发病率居首位[1,10], 又称纤维组织细胞肉瘤或恶性纤维黄色瘤、软组织恶性巨细胞瘤、恶性黄色肉芽肿和恶性组织组织细胞瘤. 1963年Ozell et al[11]首次报道该肿瘤, 1970年代初期被公认[12]. 随着免疫组织化学和电镜技术的应用, 诊断为MFH的病例越来越少, 其作为一个独立疾病类型的地位受到质疑[12-15]. 2002年, 最新版WHO分类[16]将MFH和未分化多形性肉瘤视为同义词, 变成一种排除性诊断, 占成人肉瘤的5%以下. MFH好发于中老年人的四肢、躯干及腹膜后, 也见于肺、肝、骨等处. 原发于消化道, 特别是胃的MFH则非常罕见, 国内外仅见10余例报道[3-9].
复习文献及我们报道的病例(表1)发现, 胃MFH发病年龄较大, 多为中老年男性, 年龄21-78(平均51.9)岁, 与软组织MFH相似[2]. 肿瘤大多位于黏膜下, 常见溃疡形成, 个别呈息肉样突入胃腔(病例6, 12). 肿瘤一般较大, 最大径3.5-20 cm, 中位数5.0 cm. 临床症状多为上腹部不适, 贫血和黑便也较常见, 部分病例有持续发热或无明显症状. 因临床症状没有特异性, 术前主要依靠胃镜和影像学检查发现, 但确诊困难, 只能依靠术后病理检查.
| 序号 | 性别 | 年龄(岁) | 临床症状 | 部位 | 最大径(cm) | 组织类型 | 预后 |
| 11[3] | 男 | 21 | 上腹部胀, 便血、贫血 | 胃小弯高位前壁 | 4.5 | 多形性型 | 术后2年肺转移 |
| 2[4] | 男 | 35 | 上腹部胀痛 | 胃小弯近贲门 | 20 | 未描述 | 未提供 |
| 23 | 男 | 71 | 上腹不适、黑便、贫血 | 胃体后壁近小弯 | 8 | 多形性型 | 术后13 mo死亡 |
| 24 | 男 | 34 | 上腹不适伴进食呕吐 | 胃体后壁 | 12 | 多形性型 | 术后5 mo存活 |
| 5[7] | 女 | 60 | - | - | 3.5 | 未描述 | 术后7 mo死亡 |
| 6[5] | 男 | 60 | 上腹不适、黑便 | 胃窦大弯 | 4.5 | 多形性型 | 术后3 mo死亡 |
| 7[6] | 男 | 42 | 黑便、贫血 | 贲门、胃底后壁 | 5.0 | 多形性型 | 术后17 mo死亡 |
| 8[7] | 男 | 51 | - | - | - | 多形性型 | 术后1 wk死亡 |
| 9[7] | 男 | 78 | 上腹痛, 体质量减轻 | 胃体后壁 | 5.0 | 多形性型 | 术后2年存活 |
| 10[7] | 男 | 77 | 贫血、发热、上腹痛 | 胃窦前壁近大弯 | 4.0 | 多形性型 | 术后4年死亡 |
| 11[8] | 女 | 37 | 孕期贫血 | 胃后壁 | 10.0 | 多形性型 | 术后38 mo存活 |
| 12[9] | 男 | 57 | 上腹疼痛伴黑便 | 胃角后壁 | 7.5 | 多形性型 | 术后6 mo死亡 |
原发于胃的MFH病理特征与软组织MFH相同, 肿瘤细胞多样化. 纤维母细胞样肿瘤细胞呈梭形, 细胞呈特征性的束状或轮辐状排列, 可见其向纤维细胞过渡. 组织细胞样肿瘤细胞, 胞质丰富, 体积较大, 有吞噬现象, 可吞噬脂质、细胞碎片、含铁血黄素颗粒等. 并可见多核巨细胞及单核瘤巨细胞, 核大而形态不规则, 染色深. 上述各种细胞都有不同程度的异型性, 核分裂像多见. 病理学依据瘤体中肿瘤细胞的主要成分将MFH分为多形性型、巨细胞型和炎症性型[16], 其中多形性MFH最多见, 约占总病例的75%[10]. 本文报道的病例形态学均符合多形性型, 即肥大的梭形纤维细胞样肿瘤细胞呈特征性的束状或轮辐状排列, 组织细胞样肿瘤细胞散在分布, 并见少量炎细胞灶性或散在分布. 文献报道的病例也均为多形性型(表1). 该肿瘤易复发和转移, 10例中2例复发[6-7], 转移多通过血道途径, 2例发生肺转移[3,9], 1例发生脑转移[5], 但也有1例报道胃周淋巴结转移[7].
免疫组化标记有助于胃的MFH的诊断和鉴别诊断. 该肿瘤Vimentin恒定弥漫阳性, 过去认为α1-抗胰蛋白酶(α1AT)、α1ACT、溶菌酶(lysozyme)和CD68是恶性纤维组织细胞理想的标记物, 现在认为对MFH诊断无帮助[16]. 原发于胃的MFH主要需与以下肿瘤鉴别诊断: 胃肠道间质瘤(CD34和C-Kit阳性)、平滑肌肿瘤(desimin和SMA阳性)、神经源性肿瘤(S-100阳性)、间皮肿瘤(MCA和CR阳性), 恶性黑色素瘤(S-100和HMB45阳性)和梭形细胞癌(EMA和CK阳性). 以上各类肿瘤均有特异性标志物, 因此通过免疫组化标记较易鉴别. 本文报道的病例免疫组化标记结果已排除上述肿瘤, 符合MFH的诊断标准[1].
同时, 免疫标记发现肿瘤细胞PDGFRA阳性, 与Yamamoto et al[17]报道一致, 提示PDGFRA及其相关因子在MFH的发生和发展中可能起着重要作用. 但是, 因为PDGFRA在间叶组织的发育过程中广泛发挥作用, 在多种类型的间叶肿瘤中均有不同程度的表达, 所以其抗体不能作为MFH的诊断标记物. 有报道显示P53蛋白在MFH中多呈较高水平表达, 且存在P53基因的突变, 提示P53基因在MFH的发病中可能起关键作用[18-20], 本文病例P53蛋白也均呈高水平表达.
胃MFH应尽早手术切除, 并辅以放化疗[1]. 由于原发于胃的MFH病例数有限, 有关预后研究资料不足. 综合文献及我们报道的病例(表1)发现, 有随访的11个病例中8例在手术后1 wk-4年内死亡, 其中7例在手术后2年内死亡, 提示原发于胃的MFH预后不良. 但也有2例随访2年以上良好生存.
目前认为胃原发性间叶源性肿瘤大多为胃肠道间质瘤(GIST), 而原发于胃的MFH极为少见. 最新版 WHO肿瘤分类对 MFH进行了重新定义, 将其与未分化多形性肉瘤视为同义词, 变为一种排除性诊断.
本文采用最新MF H定义报道了 2 例胃原发性MFH病例, 有助于规范胃肠道间叶源性肿瘤, 特别是MFH的诊断.
本文对胃恶性纤维组织细胞瘤临床病理特征进行了描述, 创新性较好, 科学性强, 有较高的临床指导意义.
电编: 张敏 编辑:张焕兰
| 1. | Bosmans B, de Graaf EJ, Torenbeek R, Tetteroo GW. Malignant fibrous histiocytoma of the sigmoid: a case report and review of the literature. Int J Colorectal Dis. 2006;. [PubMed] |
| 2. | Weiss SW, Enzinger FM. Malignant fibrous histiocytoma: an analysis of 200 cases. Cancer. 1978;41:2250-2266. [PubMed] |
| 5. | Shibuya H, Azumi N, Onda Y, Abe F. Multiple pri-mary malignant fibrous histiocytoma of the stomach and small intestine. Acta Pathol Jpn. 1985;35:157-164. [PubMed] |
| 6. | Wright JR Jr, Kyriakos M, DeSchryver-Kecskemeti K. Malignant fibrous histiocytoma of the stomach. A report and review of malignant fibrohistiocytic tumors of the alimentary tract. Arch Pathol Lab Med. 1988;112:251-258. [PubMed] |
| 7. | Wada Y, Matsushita T, Sarumaru S, Ryo J, Isobe H, Satoh B, Kanaya S, Katayama T, Ohtoshi M. Malignant fibrous histiocytoma of the stomach: report of two cases. Surg Today. 1998;28:296-300. [PubMed] |
| 8. | Wiersema AM, Wobbes T, Pruszczynski M, van der Sluis RF. Malignant fibrous histiocytoma of the stomach during pregnancy: a case report. Eur J Obstet Gynecol Reprod Biol. 1998;80:71-73. [PubMed] |
| 10. | Enjoji M, Hashimoto H, Tsuneyoshi M, Iwasaki H. Malignant fibrous histiocytoma. A clinicopathologic study of 130 cases. Acta Pathol Jpn. 1980;30:727-741. [PubMed] |
| 11. | Ozzello L, Stout AP, Murray MR. Cultural characteristics of malignant histiocytomas and fibrous xanthomas. Cancer. 1963;16:331-344. [PubMed] |
| 12. | Erlandson RA, Antonescu CR. The rise and fall of malignant fibrous histiocytoma. Ultrastruct Pathol. 2004;28:283-289. [PubMed] |
| 13. | Randall RL, Albritton KH, Ferney BJ, Layfield L. Malignant fibrous histiocytoma of soft tissue: an abandoned diagnosis. Am J Orthop. 2004;33:602-608. [PubMed] |
| 14. | Daugaard S. Current soft-tissue sarcoma classifi-cations. Eur J Cancer. 2004;40:543-548. [PubMed] |
| 15. | Lagace R, Aurias A. Does malignant fibrous histiocytoma exist? Ann Pathol. 2002;22:29-34. [PubMed] |
| 16. | Fletcher CDM, Unni KK, Mertens F. World Health Organization Classification of Tumors. Pathology and Genetics of Tumors of Soft Tissue and Bone. Lyon: IARC Press 2002; 109-126. |
| 17. | Yamamoto T, Akisue T, Marui T, Fujita I, Matsumoto K, Kawamoto T, Hitora T, Nakatani T, Nagira K, Kurosaka M. Immunohistochemical analysis of platelet-derived growth factor and its receptors in soft tissue malignant fibrous histiocytoma. Anticancer Res. 2003;23:4325-4328. [PubMed] |
| 18. | Yoo J, Lee HK, Kang CS, Park WS, Lee JY, Shim SI. p53 gene mutations and p53 protein expression in human soft tissue sarcomas. Arch Pathol Lab Med. 1997;121:395-399. [PubMed] |
| 19. | Jiao YF, Nakamura S, Sugai T, Habano W, Uesugi N, Oikawa M, Sato T. p53 gene mutation and MDM2 overexpression in a case of primary malignant fibrous histiocytoma of the jejunum. APMIS. 2002;110:165-171. [PubMed] |
| 20. | Reid AH, Tsai MM, Venzon DJ, Wright CF, Lack EE, O'Leary TJ. MDM2 amplification, P53 mutation, and accumulation of the P53 gene product in malignant fibrous histiocytoma. Diagn Mol Pathol. 1996;5:65-73. [PubMed] |