修回日期: 2006-12-01
接受日期: 2006-12-14
在线出版日期: 2007-02-18
目的: 观察Grp78靶向RNA干扰质粒载体对人类胃癌细胞株7901 Grp78基因表达的抑制作用.
方法: 设计1对Grp78基因发卡寡核苷酸, 并与psiSTRIKETM质粒载体连接, 构建受控于人RNA聚合酶Ⅲ启动子U6的真核表达载体, 将重组质粒导入人类胃癌细胞株7901内, 分别在转染前、转染后24, 48和72 h通过RT-PCR、免疫荧光技术检测Grp78 mRNA及蛋白水平的表达情况.
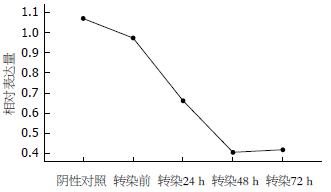
结果: 成功构建RNA干扰质粒载体, 靶向Grp78干扰质粒载体命名为psiSTRIKETM/Grp78. 将上述质粒转染到人类胃癌细胞株后, 观察到Grp78 mRNA及蛋白水平的表达明显下调, 随着时间的延长Grp78在实验组中的表达逐渐降低, 并随着时间推移稳定存在. 阴性对照组, 转染前组, 转染12, 48, 72 h组Grp78的mRNA相对表达量分别为1.069, 0.972, 0.662, 0.408, 0.420. 转染后组较转染前组及阴性对照组分别具有显著性差异(P<0.01), 转染前与阴性对照组无显著性差异(P>0.05). 转染前后组免疫荧光表达结果统计学差异明显(P<0.001), 其中转染后48 h同转染后24 h相比较Grp78蛋白表达明显减少(P<0.00714).
结论: 构建的RNA干扰真核表达载体psiSTRIKETM/Grp78能明显抑制Grp78 mRNA及蛋白的表达.
引文著录: 张新晨, 杨维良, 徐华锋, 吴德全, 杨宝峰. 小干扰RNA抑制胃癌细胞株葡萄糖调节蛋白Grp78的表达. 世界华人消化杂志 2007; 15(5): 447-452
Revised: December 1, 2006
Accepted: December 14, 2006
Published online: February 18, 2007
AIM: To construct the eukaryotic expression vector of RNA interference specific for glucose-regulated protein Grp78, and to observe silencing effect on Grp78 expression in human gastric cell line 7901.
METHODS: Gene sequences of human Grp78 were obtained from GenBank. A couple of Grp78 gene hairpin oligonucleotide was designed, whose sequence met the need of psiSTRIKETM U6 small interfering RNA (siRNA) expression vector. The designed oligonucleotide was inserted into plasmid psiSTRIKETM, which was an eukaryotic expression vector controlled by the U6 promoter of RNA polymerase Ⅲ, and then human gastric cell line 7901 was transfected with the recombinant plasmid by Lipofectamin2000. The expression of Grp78 was detected both at mRNA and protein level by reverse transcription-polymerase chain reaction (RT-PCR) immunofluorescent assay, respectively, before transfection, 24, 48, and 72 hours after transfection.
RESULTS: The recombinant plasmid of RNA interference specific for Grp78 was successfully constructed, named as psiSTRIKETM/Grp78. The expression of Grp78 was obviously down-regulated both at mRNA and protein level by psiSTRIKETM/Grp78 transfection. The analysis for the relative level of Grp78 mRNA showed a gradual and stable decrease with the prolonging of time. The expression of Grp78 mRNA was 1.069, 0.972, 0.662, 0.408, and 0.420, respectively, in the cells of negative control, before transfection, 24, 48, and 72 hours after transfection, and it was significantly lower in the cells after transfection than that before or without transfection (P < 0.01). There was no difference between the negative control group and pre-transfection group (P > 0.05). Immunofluorescent assay showed that the protein expression of Grp78 had been significantly decreased in the cells after transfection than that before transfection (P < 0.001), and it was also markedly different between 48 and 24 hours after transfection (P < 0.00714).
CONCLUSION: The siRNA eukaryotic expression vector psiSTRIKETM/Grp78 specific for Grp78 is constructed successfully, which can evidently inhibit the expression of Grp78 both at protein and mRNA level.
- Citation: Zhang XC, Yang WL, Xu HF, Wu DQ, Yang BF. Repressive effects of small interfering RNA on expression of glucose-regulated protein Grp78 in human gastric cell line. Shijie Huaren Xiaohua Zazhi 2007; 15(5): 447-452
- URL: https://www.wjgnet.com/1009-3079/full/v15/i5/447.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i5.447
葡萄糖调节蛋白(glucose regulative proteins, Grp)是一种内质网分子伴侣, 是细胞为了适应内质网应激状态所产生的一类应激蛋白, 与热休克蛋白(heat shock proteins, Hsps)有高度的同源性, 因而被认为是热休克蛋白的一种. Grp的生理功能主要是协助蛋白质的正确折叠和装配, 此外还具有其他多种生物学功能. 近期的研究认为, Grp类在某些肿瘤细胞中呈高表达趋势, 对于肿瘤细胞的抗药性、抗原表达有重要意义[1-2]. 在Grp种族中, Grp78是目前研究较多且重要成员, 在多种肿瘤细胞中都呈过表达趋势, 以此为靶点而开展的肿瘤基因治疗及免疫治疗已成为国内外研究的热点. 我们先前研究已经证明, Grp78在胃癌细胞中呈过表达趋势, 并揭示这种过表达与胃癌的发生、发展及预后有密切关系[3]. 抑制Grp的表达有可能对胃癌的生长及抗药性有重要影响. 本研究的目的就是在体外通过siRNA抑制胃癌细胞中Grp78蛋白的表达, 为下一步实验打下坚实基础.
人类胃癌细胞株7901(中国科学院上海细胞库), siSTRIKETMU6载体(Promega), 限制性内切酶PstⅠ(Promega), 质粒小量提取试剂盒(Promega), 凝胶回收试剂盒(上海华舜生物工程有限公司), LipofectamneTM 2000转染试剂(Invitrogen), 总RNA提取试剂盒(Invitrogen), Access RT-PCR A1250试剂盒(Promega), RPMI 1640培养基(Gibco), 山羊抗人Grp78抗体(Santa Cruz), FITC-兔抗山羊IgG(北京中山).
1.2.1 Grp78特异性siRNA的设计: 选择GenBank中人类Grp78基因编码区序列作为分析序列, 依据siRNA表达载体siSTRIKETMU6的要求, 采用Promega公司网站(http://www.promega.com)提供的siRNA Target Designer-Version 1.51设计软件设计出1对Grp78基因发卡寡核苷酸序列, 序列符合siRNA表达载体siSTRIKETMU6的要求: 经BLAST数据库分析, 与其他分子无同源序列; G+C含量接近50%; 不含TTT或GGG序列. 每对符合上述要求的60 nt的单链寡核苷酸, 每条单链寡核苷酸内都包含两段20 nt的寡核苷酸, 他们互为反转重复序列, 中间以CTTCCTGTCA间隔, 使寡核苷酸内部可形成发夹结构. 两对寡核苷酸的核心序列反向互补, 两端分别带有PstⅠ酶切位点, 3'末端有转录终止信号DNA序列片段TTTTT. DNA序列片段由上海生物工程公司合成. Grp78: 5'-ACCGCAAGAATTGAAATTGAGTTTCAAGAGAACTCAATTTCAATTCTTGCTTTTTC -3'; 5'-TGCAGAAAAAGCAAGAATTGAAATTGAGTTCTCTTGAAACTCAATTTCAATTCTTG -3'.
1.2.2 Grp78 siRNA表达载体的构建: 1 g/L人工合成单链核苷酸在退火缓冲液中, 90℃ 3 min后缓慢降到室温, 与5 μL快速连接缓冲液、1 μL psiSTRIKETM载体(50 mg/L)、2 μL Nuclease-Free水和1 μL T4 DNA连接酶(5.0×107 nkat/L)配制成连接反应液, 室温培养1 h. 加入到100 μL E.coli JM109感受态细胞中, 冰浴, 加入400 μL室温的LB培养液, 37℃振荡培养(50 r/min) 45 min. 200 μL转化液涂在在LB/氨苄西林平板上铺板, 37℃过夜培养. 挑取菌落, 小量提取质粒, 经PstⅠ酶切鉴定正确的重组质粒命名为psiSTRIKETM/Grp78, 于-20℃保存备用.
1.2.3 基因转染: 胃癌细胞接种于6孔板, 置于37℃、50 mL/L的二氧化碳培养箱中, 待细胞生长融合达90%时, 采用Invitrogen公司LipofectamneTM 2000转染试剂进行转染. 实验分为二组: 实验组: 每孔分别加入4 μL脂质体和psiSTRIKETM/Grp78重组质粒2 μg; 阴性对照组: 加2 μL LipofectamneTM 2000转染试剂; 分别于转染前、转染后24, 48, 72 h后收获细胞检测Grp78的表达水平.
1.2.4 RT-PCR检测目的基因的表达: 分别检验阴性对照组、转染后24, 48, 72 h时Grp78 mRNA的表达, 应用TRIzol试剂盒提取细胞总RNA, 采用Promega公司Access RT-PCR(A1250)系统进行一步法RT-PCR检测Grp78的mRNA表达. 以β-actin为内对照, RT-PCR扩增Grp78目的基因. 引物序列及预计扩增片段如表1所示. 50 μL反应体系为: 10×Buffer 5 μL, MgSO4(终浓度1 mmol/L) dNTP(终浓度0.35 mmol/L), 目的基因及b-actin各自上下游引物(终浓度0.3 μmol/L), AMV逆转录酶83.35 nkat/L, Tfl DNA聚合酶16.67 nkat/L, RNA模板4 μg. RT-PCR反应参数: 48℃孵育50 min, 94℃ 预变性2 min, 94℃变性30 s, 56℃退火40 s, 70℃延伸80 s, 35个循环, 最后70℃ 7 min. 每一RT-PCR反应均重复3次. 取2 μL RT-PCR产物, 加上样缓冲液1 μL, 15 g/L琼脂糖凝胶电泳, 凝胶呈像系统照相, 用Totallab2.01软件分析条带的积分吸光度, 计算Grp mRNA相对表达水平. Grp mRNA相对表达水平计算公式如下: Grp mRNA相对表达水平 = 样品Grp扫描值/样品β-actin扫描值.
| 目的基因 | 引物序列 | 片段大小 |
| Grp78 | 5' TGGGTCGACTCGAATTCCAAAG3' | 513 bp |
| 5' GTCAGGCGATTCTGGTCATTGG3' | ||
| β-actin | 5' GTTTGAGACCTTCAACACCCC3' | 320 bp |
| 5' GTGGCCATCTCTCTTGCTCGAAGTC3' |
1.2.5 间接法免疫荧光检测目的基因的表达: 分别将转染后24, 48, 72 h的细胞消化, 均以1×105细胞于24孔中爬片, 24 h后吸去上清, PBS冲洗标本3次, 40 g/L多聚甲醛室温固定30 min; PBS冲洗10次, 50 g/L BSA室温封闭30 min; 加入1: 200稀释的Grp78抗体, 覆盖已知抗原标本片, 将玻片置于湿盒内, 4℃过夜; PBS冲洗10次后滴加1:100稀释的FITC-兔抗山羊IgG抗体, 将玻片平放在湿盒内, 室温2 h后在荧光显微镜高倍视野下观察. 每一观察时间点选取3张图片, 每张图片在40倍视野下随机选择200个细胞, 计算其荧光细胞数和阳性率.
统计学处理 应用SPSS12.0软件分析, 结果以均数±标准差(mena±SD)表示, RT-PCR实验数据组内比较和组间比较用方差分析及t检验, 免疫荧光实验数据组内比较和组间比较采用χ2检验, 组内数据或组间数据两两比较采用χ2分割法. P<0.05为有统计学意义, χ2分割法时P<0.00714为有统计学意义.
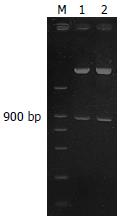
psiSTRIKETM载体包含一个PstⅠ位点, 重组质粒将会形成第2个PstⅠ位点, 经过限制性PstⅠ内切酶消化后, 成功的重组质粒将会产生2个DNA片段. 靶向Grp78 RNA重组质粒psiSTRIKETM用限制性PstⅠ内切酶酶切后, 可清楚地看到重组载体被切为两个片段, 证明重组质粒构建成功. 将由Grp78序列片段构建的靶Grp78 RNA干扰质粒载体命名为psiSTRIKETM/Grp78(图1).
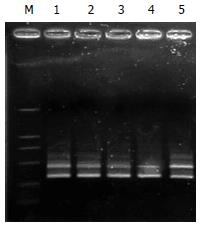
用RT-PCR方法分析Grp mRNA 相对表达水平显示, 发现随着时间的延长Grp78在实验组中的表达逐渐降低, 转染后12, 48, 72 h Grp78的mRNA相对表达量较转染前分别具有显著性差异, 转染前与阴性对照组无显著性差异(图2-3, 表2).
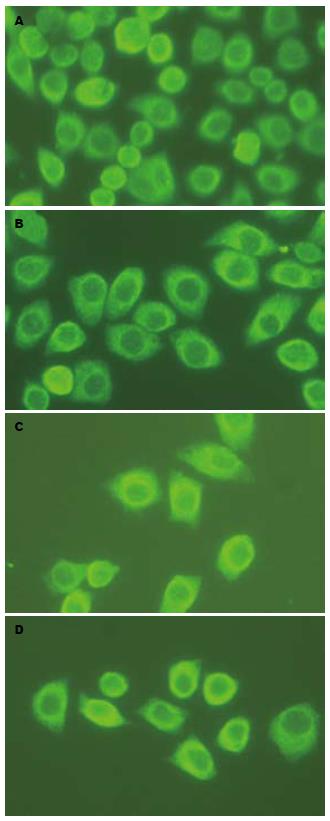
每一观察时间点选取3张图片, 每张图片40倍视野下随机选择200个细胞, 计算其荧光细胞数和阳性率. 由图4和表3可见psiSTRIKETM/Grp78组在转染前后免疫荧光表达结果统计学差异明显(P<0.001), 其中转染后24 h同转染前相比较Grp78蛋白表达明显减少(P<0.00714); 转染后48 h同转染后24 h相比较Grp78蛋白表达明显减少(P<0.00714); 而转染72 h后的荧光细胞数少于转染48 h后的荧光细胞数, 但二者没有统计学意义(P>0.00714).
胃癌是一种常见疾病, 严重威胁人民生命健康. 随着手术技术及综合治疗的不断完善, 胃癌患者的生存率有所提高, 但目前仍未根本解决肿瘤转移及复发的问题, 基因治疗或许是其治疗的希望所在[4]. 应激反应是机体的重要保护措施, 如果肿瘤一但形成, 应激反应就会变成肿瘤的保护机制. 这种保护机制对于肿瘤细胞的抗免疫原性、抗化疗药物性、抗凋亡性有重要作用, 也是目前肿瘤化疗、基因治疗、免疫治疗效果不佳的重要原因之一. 应激反应主要以两种形式存在, 其一为热休克蛋白(Hsp)介导的细胞质内的应激反应及Grp介导的细胞核内的内质网应激. 现在已经明确, Hsp族在胃癌中呈过表达并在肿瘤的发生、发展及多药耐药方面有重要作用, 在此方面研究中我国学者处于世界领先地位[5-6]. 另一种则为Grp介导的细胞核内的内质网应激.
Grp是一种内质网分子伴侣, 是细胞为了适应内质网应激状态所产生的一组应激蛋白, 主要包括Grp78, Grp94及Grp170等. 传统观点认为, Grps可在维持细胞稳态方面发挥多种功能. 作为内质网(ER)分子伴侣, Grps参与内质网蛋白的转运、蛋白质量控制及ER相关蛋白降解、ER应激调节及ER钙绑定等活动[7-9]. 其中, Grp78是研究及应用最多的Grp, 被认为在肿瘤增殖、抗药性等方面起重要作用[10]. 早有研究证实, Grp78在纤维肉瘤的增殖中有重要作用[11]; 应用大鼠模型可发现在肿瘤的生长过程中体内激活了Grp78的启动子[12]; 在正常组织转化为腺瘤或腺癌的过程中, 细胞质内Grp78也呈相应的过表达趋势[13]. 尚有研究证实乳腺癌标本的Grp78表达显著高于癌旁组织[14]; Grp78在结肠癌及肺癌等也存在着过表达[13,15]. 抑制Grp78的表达可以抑制肿瘤细胞增殖, 促进肿瘤细胞凋亡[16-17]. Grp78已被证实为肿瘤转移的重要因子, 有报道称在转移癌细胞系中Grp78蛋白水平增高[18-21], 并在抗药性形成方面发挥重要作用[22-24]. 作者课题组已首先证实Grp78及Grp94在胃癌中呈过表达[3,25], 并与胃癌的多种生物学特性有关, 国内外已有多名学者证实这个结果[26-28]. 因为在已有的文献中证实Grp78在内质网应激及肿瘤形成、抗药性形成过程中起主导作用, 作者设想通过RNA干扰方法抑制胃癌细胞中Grp78蛋白的表达.
在抑制方法方面, RNA干扰(RNAi)是一种在进化上保守的机制, 是用由dsRNA前体剪切产生的短的反义RNA靶向对应的mRNA然后进行剪切. RNAi可以高效、特异的阻断体内特定基因的表达, 促使mRNA降解, 诱使细胞表现出特定基因缺失的表型的过程, 是基因沉默的理想工具, 可以直接用于疾病相关基因的抑制, 从而达到疾病治疗或预防的目的[29-30].
本实验采用设计重组质粒表达载体持续表达siRNA的方法, 能较长时间内保持干扰作用. 将siRNA以折叠的茎环结构表达, 成功地克隆了靶向胃癌细胞Grp78的重组质粒, 并将其转染到人胃癌细胞株中, 来观察其对Grp78表达的抑制作用. 实验结果显示, 在转染24 h后, 人胃癌细胞株Grp78表达呈现明显抑制, 并随着时间的推移继续抑制, 在48 h时达到高峰, 到72 h时仍稳定存在. 本实验的结果证明, 体外通过siRNA抑制胃癌细胞中Grp78蛋白的表达是十分有效和稳定的, 可以为进一步的实验研究提供有效的工具, 为进一步应用抗化疗药物和其他药物进行对比实验打下坚实基础.
在检测手段方面, 本实验采用了RT-PCR及免疫荧光法从mRNA和蛋白两个水平检验Grp78的表达水平, 多方面证实了抑制的有效性. 免疫荧光检测方法简便、特异性高, 可以代替Western blot, 是检测蛋白有效的方法.
胃癌是威胁人类生命的严重疾病, 是消化道系统最常见的恶性疾病. 其发生、发展是涉及到多基因、多因素的复杂过程, 先前的研究认为内质网应激产物Grp 7 8在胃癌组织中呈高表达状态, 并且与其生物学特性有关. 因此, 抑制Grp78表达可能起到治疗作用, 本实验即是通过RNA干扰方法抑制胃癌细胞Grp78表达, 以期达到治疗效果.
Grp类在很多肿瘤细胞中都呈高 表达趋势, 对于肿瘤细胞的形成、抗药性、抗原表达都有重要意义, 在Grp种族中, Grp78是目前研究较多且重要成员, 以此为靶点而开展的肿瘤基因治疗及免疫治疗已成为国内外研究的热点.
本实验通过RNA干扰方法抑制胃癌细胞中Grp78表达并获得成功, 国内外尚无相关报道, 因此具有一定的创新性.
通过RNA干扰方法成功抑制胃癌细胞中Grp78的表达, 为进一步的实验打下坚实基础, 可进一步检验在胃癌中Grp78过表达对细胞生长、抗药性形成及肿瘤免疫的作用.
葡萄糖调节蛋白(Grps): 是一种内质网(ER)分子伴侣, 可参与内质网蛋白的转运、蛋白质量控制及E R相关蛋白降解、ER应激调节及ER钙绑定等活动. 近期的研究发现, Grps与肿瘤生长、肿瘤抗化疗药物性及肿瘤免疫尚有重要关联. 同时, Grps可以作为一种新的标志物指示肿瘤进展及化疗反应性, 也可以作为肿瘤治疗的靶点.
本文应用RNA干扰技术研究了葡萄糖调节蛋白(Grp)介导的细胞核内的内质网应激, 实验手段和技术路线较为先进,结果可靠, 有指导和参考价值.
电编: 张敏 编辑:张焕兰
| 2. | Lee AS. The glucose-regulated proteins: stress induction and clinical applications. Trends Biochem Sci. 2001;26:504-510. [PubMed] |
| 5. | Zhao ZG, Shen WL. Heat shock protein 70 antisense oligonucleotide inhibits cell growth and induces apoptosis in human gastric cancer cell line SGC-7901. World J Gastroenterol. 2005;11:73-78. [PubMed] |
| 6. | Liu X, Ye L, Wang J, Fan D. Expression of heat shock protein 90 beta in human gastric cancer tissue and SGC7901/VCR of MDR-type gastric cancer cell line. Chin Med J (Engl). 1999;112:1133-1137. [PubMed] |
| 7. | Hendershot LM. The ER function BiP is a master regulator of ER function. Mt Sinai J Med. 2004;71:289-297. [PubMed] |
| 8. | Lee AS. The ER chaperone and signaling regulator GRP78/BiP as a monitor of endoplasmic reticulum stress. Methods. 2005;35:373-381. [PubMed] |
| 9. | Yang Y, Li Z. Roles of heat shock protein gp96 in the ER quality control: redundant or unique function? Mol Cells. 2005;20:173-182. [PubMed] |
| 10. | Fu Y, Lee AS. Glucose regulated proteins in cancer progression, drug resistance and immunotherapy. Cancer Biol Ther. 2006;5:741-744. [PubMed] |
| 11. | Jamora C, Dennert G, Lee AS. Inhibition of tumor progression by suppression of stress protein GRP78/BiP induction in fibrosarcoma B/C10ME. Proc Natl Acad Sci USA. 1996;93:7690-7694. [PubMed] |
| 12. | Dong D, Dubeau L, Bading J, Nguyen K, Luna M, Yu H, Gazit-Bornstein G, Gordon EM, Gomer C, Hall FL. Spontaneous and controllable activation of suicide gene expression driven by the stress-inducible grp78 promoter resulting in eradication of sizable human tumors. Hum Gene Ther. 2004;15:553-561. [PubMed] |
| 13. | Xing X, Lai M, Wang Y, Xu E, Huang Q. Overexpression of glucose-regulated protein 78 in colon cancer. Clin Chim Acta. 2006;364:308-315. [PubMed] |
| 14. | Fernandez PM, Tabbara SO, Jacobs LK, Manning FC, Tsangaris TN, Schwartz AM, Kennedy KA, Patierno SR. Overexpression of the glucose-regulated stress gene GRP78 in malignant but not benign human breast lesions. Breast Cancer Res Treat. 2000;59:15-26. [PubMed] |
| 15. | Wang Q, He Z, Zhang J, Wang Y, Wang T, Tong S, Wang L, Wang S, Chen Y. Overexpression of endoplasmic reticulum molecular chaperone GRP94 and GRP78 in human lung cancer tissues and its significance. Cancer Detect Prev. 2005;29:544-551. [PubMed] |
| 16. | Ermakova SP, Kang BS, Choi BY, Choi HS, Schuster TF, Ma WY, Bode AM, Dong Z. (-)-Epigallocatechin gallate overcomes resistance to etoposide-induced cell death by targeting the molecular chaperone glucose-regulated protein 78. Cancer Res. 2006;66:9260-9269. [PubMed] |
| 17. | Gupta P, Walter MR, Su ZZ, Lebedeva IV, Emdad L, Randolph A, Valerie K, Sarkar D, Fisher PB. BiP/GRP78 Is an Intracellular Target for MDA-7/IL-24 Induction of Cancer-Specific Apoptosis. Cancer Res. 2006;66:8182-8191. [PubMed] |
| 18. | Mintz PJ, Kim J, Do KA, Wang X, Zinner RG, Cristofanilli M, Arap MA, Hong WK, Troncoso P, Logothetis CJ. Fingerprinting the circulating repertoire of antibodies from cancer patients. Nat Biotechnol. 2003;21:57-63. [PubMed] |
| 19. | Misra UK, Gonzalez-Gronow M, Gawdi G, Pizzo SV. The role of MTJ-1 in cell surface translocation of GRP78, a receptor for alpha 2-macroglobulin-dependent signaling. J Immunol. 2005;174:2092-2097. [PubMed] |
| 20. | Misra UK, Deedwania R, Pizzo SV. Binding of activated alpha2-macroglobulin to its cell surface receptor GRP78 in 1-LN prostate cancer cells regulates PAK-2-dependent activation of LIMK. J Biol Chem. 2005;280:26278-26286. [PubMed] |
| 21. | Jemal A, Thomas A, Murray T, Thun M. Cancer statistics, 2002. CA Cancer J Clin. 2002;52:23-47. [PubMed] |
| 22. | Tsutsumi S, Gotoh T, Tomisato W, Mima S, Hoshino T, Hwang HJ, Takenaka H, Tsuchiya T, Mori M, Mizushima T. Endoplasmic reticulum stress response is involved in nonsteroidal anti-inflammatory drug-induced apoptosis. Cell Death Differ. 2004;11:1009-1016. [PubMed] |
| 23. | Tsutsumi S, Namba T, Tanaka KI, Arai Y, Ishihara T, Aburaya M, Mima S, Hoshino T, Mizushima T. Celecoxib upregulates endoplasmic reticulum chaperones that inhibit celecoxib-induced apoptosis in human gastric cells. Oncogene. 2006;25:1018-1029. [PubMed] |
| 24. | Dong D, Ko B, Baumeister P, Swenson S, Costa F, Markland F, Stiles C, Patterson JB, Bates SE, Lee AS. Vascular targeting and antiangiogenesis agents induce drug resistance effector GRP78 within the tumor microenvironment. Cancer Res. 2005;65:5785-5791. [PubMed] |
| 28. | Wang XP, Liao J, Liu GZ, Wang XC, Shang HW. Co-expression of heat shock protein 70 and glucose-regulated protein 94 in human gastric carcinoma cell line BGC-823. World J Gastroenterol. 2005;11:3601-3604. [PubMed] |