修回日期: 2007-11-30
接受日期: 2007-12-22
在线出版日期: 2007-12-28
目的: 评价术后序贯放化疗对中晚期胃癌的生存影响和不良反应.
方法: 收集我院2003-01/2005-12胃癌根治术后行序贯放化疗患者36例及对照单纯化疗患者32例, 分析两组的1年和3年生存率, 同时评价放化疗期间出现的血液学, 肝肾功能及胃肠道等不良反应.
结果: 术后序贯放化疗组和单纯化疗组1年生存率分别为77%和61%, 3年生存率分别为47%和25%(P = 0.041), 中位生存时间分别为40.0 mo和24.5 mo(P = 0.038), 治疗期间两组出现Ⅲ-Ⅳ级白细胞减少分别为11.1%和6.3%, Ⅲ-Ⅳ级恶心呕吐分别为8.3%和3.1%, 但差异无统计学意义.
结论: 胃癌患者术后序贯放化疗较单纯化疗可提高1年和3年生存率, 延长中位生存时间, 不良反应可耐受.
引文著录: 袁响林, 付强, 胡国清, 陈元, 张莉红, 胡广原, 于世英. 中晚期胃癌术后序贯放化疗36例. 世界华人消化杂志 2007; 15(36): 3856-3859
Revised: November 30, 2007
Accepted: December 22, 2007
Published online: December 28, 2007
AIM: To investigate the effect of postoperative sequence chemoradiotherapy compared with postoperative chemotherapy alone on survival of patients with advanced gastric cancer, and to evaluate the toxic effect.
METHODS: A total of 68 patients were collected from our hospital from January 2003 to December 2005. Thirty-six patients received sequence chemoradiotherapy following radical resection, and 32 patients received chemotherapy alone following radical resection. The 1- and 3-yr survival rate were evaluated, as well as the hematologic and gastrointestinal toxic effects, and liver and kidney function.
RESULTS: The 1- and 3-yr survival rate of the sequence chemoradiotherapy group was 77% and 47%, respectively, as compared with 61% and 25% in the chemotherapy only group (P = 0.041).The median survival time was 40 mo compared with 24.5 mo in the control group (P = 0.038). Grade Ⅲ-Ⅳ leukopenia occurred in 11.1% of the sequence chemoradiotherapy group compared with 6.3% in the control group. Grade Ⅲ-Ⅳ nausea and vomiting occurred in 8.3% compared with 3.1% in the control group. No statistic significant correlation was found in toxic effect.
CONCLUSION: Postoperative sequence chemoradiotherapy of gastric cancer improves the 1- and 3-yr survival rate significantly, and prolongs the median survival time compared with postoperative chemotherapy alone. The toxic effects are tolerable.
- Citation: Yuan XL, Fu Q, Hu GQ, Chen Y, Zhang LH, Hu GY, Yu SY. Postoperative sequence chemoradiotherapy for advanced gastric cancer: an analysis of 36 cases. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3856-3859
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3856.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3856
胃癌是我国最常见的恶性肿瘤之一, 手术完全切除病灶是唯一可能根治肿瘤的方法, 然而, 仍有许多在行根治性手术且切缘阴性的胃癌患者还是出现肿瘤复发, 只能进行姑息性治疗, 这反映出大多数患者确诊时已属中晚期(Ⅲ-Ⅳ期), 单纯手术治疗效果差[1]. 同时研究表明中晚期胃癌术后复发率高, 局部复发率60%-70%, 5年生存率仅10%-20%[2]. 因此中晚期胃癌术后治疗方式的选择会对患者生存产生直接影响. 本文通过收集同济医院2003-01/2005-12根治术后胃癌患者68例, 采用前瞻性非随机对照方法, 分为术后序贯放化疗和单纯化疗两组, 来探讨术后序贯放化疗的价值.
入组条件(1)经手术后病理确诊的中晚期胃腺癌患者, (2)年龄18-75岁, 体能状况KPS大于70分, 本研究中术后序贯放化疗组年龄为36-75岁, 术后单纯化疗组年龄为29-74岁, (3)术后病理证实胃周淋巴结转移和/或肿瘤浸润至胃壁深肌层, 伴或不伴手术切缘阳性, (4)无重要器官功能严重损害, 血常规, 肝肾功能正常, (5)临床检查无远处转移病灶, (6)预期生存时间大于6 mo. 术后序贯放化疗组36例, 术后单纯化疗组(对照组)32例, 两组患者临床资料差异无统计学意义(P>0.05, 表1).
| n | 男/女 | 平均年龄(岁) | 病变部位 | 术后分期 | |||||
| 近 | 远 | II期 | Ⅲ期 | Ⅳ期 | 残留 | ||||
| 序贯放化疗 | 36 | 29/7 | 54.3(36-75) | 8 | 28 | 11 | 18 | 7 | 4 |
| 单纯化疗 | 32 | 26/6 | 53.6(29-74) | 4 | 28 | 7 | 19 | 6 | 2 |
序贯放化疗组治疗方案, 放疗安排在化疗2-3周期后进行. 术后化疗方案: OLF方案: 草酸铂130 mg/m2, iv drip 2 h d1; CF 200 mg iv drip d1-5; 5-FU 425 mg/m2 iv drip d1-5, 每3周重复, 共6个周期. 术后放疗方案: CT模拟定位下制定放疗计划, 15MV能X线, 常规外照射总量: 45 Gy/25次, 分次量1.8 Gy, 5 wk完成, 先行前后野照射剂量至DT 36 Gy/20次后避开脊髓, 行左右侧野照射至总量. 若有残端阳性患者, 局部小野追加至50.4 Gy/28次. 放疗照射范围包括瘤床, 手术残端或吻合口, 区域淋巴结(包括胃周、腹腔、主动脉旁、脾、肝十二指肠、肝门和胰十二指肠淋巴结. 胃食管结合部癌还需包括贲门和食管周围淋巴结, 但不包括胰十二指肠淋巴结). 放疗期间注意脊髓、心脏、肝脏、肾脏等器官保护. 按WHO标准进行毒性评定.
统计学处理 应用SPSS12.0进行统计分析, 百分比统计不良反应. 生存期为患者开始治疗至死亡或最后失访的时间. 总体生存比较用kaplan-Meier法分析并绘制生存曲线. 中位生存期用中位数计算.
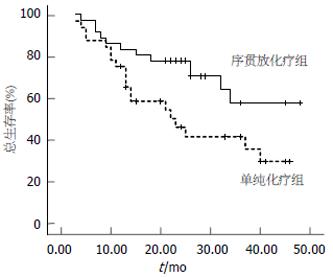
所有患者随访至2006-12, 随访时间14-48 mo, 中位随访时间27 mo, 其中失访4 例, 随访率95.5%. 术后序贯放化疗组和单纯化疗组1年、3年生存率和中位生存时间均有显著性差异(77% vs 47%; 61% vs 25%, P = 0.041; 40.0 mo vs 24.5 mo, P = 0.038; 表2, 图1).
| n | 生存率(%) | 中位生存时间(mo) | ||
| 1年 | 3年 | |||
| 序贯放化疗 | 36 | 77 | 61 | 40.0 |
| 单纯化疗 | 32 | 47 | 25 | 24.5 |
参照WHO不良反应的分级标准, 序贯放化疗组Ⅲ-Ⅳ级白细胞下降率和胃肠道反应发生率均高于单纯化疗组,但差异无统计学意义(11.1% vs 6.3%, 13.9% vs 6.2%, P>0.05)(表3). 其中放化疗组中有2例因不能耐受胃肠道反应, 未能完成规定放疗.
| 放化疗组 | 单纯化疗组 | |||
| III | IV | III | IV | |
| 白细胞减少 | 4(11.1) | 0(0) | 2(6.3) | 0(0) |
| 粒细胞减少 | 5(13.9) | 0(0) | 1(3.1) | 1(3.1) |
| 贫血 | 1(2.7) | 0(0) | 1(3.1) | 0(0) |
| 血小板减少 | 1(2.7) | 0(0) | 0(0) | 0(0) |
| 恶心呕吐 | 3(8.3) | 0(0) | 1(3.1) | 0(0) |
| 肝功能 | 0(0) | 0(0) | 0(0) | 0(0) |
| 肾功能 | 0(0) | 0(0) | 0(0) | 0(0) |
放化疗组死亡12例, 其中局部区域复发3例, 远处转移8例, 其他疾病1例. 单纯化疗组死亡19例, 其中局部区域复发11例, 远处转移8例.
分析我国近20年胃癌死亡情况, 90年代男性增长11.0%, 女性增长6.3%, 胃癌死亡占恶性肿瘤死亡的23.2%, 仍排列在第一位[3]. 胃癌根治术后失败的原因主要为局部复发和远处转移. 尤其当肿瘤穿透胃浆膜层和淋巴结转移将影响治疗效果[4]. 胃本身是放疗敏感器官, 但由于周围肝脏, 肾脏, 胰腺和肠道等放疗危及器官的存在, 限制了胃癌术后放疗的发展. 近年来随着CT模拟定位及数字重建技术在临床上的应用, 放射物理学及放射生物学的不断发展与成熟, 尤其是近几年来三维适形和调强放射治疗技术的广泛应用, 放射治疗对胃癌的价值有了新的评价. 为提高中晚期胃癌术后放射治疗的疗效, 许多学者在放射治疗的同时联合化疗, 取得了较好的疗效, 提高了治疗后的生存率. 本研究中放化疗组1年生存率和3年生存率均明显优于单纯化疗组, 且中位生存时间也明显提高(40.0 mo vs 24.5 mo), 差异具有统计学意义(P<0.05). SWOG9008 /INT0116试验针对胃癌术后的同步放化疗, 在降低局部复发和区域转移的基础上, 明显延长了总生存时间, 为胃癌的术后放化疗提供了理论基础. Klassen et al[5]报道, 对于手术未能切除或切除后有残留病灶的胃癌患者, 采用放化疗的中位生存期明显好于单纯5-FU化疗组, 达8.5 mo, 5年生存率亦高于单纯化疗组. INT0116组间研究结果也支持术后联合放化疗. 在该项研究中, 603例胃癌或胃食管腺癌的患者根治性手术后被随机分为放化疗组和观察组, 和观察组相比, 放化疗组无复发生存率提高了44%, 并且总生存率提高28%[6]. Kim et al[7]报道了韩国544例胃癌D2术后辅助放化疗患者, 对比单纯手术446例患者, 5年生存率及无复发生存时间均明显延长. 因此本组结果与上述研究结果一致. 同时, 东方和西方的研究者在近来的研究中均证实术后同步放化疗在生存率上均较单纯手术有优势[8-9]. 本研究报道1年生存率和3年生存率高于既往研究, 原因之一可能与使用新型化疗方案OLF方案有关, 胃癌的联合化疗以5-FU或顺铂(Cisplatin, DDP)作为基础己得到国际共识与公认, 第三代铂类药物草酸铂正越来越多的应用于胃癌的治疗. 草酸铂在体内与DNA结合的速率较顺铂快10倍以上, 结合牢固, 有更强的细胞毒作用. 同时, 毒副反应相对较轻, 胃肠道和肾脏毒性明显低于顺铂, 较易为晚期消化道肿瘤患者所接受. 大量Ⅱ期临床研究证实了新型药物如伊立替康、多西紫杉醇、卡培他滨、S1、草酸铂在中晚期胃癌中的作用[10], 其中草酸铂的Ⅲ期临床研究正在进行中. 国内学者进行的含草酸铂化疗方案治疗晚期胃癌均显示出较好的疗效及耐受性[11-13]. 其次, 近年来发现胃食管结合部的腺癌比例逐渐增高, 且早期易发生淋巴结转移和血道播散, 预后较差[14], 本组研究患者肿瘤多位于胃远端(胃窦), 仅小部分位于胃食管结合部(贲门), 故预后相对较好. 另一方面, 由于同步放化疗的毒性反应较大, 因此本研究设计为序贯放化疗, 并使用肾毒性小的化疗药物方案(草酸铂和5-FU). 本组研究中密切观察了治疗期间的血象变化和胃肠道反应. 术后放化疗组的毒性除白细胞减少, 中性粒细胞减少, 胃肠道反应较高外, 与单纯化疗组相似, 患者基本能耐受治疗, 也未出现治疗相关的死亡. 尽管部分肝脏和肾脏受到照射, 肝肾功能未见异常, 随访1年以上未见胃肠道, 肝脏和肾脏的远期并发症出现. 但是应该指出的是序贯放疗应使用CT模拟定位及治疗计划系统, 通过计划系统严格限制照射区危及器官(脊髓, 肾脏, 肝脏等)的剂量, 这样才能保证治疗的安全. Pemberton et al[15]研究中也强调了治疗计划系统在胃癌放疗中的重要性. 虽然通过多野照射可降低左肾的照射剂量, 但同时增加了肝脏的照射剂量[16], 因此, 常规两野照射仍然是主要的放疗方式.
由于本研究中观察病例数相对较少, 随访时间仍不够长, 肾脏等器官的远期毒性反应并未观察到, 最近Jansen et al[17]研究报道, 胃癌放疗18 mo后左肾功能下降, 且与左肾受照射体积相关. 因此对研究组患者应进一步随访观察肾脏、肝脏等器官功能变化.
总之, 对于中晚期胃癌, 手术后局部区域的放疗与全身化疗做到有机的结合, 进行互补性治疗可以提高总生存率, 延长生存时间. 术后放疗和含草酸铂, 氟脲嘧啶的化疗序贯治疗耐受性尚可, 值得临床上进一步深入研究.
胃癌是我国最常见的恶性肿瘤之一, 其发病率和死亡率在全国大多数城市排在前列, 多数患者确诊时已属进展期(肿瘤侵犯超过黏膜下层), 单纯手术治疗效果差, 目前术后辅助放疗存在一定争议. 术后放化疗联合应用是否优于术后单纯化疗尚无定论.
本文将术后辅助治疗由同步放化疗调整为序贯放化疗, 以达到减少放化疗急性毒性反应的目的; 同时化疗方案选用草酸铂联合氟尿嘧啶来提高传统化疗方案氟尿嘧啶的治疗效果, 从而探讨胃癌术后辅助放疗的价值, 以及放化疗联合应用的意义, 为进展期胃癌术后规范治疗提供参考.
本研究显示中晚期胃癌术后序贯放化疗的1年、3年生存率优于术后单纯化疗, 在具备相应放疗条件的单位可进一步开展.
1 调强放射治疗: 调强放射治疗与以往放射治疗技术不同, 他通过调节各个方向照射野的野内射线的强度产生非均匀照射野, 达到肿瘤的高剂量三维适形分布和危及器官的低剂量分布, 从而提高肿瘤的照射剂量, 尽可能地减少危及器官和正常组织的受量, 最终提高肿瘤局部的控制率, 改善肿瘤患者的生存质量.
2 危及器官: 是指放疗计划设计时受累及的对放射线特别敏感的重要器官和组织. 在确定放疗计划区时要考虑这些器官可能受到的损伤. 例如本文中胃癌放疗的危及器官包括肝脏、肾脏、脊髓等.
本文选题尚可, 数据客观, 研究结论有一定的临床指导意义.
编辑: 程剑侠 电编: 李军亮
| 1. | Meyer HJ, Jähne J, Pichlmayr R. Strategies in the surgical treatment of gastric carcinoma. Ann Oncol. 1994;5 Suppl 3:33-36. [PubMed] [DOI] |
| 2. | Henning GT, Schild SE, Stafford SL, Donohue JH, Burch PA, Haddock MG, Trastek VF, Gunderson LL. Results of irradiation or chemoirradiation following resection of gastric adenocarcinoma. Int J Radiat Oncol Biol Phys. 2000;46:589-598. [PubMed] [DOI] |
| 3. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 4. | Maehara Y, Hasuda S, Koga T, Tokunaga E, Kakeji Y, Sugimachi K. Postoperative outcome and sites of recurrence in patients following curative resection of gastric cancer. Br J Surg. 2000;87:353-357. [PubMed] [DOI] |
| 5. | Klaassen DJ, MacIntyre JM, Catton GE, Engstrom PF, Moertel CG. Treatment of locally unresectable cancer of the stomach and pancreas: a randomized comparison of 5-fluorouracil alone with radiation plus concurrent and maintenance 5-fluorouracil--an Eastern Cooperative Oncology Group study. J Clin Oncol. 1985;3:373-378. [PubMed] |
| 6. | Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, Haller DG, Ajani JA, Gunderson LL, Jessup JM. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med. 2001;345:725-730. [PubMed] [DOI] |
| 7. | Kim S, Lim DH, Lee J, Kang WK, MacDonald JS, Park CH, Park SH, Lee SH, Kim K, Park JO. An observational study suggesting clinical benefit for adjuvant postoperative chemoradiation in a population of over 500 cases after gastric resection with D2 nodal dissection for adenocarcinoma of the stomach. Int J Radiat Oncol Biol Phys. 2005;63:1279-1285. [PubMed] [DOI] |
| 8. | Park SH, Kim DY, Heo JS, Lim DH, Park CK, Lee KW, Choi SH, Sohn TS, Kim S, Noh JH. Postoperative chemoradiotherapy for gastric cancer. Ann Oncol. 2003;14:1373-1377. [PubMed] [DOI] |
| 9. | Sakamoto J, Morita S, Kodera Y, Rahman M, Nakao A. Adjuvant chemotherapy for gastric cancer in Japan: global and Japanese perspectives. Cancer Chemother Pharmacol. 2004;54 Suppl 1:S25-S31. [PubMed] [DOI] |
| 10. | Ajani JA. Evolving chemotherapy for advanced gastric cancer. Oncologist. 2005;10 Suppl 3:49-58. [PubMed] [DOI] |
| 13. | 沈 琳, 金 懋林, 张 晓东, 李 洁, 刘 庆森, 胡 国清, 吴 晴, 付 强, 陆 震宇, 李 杰. 澳沙利铂联合表阿霉素5-FU/CF治疗晚期胃癌的临床探讨. 中国肿瘤临床. 2005;32:472-475. |
| 14. | Lagarde SM, ten Kate FJ, Reitsma JB, Busch OR, van Lanschot JJ. Prognostic factors in adenocarcinoma of the esophagus or gastroesophageal junction. J Clin Oncol. 2006;24:4347-4355. [PubMed] [DOI] |
| 15. | Pemberton L, Coote J, Perry L, Khoo VS, Saunders MP. Adjuvant chemoradiotherapy for gastric carcinoma: dosimetric implications of conventional gastric bed irradiation and toxicity. Clin Oncol (R Coll Radiol). 2006;18:663-668. [PubMed] [DOI] |
| 16. | Marcenaro M, Foppiano F, Durzu S, Barra S, Corvò R. Kidney-sparing radiotherapy by multiple-field three-dimensional technique in the postoperative management of patients with gastric cancer: comparison with standard two-field conformal technique. Tumori. 2006;92:34-40. [PubMed] |
| 17. | Jansen EP, Saunders MP, Boot H, Oppedijk V, Dubbelman R, Porritt B, Cats A, Stroom J, Valdés Olmos R, Bartelink H. Prospective study on late renal toxicity following postoperative chemoradiotherapy in gastric cancer. Int J Radiat Oncol Biol Phys. 2007;67:781-785. [PubMed] [DOI] |