修回日期: 2007-11-28
接受日期: 2007-12-22
在线出版日期: 2007-12-28
目的: 观察降脂益肝冲剂对非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)大鼠肝脏抵抗素mRNA表达的影响, 并探讨抵抗素在大鼠NASH发病机制中的作用.
方法: 24只♂Wistar大鼠随机分为3组: 正常组普通饲料喂养, 模型组和治疗组高脂饮食喂养. 治疗组在高脂饮食12 wk后给予降脂益肝冲剂, 同时模型组和正常组给予等量的生活饮用水灌胃, 17 wk末处死各组大鼠. 观察动物一般情况, 肝组织脂肪变性及炎症活动程度, 测定血清TNF-α、ALT、AST, 空腹血糖(FBG)、空腹胰岛素(FINS), 并计算胰岛素敏感指数(ISI); RT-PCR法检测肝组织抵抗素mRNA相对含量.
结果: 在正常肝脏组织探测到抵抗素mRNA的微量表达(0.42±0.08), 模型组其表达量显著升高(2.14±0.11, P<0.01), 与模型组相比治疗组则显著下降(0.90±0.06, P<0.01). 模型组抵抗素水平与血清TNF-α、ALT、AST水平、肝脏炎症活动度计分成显著正相关(r = 0.873, 0.772, 0.716, 0.892, P<0.05), 与ISI无相关. 治疗组上述各项指标均得到显著改善.
结论: 抵抗素与反映肝脏炎症程度及肝功能的指标密切相关, 可能在NASH的发病中起重要作用. 降脂益肝冲剂对NASH有很好的疗效, 抵抗素是其可能的作用靶点.
引文著录: 杨文慧, 赵和平, 段晓燕, 刘婷, 葛姝囡. 降脂益肝冲剂对NASH大鼠肝脏抵抗素mRNA表达的影响. 世界华人消化杂志 2007; 15(36): 3798-3802
Revised: November 28, 2007
Accepted: December 22, 2007
Published online: December 28, 2007
AIM: To explore the effects of resistin in the pathogenesis of a rat model of non-alcoholic steatohepatitis (NASH), and to observe the effect of Jiangzhi Yigan Chongji on resistin mRNA in the liver of that model, to explore its mechanism of action.
METHODS: 24 male Wistar rats were randomly divided into three groups (eight rats in each): normal group fed with standard diet, model group, and treated group fed with a high-fat diet. The treated group was given Jiangzhi Yigan Chongji (1 mL/100 g, its concentration is 0.8 g/mL, twice daily) by intragastric administration after 12 weeks. Meanwhile, the normal and model groups were separately given drinking water by the same means. After 17 weeks, they were killed. Resistin mRNA in the liver of the rat model of NASH induced by high-fat diet was detected with RT-PCR. Level of alanine aminotransferase (ALT) and asparate aminotransferase (AST) was detected by an automatic biochemistry analyzer; fasting blood glucose (FBG) was detected by glucose oxidase method; and tumor necrosis factor α (TNF-α) and fasting insulin (FINS) in serum were detected by radioimmunoassay. Degrees of steatosis and steatohepatitis were observed.
RESULTS: A positive correlation was found between mRNA expression of resistin and TNF-α, ALT and AST, and the degree of steatohepatitis (r = 0.873, 0.772, 0.716 and 0.892, P < 0.05) in the model group, but had no correlation with ISI. The relative level of resistin mRNA in the liver tissue of the model group (2.14 ± 0.11) was significantly higher than that in the normal group (0.42 ± 0.08), and that in the treated group (0.90 ± 0.06) was significantly lower than that in the model group (P < 0.01).
CONCLUSION: Resistin may play an important role in the damage of NASH. Jiangzhi Yigan Chongji can significantly decrease the expression of resistin mRNA in liver tissue of NASH rats, and resistin may be a pharmacological target.
- Citation: Yang WH, Zhao HP, Duan XY, Liu T, Ge SN. Effect of Jiangzhi Yigan Chongji on resistin mRNA in the liver of rats with non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3798-3802
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3798.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3798
抵抗素是一种富含半胱氨酸的分泌性蛋白, 因其可影响与胰岛素作用相关的葡萄糖代谢以及脂代谢, 具有对抗胰岛素的作用而被命名. 新近研究表明他还可作为促炎因子参与炎症的级联反应, 与NASH的发病关系密切. 为此, 本研究采用高脂胆固醇饮食建立非酒精性脂肪肝大鼠模型, 观察其肝组织中抵抗素mRNA的表达情况, 对抵抗素在NASH发病机制中的作用进行初步探讨; 同时观察降脂益肝冲剂对肝组织抵抗素mRNA表达的影响, 探讨其可能的分子治疗机制, 为其更广泛的临床应用提供实验依据.
实验动物及饲料配制: (1)选用体质量为160-210 g的清洁级♂Wistar大鼠24只. 由山西医科大学生制实验室提供. (2)普通饲料: 玉米面35.45%, 白面29.55%, 麸皮12.5%, 豆粉12%, 鱼粉8%, 酵母粉2% (g/100 g)等. 高脂饲料[1]: 由85%的普通饲料, 13%的猪油和2%的胆固醇组成. 胆固醇, 成都科龙化工试剂厂产品; 降脂益肝冲剂由丹参、泽泻、何首乌、茯苓、草决明、山楂等18味中药组成, 为无糖颗粒型制剂, 由山西医科大学第一医院生产并提供; 葡萄糖试剂盒购自中生北控生物科技股份有限公司, 胰岛素和TNF-α测定试剂盒购自北京科美东雅生物技术有限公司, 游离脂肪酸(FFA)测试盒购自南京建成生物工程公司, RT-PCR试剂盒购自立陶宛Fermentas公司; PCR引物由上海生物工程公司合成.
1.2.1 动物模型制备和药物剂量: 将24只大鼠随机分为3组, 每组8只. 正常对照组喂普通饲料, 模型组和治疗组喂高脂饲料. 实验动物自由饮水, 分笼(每笼4只)饲养于(20±2)℃的动物实验室内. 每天8:00 am-8:00 pm为采光时间, 8:00 am-9:00 am, 4:00 pm-5:00 pm为喂食和给药的时间. 实验第13周开始给予降脂益肝冲剂1 mL/100g, 以0.8 g/mL的浓度溶解ig, 每日2次, 共5 wk. 药物剂量按徐叔云 et al[2]主编"药制实验方法学"计算, 公式: dB = dA×RB/RA×(WA/ WB)1/3; [dA, dB分别为人, 大鼠的每公斤体质量剂量(mg/kg), RA, RB分别为人, 大鼠的体形系数(查表可得), WA, WB分别为人, 大鼠的体质量(kg)值]. 按成年人60 kg体质量的剂量(40 g/d)计算出大鼠的药物剂量, 每周根据体质量调整一次剂量. 同时模型组和正常组分别给予等量的生活饮用水ig, 每日2次.
1.2.2 标本采集和处制: 饲养满17 wk, 自由饮水, 禁食12 h后用100 g/L的水合氯醛0.35 mL/100 g体质量经腹腔内注射麻醉后开腹, 腹主动脉取血, 3000 r/min离心15 min分离血清; 迅速取出肝脏, 置于4℃生制盐水中反复漂洗, 然后用匀浆器制备匀浆, 1 g肝组织加入9 mL 8.6 g/L NaCl溶液, 经4000 r/min离心10 min后取上清液即为10%的大鼠肝匀浆; 另称取0.1 g肝左叶置于1.5 mL EP管, 均保存于-70℃冰箱待用. 取肝左叶, 于40 g/L的多聚甲醛中固定24-48 h, 自来水冲洗24 h, 逐级乙醇脱水, 二甲苯透明, 浸蜡, 石蜡包埋切片, 常规HE染色, 光镜下观察肝组织病制变化.
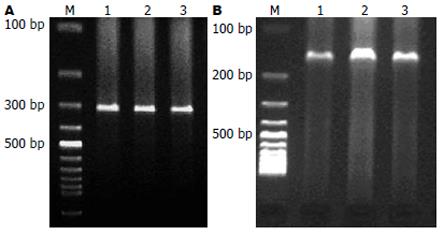
1.2.3 检测方法: 葡萄糖氧化酶法测定空腹血糖(FBG), 放免法测定血清空腹胰岛素(FINS)并计算胰岛素敏感指数(ISI = ln[1/(FINS×FBG)]); 放免法测定TNF-α水平; ALT、AST在全自动生化分析仪(Olympus Au1000)上测定. RT-PCR法检测肝脏抵抗素mRNA表达: (1)按TRIzol试剂盒说明书从大鼠肝脏中提取总RNA; (2)AMV反转录合成cDNA第一链; (3)PCR扩增: resistin上游引物: 5-CCAGAAGGCACAACCGTCACTA-3; 下游引物5-TCAACCGTCCTCAGGAACCAA-3; PCR反应条件: 94℃ 5 min, 94℃ 20 s, 56℃ 30 s, 72℃ 30 s, 37个循环后, 72℃继续延伸10 min, 产物为154 bp. GAPDH上游引物: 5-TCCCTCAAGATTGTCAGCAA-3, 下游引物5-AGATCCAGAACGGATACATT-3, PCR反应条件: 94℃ 5 min, 94℃ 20 s, 50℃ 30 s, 72℃ 30 s, 35个循环后, 72℃继续延伸10 min, 产物为308 bp; (4)PCR产物分析: PCR产物经15 g/L琼脂糖凝胶电泳, 溴化乙锭(0.5 mg/L)染色后于Tanon Gis 2010图像分析仪扫描分析. 目标基因mRNA的相对含量用目标基因与GAPDH吸光度值×面积的比值表示. (5)用多聚甲醛固定肝组织, 经石蜡包埋, 5 mm连续切片, 常规苏木精-伊红染色, 光镜下评估脂肪变性程度及计算炎症活动度计分. 肝细胞脂肪变性程度判断标准[3], 以肝小叶内未见脂滴肝细胞为阴性, 脂滴肝细胞占肝细胞总数小于1/3为+, 1/3-2/3为++, 大于2/3为+++, 几乎均呈脂滴肝细胞为++++. 炎症活动度计分[4]: 按汇管区炎症(P)、小叶内炎症(L)、碎屑坏死(PN)及桥接坏死(BN, 包括多小叶坏死)四项指标, 再依病变程度分别计为1、2、3、4分, 因BN、PN的严重度与病变活动度和预后直接相关, 故在计分时加倍, 计分公式为: P+L+2(PN+BN).
统计学处理 计量资料用mean±SD表示, 采用方差分析及LSD-t检验, 等级资料采用秩和检验, 参数间进行Pearson相关分析, 采用SPSS13.0软件处理, P<0.05被认为有显著性差异.
普通饮食大鼠行动活跃, 被毛整洁, 细密, 柔顺; 高脂饮食组大鼠行动迟缓, 但易激惹; 且模型组大鼠与治疗组相比, 被毛散乱, 粗糙, 缺乏光泽.
模型组血清TNF-α、ALT、AST较正常组显著升高(P值均<0.01). 与模型组相比, 治疗组TNF-α、ALT、AST显著下降(P值均<0.01)(表1).
模型组与正常组相比FBS、INS明显升高(P均<0.01), ISI明显下降(P<0.01), 用药组与模型组相比FBS、INS明显降低(P分别<0.05和<0.01), ISI明显升高(P<0.01)(表1).
正常组肝脏可探测抵抗素mRNA的微量表达(0.42±0.08), 模型组其相对表达量显著升高(2.14±0.11, P<0.01), 与模型组相比, 治疗组抵抗素mRNA的相对表达量显著降低(0.90±0.06, P<0.01), 但仍较正常组偏高(P<0.01)(图1, 表2).
2.5.1 大体形态观察: 正常组大鼠肝脏呈紫红色, 质地柔软, 被膜光滑, 边缘锐利, 切面光洁, 与周围无粘连; 模型组大鼠肝脏体积明显增大, 呈黄褐色, 被膜紧张, 边缘饱满, 质地稍韧, 与周围组织粘连, 不易分离, 切面有油腻感; 治疗组大鼠肝脏轻度肿大, 呈较浅淡的黄褐色, 被膜较光滑, 边缘较锐利, 切面较光洁, 质地较正常组略差.
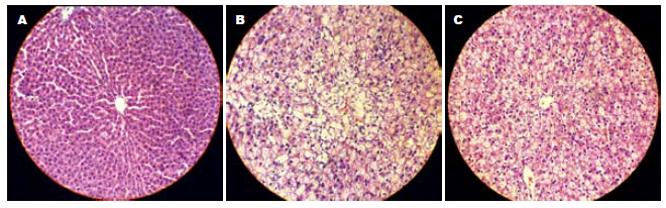
2.5.2 组织病理学改变: HE染色光镜下观察, 正常组肝小叶结构完整, 肝细胞呈多边形, 围绕中央静脉呈放射状, 肝窦清晰可见, 肝索排列整齐; 模型组大鼠肝组织弥漫性脂肪变, 小叶结构不清, 界限消失, 肝索排列紊乱, 小叶内和汇管区不同程度的炎症细胞浸润和坏死; 治疗组大鼠仍可见条索状排列的肝细胞, 脂变程度较模型组明显减轻, 且仅有轻微的炎性细胞浸润, 未见坏死灶. 模型组炎症活动度计分明显高于正常组(P<0.01), 治疗组炎症活动较模型组明显减轻(P<0.01, 图2).
在模型组中, 抵抗素mRNA相对表达量与血清TNF-α、ALT、AST水平、肝脏炎症活动度计分成显著正相关(r = 0.873, 0.772, 0.716, 0.892, P<0.01或P<0.05), 与ISI无相关性.
研究发现约20%的NASH可进展为肝硬化, 而后者发生原发性肝细胞癌、肝功能衰竭和移植肝复发的概率高达30%-40%[5]. 现在普遍认为肝纤维化和肝硬化只有在NASH的基础上才会发生, 无炎则无硬化. 可见探讨其发病机制寻求有效的临床用药, 对阻断NASH向终末期肝病发展具有重要意义.
抵抗素是Steppan et al[6]发现的一种脂肪细胞因子, 因其可诱导胰岛素抵抗而被命名. 但也有与之相反或无关的结论[7-8]. 新近研究表明抵抗素还可作为促炎因子参与炎症的级联反应. 一般认为, 抵抗素在啮齿类动物主要由白色脂肪组织表达, 人类主要由外周血单核细胞分泌. 而最近研究发现无论大鼠或人类在发生慢性肝损害时均可导致抵抗素在肝脏的显著表达[9-10]. 可见探讨抵抗素在肝脏疾病发生中的作用值得深入研究.
本实验用高脂加胆固醇饮食成功复制了实验性大鼠NASH模型, 此模型与人类NASH的发病经过相似, 故所研究的理论易于推广应用于人类. 结果发现: (1)模型组肝细胞普遍发生脂肪变性, 出现汇管区炎症, 炎症细胞以单核细胞为主, 炎症活动度计分明显增高; 血清ALT、AST、TNF-α显著升高. 证实长期高脂饮食为主的营养过度可引起肝脏脂肪浸润及脂肪性肝炎. (2)正常对照组肝脏即有抵抗素mRNA表达, 模型组其表达量显著增高, 提示抵抗素的高表达可能与NASH的发生密切相关. (3)进一步相关分析显示, 模型组抵抗素水平与血清TNF-α、ALT、AST水平、肝脏炎症活动度计分成显著正相关, 提示抵抗素在导致肝脏炎症变性及肝功能损害中发挥重要作用. (4)模型组抵抗素水平与ISI无相关性, 提示抵抗素在参与NASH发生过程中并非通过影响胰岛素敏感性途径发挥作用, 即其与胰岛素抵抗的直接关联在NASH的发病中并不发挥主要作用. 本研究结果与Bertolani et al[10]报道在人类正常对照组可见抵抗素在肝脏的表达, NASH组表达增强, 且表达量与NASH炎症活动度计分成显著正相关结果一致. 且该实验同时发现抵抗素可刺激肝星状细胞分泌MCP-1、IL-8等细胞因子导致肝脏炎症的发生. 亦支持本实验结论抵抗素可导致肝脏炎症变性及肝功能损害. Pagano et al[11]和Bahr et al[12]在对NAFLD及肝硬化患者的研究中发现血浆抵抗素水平与胰岛素抵抗无相关, 亦与本实验结论一致. 在随后的实验中我们期望可以定位抵抗素在NASH模型大鼠肝脏中的表达细胞, 并进一步探究其分子作用机制, 为NASH发生与防治提供新的理论依据.
降脂益肝冲剂主要由丹参、泽泻、山楂、何首乌、五味子、枸杞子、草决明、柴胡等18味中药组方, 本实验研究表明, 他对NASH具有良好的治疗效果, 可减少TNF-α的释放减轻肝脏的炎症反应, 降低血清ALT、AST促进肝功能恢复, 升高ISI改善胰岛素抵抗, 以及减轻肝细胞脂变与炎细胞浸润. 而其部分作用的发挥可能与下调肝脏抵抗素mRNA的表达有关, 但其机制不包括改善胰岛素抵抗作用. 这也提示我们以降低抵抗素表达为靶点来治疗胰岛素抵抗相关代谢性疾病仍有待商榷.
研究发现约20%的NASH可进展为肝硬化, 其中30%-40%死于肝相关疾病, 部分发生亚急性肝功能衰竭和肝细胞肝癌. 目前认为其与代谢综合征密切相关, 属于代谢综合征的肝脏表现. 但其发病机制尚不明确, 临床上仍缺乏有效的治疗手段.
已脂肪细胞因子在其发病机制中的作用日益受到关注, 瘦素、脂联素已发现在肝脏中表达, 抵抗素有望成为又一种可在肝脏探及并与NASH发病密切相关的脂肪细胞因子.
本实验中模型组抵抗素水平与血清TNF-α、ALT、AST水平、肝脏炎症活动度计分成显著正相关, 与胰岛素抵抗无相关.
本实验用高脂加胆固醇饮食复制的实验性大鼠NASH模型, 与人类NASH的发病经过相似, 故所研究理论易于推广应用于人类, 从而提供了有效治疗NASH的中成药物.
本文的材料和方法选择比较合适, 结果明确, 图片表格清晰, 条理清楚, 具有一定的科学性和可读性, 进一步充实了该领域的研究.
编辑: 程剑侠 电编: 何基才
| 1. | 戴 林, 邓 彬, 白 成, 于 洪波, 李 爱萍. 吡格列酮对大鼠非酒精性脂肪性肝炎的实验研究. 胃肠病学和肝病学杂志. 2004;13:482-484. |
| 3. | Diehl AM, Goodman Z, Ishak KG. Alcohollike liver disease in nonalcoholics. A clinical and histologic comparison with alcohol-induced liver injury. Gastroenterology. 1988;95:1056-1062. [PubMed] [DOI] |
| 5. | Nakashima T, Sumida Y, Furutani M, Hirohama A, Okita M, Mitsuyoshi H, Itoh Y, Okanoue T. Elevation of serum thioredoxin levels in patients with nonalcoholic steatohepatitis. Hepatol Res. 2005;33:135-137. [PubMed] [DOI] |
| 6. | Steppan CM, Bailey ST, Bhat S, Brown EJ, Banerjee RR, Wright CM, Patel HR, Ahima RS, Lazar MA. The hormone resistin links obesity to diabetes. Nature. 2001;409:307-312. [PubMed] [DOI] |
| 7. | Degawa-Yamauchi M, Bovenkerk JE, Juliar BE, Watson W, Kerr K, Jones R, Zhu Q, Considine RV. Serum resistin (FIZZ3) protein is increased in obese humans. J Clin Endocrinol Metab. 2003;88:5452-5455. [PubMed] [DOI] |
| 8. | Lee JH, Bullen JW, Stoyneva VL, Mantzoros CS. Circulating resistin in lean, obese, and insulin-resistant mouse models: lack of association with insulinemia and glycemia. Am J Physiol Endocrinol Metab. 2005;288:E625-E632. [PubMed] [DOI] |
| 10. | Bertolani C, Sancho-Bru P, Failli P, Bataller R, Aleffi S, DeFranco R, Mazzinghi B, Romagnani P, Milani S, Ginés P. Resistin as an intrahepatic cytokine: overexpression during chronic injury and induction of proinflammatory actions in hepatic stellate cells. Am J Pathol. 2006;169:2042-2053. [PubMed] [DOI] |
| 11. | Pagano C, Soardo G, Pilon C, Milocco C, Basan L, Milan G, Donnini D, Faggian D, Mussap M, Plebani M. Increased serum resistin in nonalcoholic fatty liver disease is related to liver disease severity and not to insulin resistance. J Clin Endocrinol Metab. 2006;91:1081-1086. [PubMed] [DOI] |
| 12. | Bahr MJ, Ockenga J, Böker KH, Manns MP, Tietge UJ. Elevated resistin levels in cirrhosis are associated with the proinflammatory state and altered hepatic glucose metabolism but not with insulin resistance. Am J Physiol Endocrinol Metab. 2006;291:E199-E206. [PubMed] [DOI] |