修回日期: 2007-11-28
接受日期: 2007-12-22
在线出版日期: 2007-12-28
目的: 探讨脂联素mRNA在原代肝星状细胞(hepatic stellate cell, HSC)活化过程中表达的变化趋势, 以及其对体外培养的原代HSC增殖状况和金属基质蛋白酶-13(MMP-13) mRNA与蛋白表达的影响.
方法: 改良的肝脏二步原位灌注法分离培养原代HSC; 以α-SMA为原代HSC活化的标志, Real-time PCR方法检测随HSC活化脂联素表达的动态变化; MTT方法检测脂联素对活化HSC增殖的影响, 以外源性脂联素处理原代HSC, 根据脂联素浓度, 分为对照组, 脂联素处理浓度62.5 mg/L, 125 mg/L, 250 mg/L, 500 mg/L五组, Real-time PCR方法检测MMP-13 mRNA表达; ELISA方法检测原代HSC分泌的MMP-13蛋白量.
结果: HSC存活率的下降与脂联素浓度呈线性相关(OR = 0.828). MMP-13 mRNA和蛋白表达水平与外源性加入脂联素浓度正相关, 当脂联素浓度增加至500 g/L时, MMP-13 mRNA表达增高至对照组的5.54倍, MMP-13含量增加至30.951 mg/L显著高于对照组的24.127 mg/L, 差异具有显著统计学意义.
结论: 脂联素具有抑制肝纤维化的作用, 其机制可能与抑制HSC增殖和增强MMP-13在HSC细胞的表达有关.
引文著录: 于丹, 马红. 脂联素随原代HSC活化表达的动态变化及其对原代HSC表达MMP-13的影响. 世界华人消化杂志 2007; 15(36): 3793-3797
Revised: November 28, 2007
Accepted: December 22, 2007
Published online: December 28, 2007
AIM: To study trends in the expression of adiponectin during hepatic stellate cell (HSC) activation and the effects of adiponectin on mRNA and protein expression of matrix metalloproteinase-13 (MMP-13), which was closely related to liver fibrosis in primary HSCs.
METHODS: We isolated primary HSCs through improved two-step liver in situ perfusion, and investigated changes in expression of adiponectin during activation of primary HSCs. MTT was used to study the effect of adiponectin on proliferation of activated HSCs. We chose proper concentration of adiponectin and then divided primary HSCs into five groups according to the concentration of adiponectin. Real-time PCR was used to detect the difference of a-smooth muscle actin, adiponectin and MMP-13 expression between the groups. Enzyme linked immunosorbent assay (ELISA) was used to detect the quantity of MMP-13 protein secreted into the medium.
RESULTS: The survival rate of HSCs showed a linear correlation with adiponectin concentration (OR = 0.828). Expression of adiponectin was down-regulated during HSC activation. Adiponectin was able to inhibit the proliferation of HSCs. When the concentration of adiponectin was 500 mg/L, MMP-13 mRNA expression, in contrast with that in the control group, increased by 5.54 times. MMP-13 protein expression in adiponectin-treated cells increased significantly in contrast with that in the control group (30.951 mg/L vs 24.127 mg/L).
CONCLUSION: Expression of adiponectin was decreased during HSC activation. As a member of the adipokines, adiponectin can exert its potential anti-fibrotic activity through inhibition of HSC proliferation and up-regulation of expression of MMP-13 in primary HSCs.
- Citation: Yu D, Ma H. Expression of adiponectin during hepatic stellate cell (HSC) activation and the effect of adiponectin on expression of matrix metalloproteinase-13 in primary HSCs. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3793-3797
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3793.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3793
脂联素是在脂肪组织中特异表达的脂肪因子. 静息态的HSC可以表达脂联素, 而活化的HSC不表达脂联素[1-2]. 有研究发现, 脂联素可以维持HSC的静息状态, 使已经活化的HSC重新逆转为静息状态; 还能够抑制血小板衍生生长因子(PDGF)诱导的HSC增生和转移, 减弱转化生长因子b1(TGFb1)的作用, 并可以减少TGFβ1与结缔组织生长因子(CTGF)的基因表达[3], 这些均提示脂联素可能对肝纤维化具有调节作用, 本实验通过检测脂联素随原代HSC活化表达的动态变化和外源性脂联素处理活化的HSC, 观察其对HSC增殖的影响以及对MMP-13基因和蛋白表达的影响, 观察脂联素对直接影响肝纤维化形成因子的作用.
成年洁净级♂Wistar大鼠, 体质量400-500 g, 购自首都医科大学动物室, 普通饲料喂养, 自由饮食; 蛋白酶E, Ⅳ型胶原酶购自Sigma公司, Nycodenz购自Sigma公司, DMEM培养基干粉和胎牛血清购自Gibco公司, 脂联素购自Cayman公司, TRIzol RNA提取试剂购自Invitrogen公司, M-MLV和Oligo(dT)反转录酶和RNase inhibitor购自Promega公司, SYBER GREEN MIX购自ABI公司, ELISA试剂盒购自ALD公司, 紫外凝胶成像仪(BIO RED), PCR仪(Eppendorf), 分光光度计(Amersham Biosciences), 荧光定量PCR仪(ABI, 7300).
1.2.1 改良的原位肝脏灌注法分离原代HSC: 体质量约500 g的成年♂Wistar大鼠, 无菌条件下, 门脉插管, 以D-HANK'S灌注冲洗, 同时将肝脏游离、悬挂. 灌入含0.5 g/L Ⅳ型胶原酶和10 g/L蛋白酶E的D-HANK'S液, 37℃水浴, 消化肝脏; 去除筋膜等结构, 并转入含0.5 g/L Ⅳ型胶原酶和0.1 g/L蛋白酶E的D-HANK'S液中, 37℃水浴, 振荡消化. 细胞悬液经过200钼细胞筛, 离心, DMEM冲洗2-3遍后, 180 g/L Nycodenz梯度离心. 取中间云雾状细胞层, 至DMEM中离心冲洗后培养于含200 mL/L FBS的DMEM培养基.
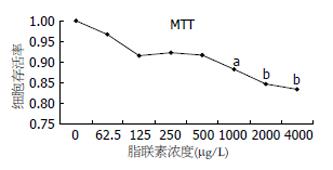
1.2.2 MTT: 取处于对数生长期的HSC-T6接种于96孔培养板中(细胞数为每孔5×103个), 每孔200 mL培养24 h后, 换无血清加入脂联素浓度大小分为62.5 mg/L, 125 mg/L, 250 mg/L, 500 mg/L, 1000 mg/L, 2000 mg/L, 4000 mg/L中, 每浓度设平行孔6个, 加入MTT, 孵育4 h后, 用DMSO溶解, 于酶标仪检测A值, 计算药物的体外生长细胞存活率.
1.2.3 Real-time PCR和ELISA方法: TRIzol法抽提RNA, 逆转录. 采用SYBR green染料法进行相对定量检测待检指标. 检测指标引物序列见表1. 溶解曲线检测二聚体保证试验结果可靠性. 每个样本6瓶重复, 整个实验重复三次. ELISA方法检测HSC细胞培养上清中MMP-13的含量.
| 检测指标 | 上游引物 | 下游引物 |
| GAPDH | ccatcactgccactcagaaga | atactatgggggtaggaacag |
| adiponectin | tggtcacaatgggataccg | cccttaggaccaagaacacct |
| α-SMA | ggtgaaactctgggagatcct | aatggcatctctgtgtcaacc |
| MMP-13 | ggacaagcagctccaaagg | ggtccagaccgagggagt |
统计学处理 应用SPSS11.5软件, 数据以mean±SD表示, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义, P<0.01为差异有显著统计学意义.
分离的原代HSC经荧光显微镜下, 327 nm紫光激发, 可见蓝绿色自发荧光, 确定细胞性质为HSC; 台盼蓝染色HSC细胞存活率大于90%(图1).
活化的HSC随脂联素浓度增高, 存活率明显下降. 当脂联素浓度增高至1000 mg/L时, HSC细胞存活率为对照组的88%(P<0.05), 并且HSC存活率的下降与脂联素浓度呈线性相关(OR = 0.828). 当脂联素浓度增加至2000 mg/L以上时, 细胞存活率降低为对照组的84%以下(P<0.01)(图2).
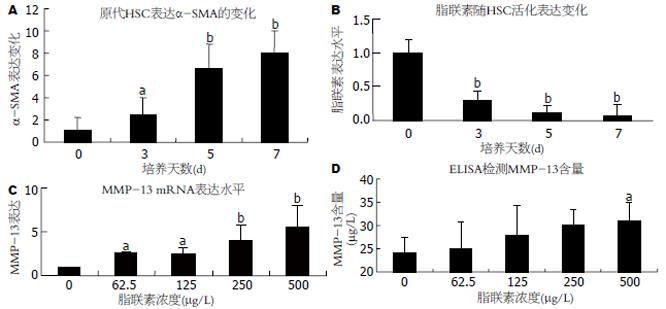
根据MTT结果, 选取细胞存活率大于90%的脂联素浓度, 作为外源性干预因素处理HSC. 以α-SMA为HSC活化的标志, 观察随着原代HSC活化, 脂联素mRNA表达的动态变化. 随原代HSC培养天数增加, α-SMA表达逐渐增高, HSC逐渐由静息态转变为活化状态(图3A). 脂联素的表达随α-SMA的升高进行性降低, 当培养3 d时, 脂联素的表达下降为对照组的30%(P<0.01), 并且随培养时间延长, 脂联素的表达继续下降, 当培养7 d, 即HSC完全活化后, 脂联素的表达仅为对照组的7%(P<0.01)(图3B). 以外源性脂联素处理原代HSC, 当脂联素浓度为62.5 mg/L时, MMP-13 mRNA表达即增长为对照组的2.11倍(P<0.05), 并且随着脂联素浓度增加, MMP-13的表达增高更加显著, 当脂联素浓度增加至500 mg/L时, MMP-13 mRNA表达增高至对照组的5.54倍(P<0.01), MMP-13表达增高的倍数与加入脂联素的浓度正相关(图3C). 细胞培养上清中MMP-13的蛋白含量与脂联素浓度呈正相关, 即MMP-13含量随脂联素浓度增大而增高. 当脂联素浓度增高至500 mg/L时, MMP-13含量显著高于对照组(30.951 mg/L vs 24.127 mg/L, P<0.05, 图3D).
肝纤维化是各种病因对肝脏慢性、重复性的损伤所引起的肝脏病理改变[4]. HSC的活化与转型在肝纤维化的发生中处于中心地位[5], 活化的HSC能够表达多种细胞因子及受体大量增殖, 大量合成ECM, 表达平滑肌a-肌动蛋白(a-smooth muscle atine, α-SMA), 并具有收缩功能[6-7]; 近年来研究表明, HSC还能生成少量基质金属蛋白酶及其抑制剂参与ECM的产生和降解[8-9], 基质金属蛋白酶(MMPs)与基质金属蛋白酶组织抑制剂(TIMPs)相互作用失衡, 最终导致ECM在肝内过度沉积的结果[10-12]. 因此促进HSC的凋亡, 一方面HSC数量的减少使ECM分泌减少, 另一方面使活化的HSC分泌的金属蛋白酶抑制剂减少, 促进ECM的降解[13-14]. MMP-13是大鼠肝脏中活化的HSC、成纤维细胞和Kupffer细胞分泌的最重要的酶, 是Ⅰ型, Ⅲ型胶原的主要降解酶[15]. 动物实验显示, 在肝纤维化形成过程中, MMP-13水平下降, 活性降低, 从而不能有效降解沉积的间质胶原, 导致ECM过度沉积而发生纤维化.
脂联素是脂肪组织中特异表达的脂肪因子. 过氧化物酶激活物增殖受体g(PPARg)能够调节脂联素基因的转录活性, PPAR的配体能够增加脂联素的mRNA表达和血清脂联素水平[16-17], 脂联素存在AdipoR1与AdipoR2两种受体[18], 脂联素通过与两种受体结合发挥增敏胰岛素[19-20], 抗动脉粥样硬化[21], 以及抗炎作用[22-24]; 脂联素还能够促进肝细胞内的脂肪酸氧化, 降低脂肪细胞中脂肪酸的产生, 防止肝细胞中甘油三酯聚集, 其中高分子量脂联素主要发挥增敏胰岛素和抗炎的作用[25-26].
肝脏中静息态的HSC也可表达脂联素, 但脂联素在活化的HSC中并不表达, 其具体变化过程未见报道. 本实验以α-SMA作为原代HSC活化的标志, 首次对HSC活化过程中脂联素表达的动态变化进行检测, 发现脂联素的表达水平随HSC的活化, 进行性减少. 目前对于脂联素和肝纤维化的关系, 报道还很少, 根据已有报道, 脂联素可以维持HSC的静息状态, 使已经活化的HSC重新逆转为静息状态; Kamada et al[3]发现脂联素能够通过抑制促肝纤维化形成因子的合成而抑制肝纤维化. 但是临床研究却得出不同的结论, Tietge et al[27]研究发现血清脂联素仅与肝功能下降和肝的血流动力学有关. Kaser et al[28]认为肝硬化时脂联素水平升高是慢性肝病时机体一种抗炎机制的反映.
为了明确脂联素对肝纤维化形成的直接作用, 我们以外源性脂联素处理HSC, 观察其对活化的HSC增殖的影响, 发现脂联素能够抑制活化HSC的增殖, 并且这种抑制作用与脂联素的浓度呈正相关, 这与Ding et al报道的脂联素促进活化的HSC凋亡的结论一致. 我们还检测了脂联素对肝脏中降解ECM重要的蛋白酶MMP-13的表达, 发现其能够上调HSC中MMP-13 mRNA表达, 并促进HSC合成MMP-13, 也提示脂联素潜在的抗肝纤维化作用.
本次实验仅选取MMP-13作为检测指标, 预测脂联素具有抑制肝纤维化的作用, 虽得出脂联素能够促进HSC中MMP-13的基因及蛋白表达, 但是并没有探讨脂联素与其他蛋白酶, 及其抑制因子以及胶原表达与沉积的相互作用和作用机制, 因此我们还需进一步研究以客观认识脂联素在肝纤维化及其他慢性肝病中发挥的作用.
脂联素是脂肪因子的一种, 他除了能够促进糖和脂肪代谢之外还具有抗炎, 增敏胰岛素和抗动脉粥样硬化等功能. 静息态的HSC表达脂联素mRNA, 脂联素对于维持HSC的静息状态具有重要作用, 大量体外试验及动物试验均发现脂联素通过抑制促纤维化形成因子合成, 而发挥抑制纤维化形成的作用; 而临床试验结果却得到不同的结果, 因此脂联素对肝纤维化的作用还需进一步研究证实.
近年来人们发现肝脏中与肝纤维化密切相关的HSC也能表达脂联素, 因此对于脂联素与肝纤维化的研究成为了研究的又一热点.
本文首次报道了脂联素mRNA随HSC活化表达变化进行性减少的过程, 还选取MMP-13作为检测指标, 预测脂联素具有抑制肝纤维化的作用, 得出脂联素能够促进HSC中MMP-13的基因及蛋白表达, 但是还需进一步研究脂联素对其他ECM降解酶的作用, 以全面阐述脂联素与肝纤维化的关系.
脂联素能够促进HSC中MMP-13的mRNA及蛋白表达, 提示脂联素可能具有潜在的抗纤维化作用, 进一步深入研究脂联素与肝纤维化的关系, 以及脂联素发挥抗纤维化作用的信号转导通路, 可能为治疗肝纤维化提供新的思路.
本文思路较好, 设计合理, 图片清晰, 有一定的可读性.
编辑: 程剑侠 电编: 何基才
| 1. | Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem. 1995;270:26746-26749. [PubMed] [DOI] |
| 2. | Ding X, Saxena NK, Lin S, Xu A, Srinivasan S, Anania FA. The roles of leptin and adiponectin: a novel paradigm in adipocytokine regulation of liver fibrosis and stellate cell biology. Am J Pathol. 2005;166:1655-1669. [PubMed] [DOI] |
| 3. | Kamada Y, Tamura S, Kiso S, Matsumoto H, Saji Y, Yoshida Y, Fukui K, Maeda N, Nishizawa H, Nagaretani H. Enhanced carbon tetrachloride-induced liver fibrosis in mice lacking adiponectin. Gastroenterology. 2003;125:1796-1807. [PubMed] [DOI] |
| 4. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] [DOI] |
| 6. | Brenner DA, Waterboer T, Choi SK, Lindquist JN, Stefanovic B, Burchardt E, Yamauchi M, Gillan A, Rippe RA. New aspects of hepatic fibrosis. J Hepatol. 2000;32:32-38. [PubMed] [DOI] |
| 7. | Lee KS, Lee SJ, Park HJ, Chung JP, Han KH, Chon CY, Lee SI, Moon YM. Oxidative stress effect on the activation of hepatic stellate cells. Yonsei Med J. 2001;42:1-8. [PubMed] [DOI] |
| 8. | Schlaf G, Schmitz M, Heine I, Demberg T, Schieferdecker HL, Götze O. Upregulation of fibronectin but not of entactin, collagen IV and smooth muscle actin by anaphylatoxin C5a in rat hepatic stellate cells. Histol Histopathol. 2004;19:1165-1174. [PubMed] |
| 9. | Galli A, Svegliati-Baroni G, Ceni E, Milani S, Ridolfi F, Salzano R, Tarocchi M, Grappone C, Pellegrini G, Benedetti A. Oxidative stress stimulates proliferation and invasiveness of hepatic stellate cells via a MMP2-mediated mechanism. Hepatology. 2005;41:1074-1084. [PubMed] [DOI] |
| 10. | Reeves HL, Friedman SL. Activation of hepatic stellate cells--a key issue in liver fibrosis. Front Biosci. 2002;7:d808-d826. [PubMed] [DOI] |
| 11. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] [DOI] |
| 13. | Iredale JP, Benyon RC, Pickering J, McCullen M, Northrop M, Pawley S, Hovell C, Arthur MJ. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors. J Clin Invest. 1998;102:538-549. [PubMed] [DOI] |
| 14. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] [DOI] |
| 15. | Arthur MJ. Fibrogenesis II. Metalloproteinases and their inhibitors in liver fibrosis. Am J Physiol Gastrointest Liver Physiol. 2000;279:G245-G249. [PubMed] |
| 16. | Iwaki M, Matsuda M, Maeda N, Funahashi T, Matsuzawa Y, Makishima M, Shimomura I. Induction of adiponectin, a fat-derived antidiabetic and antiatherogenic factor, by nuclear receptors. Diabetes. 2003;52:1655-1663. [PubMed] [DOI] |
| 17. | Díez JJ, Iglesias P. The role of the novel adipocyte-derived hormone adiponectin in human disease. Eur J Endocrinol. 2003;148:293-300. [PubMed] [DOI] |
| 18. | Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, Sugiyama T, Miyagishi M, Hara K, Tsunoda M. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature. 2003;423:762-769. [PubMed] [DOI] |
| 19. | Pereira RI, Draznin B. Inhibition of the phosphatidylinositol 3'-kinase signaling pathway leads to decreased insulin-stimulated adiponectin secretion from 3T3-L1 adipocytes. Metabolism. 2005;54:1636-1643. [PubMed] [DOI] |
| 20. | Berg AH, Combs TP, Du X, Brownlee M, Scherer PE. The adipocyte-secreted protein Acrp30 enhances hepatic insulin action. Nat Med. 2001;7:947-953. [PubMed] [DOI] |
| 21. | Trujillo ME, Scherer PE. Adiponectin--journey from an adipocyte secretory protein to biomarker of the metabolic syndrome. J Intern Med. 2005;257:167-175. [PubMed] [DOI] |
| 22. | Ouchi N, Kihara S, Arita Y, Okamoto Y, Maeda K, Kuriyama H, Hotta K, Nishida M, Takahashi M, Muraguchi M. Adiponectin, an adipocyte-derived plasma protein, inhibits endothelial NF-kappaB signaling through a cAMP-dependent pathway. Circulation. 2000;102:1296-1301. [PubMed] [DOI] |
| 23. | Lappas M, Permezel M, Rice GE. Leptin and adiponectin stimulate the release of proinflammatory cytokines and prostaglandins from human placenta and maternal adipose tissue via nuclear factor-kappaB, peroxisomal proliferator-activated receptor-gamma and extracellularly regulated kinase 1/2. Endocrinology. 2005;146:3334-3342. [PubMed] [DOI] |
| 24. | Wolf AM, Wolf D, Rumpold H, Enrich B, Tilg H. Adiponectin induces the anti-inflammatory cytokines IL-10 and IL-1RA in human leukocytes. Biochem Biophys Res Commun. 2004;323:630-635. [PubMed] [DOI] |
| 25. | Waki H, Yamauchi T, Kamon J, Ito Y, Uchida S, Kita S, Hara K, Hada Y, Vasseur F, Froguel P. Impaired multimerization of human adiponectin mutants associated with diabetes. Molecular structure and multimer formation of adiponectin. J Biol Chem. 2003;278:40352-40363. [PubMed] [DOI] |
| 26. | Tsao TS, Murrey HE, Hug C, Lee DH, Lodish HF. Oligomerization state-dependent activation of NF-kappa B signaling pathway by adipocyte complement-related protein of 30 kDa (Acrp30). J Biol Chem. 2002;277:29359-29362. [PubMed] [DOI] |
| 27. | Tietge UJ, Böker KH, Manns MP, Bahr MJ. Elevated circulating adiponectin levels in liver cirrhosis are associated with reduced liver function and altered hepatic hemodynamics. Am J Physiol Endocrinol Metab. 2004;287:E82-E89. [PubMed] |
| 28. | Kaser S, Moschen A, Kaser A, Ludwiczek O, Ebenbichler CF, Vogel W, Jaschke W, Patsch JR, Tilg H. Circulating adiponectin reflects severity of liver disease but not insulin sensitivity in liver cirrhosis. J Intern Med. 2005;258:274-280. [PubMed] [DOI] |