修回日期: 2007-11-28
接受日期: 2007-12-22
在线出版日期: 2007-12-28
目的: 观察体外循环状态下新生小型猪肝细胞的活性变化.
方法: 利用Cello培养循环式人工毛细管培养装置构建肝细胞循环系统, 以50 mL/min的流速循环乳猪肝细胞悬液, 分别观察循环8 h内肝细胞形态、活力和功能等的变化.
结果: 循环4 h后, 乳猪肝细胞的活力和贴壁率下降, 分别为76.1%±1.4%、62.8%±1.8%, 氨清除率是对照组的62.7%±14.6%, 继续观察发现, 随着循环时间的延长, 悬液中细胞碎片增多, LDH和AST显著升高(P<0.01), 细胞活力、贴壁率、白蛋白和尿素合成率、氨清除率等均显著下降(P<0.05).
结论: 乳猪肝细胞悬液循环模式可用于生物人工肝BAL系统.
引文著录: 张世昌, 王英杰, 陈志, 刘涛, 刘俊. 体外循环状态下新生小型猪肝细胞的活性. 世界华人消化杂志 2007; 15(36): 3787-3792
Revised: November 28, 2007
Accepted: December 22, 2007
Published online: December 28, 2007
AIM: To observe the viability of neonatal mini-porcine hepatocytes in extracorporeal circulation.
METHODS: A hepatocyte circulation system was constructed with Cello artificial capillary culture equipment and freshly isolated hepatocyte suspensions were circulated at 50 mL/min in vitro. The viability, function and morphological characteristics of hepatocytes were examined within 8 hours.
RESULTS: After 4 hours circulation, the viability and adherence ratio of hepatocytes were 76.1% ± 1.4% and 62.8% ± 1.8%, respectively, and the ratio of amino clearance was about 62.7% ± 14.6% of that in the control group. However, with time, many fragments of hepatocytes were observed in the circulating suspensions, as well as a significant increase in lactate dehydrogenase and aspartate aminotransferase (P < 0.01). The cell viability and adherence ratio, synthesis of urea and albumin, and the clearance rate of ammonia also decreased significantly (P < 0.05).
CONCLUSION: Porcine hepatocyte suspensions can be applied to BAL system in a circulation condition in order to strengthen the mass exchange. However, these cells need to be changed regularly to maintain cellular viability and the supporting effects of BAL.
- Citation: Zhang SC, Wang YJ, Chen Z, Liu T, Liu J. Preliminary study of the viability of neonatal mini-porcine hepatocytes in extracorporeal circulation. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3787-3792
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3787.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3787
保持生物反应器内大量肝细胞的高活性和充分的物质交换是生物人工肝(BAL)治疗肝功能衰竭的关键之一[1-3]. 目前研究较多并已应用于BAL临床研究的普通中空纤维型反应器[4-7], 通过微囊包裹、被覆生物基质等方法能够承担大量培养和维持肝细胞高活性的重任[7-13], 但同时增加营养物质弥散到肝细胞的阻力, 使肝细胞与肝功能衰竭患者血液之间物质交换受限. 有研究报道, 根据流体力学和生物流变学的原理, 肝细胞沿中空纤维管长轴流动, 可与相向流动的患者血浆进行充分的物质交换, 从而有效地提高物质交换效率[14]. 但肝细胞不像红细胞那样可以任意变形流动, 循环对肝细胞形态和功能的影响尚需进一步观察. 我们利用Cello培养循环式人工毛细管培养系统构建肝细胞循环培养系统, 检测循环状态下肝细胞的形态和功能的变化, 评价循环对肝细胞的影响.
中国实验小型猪4只, 新生1-7 d, 雌雄不限, 无病原体感染, 由第三军医大学实验动物中心提供. 实验前4 h断乳, 清洁皮毛后备用. Ⅳ型胶原酶和台盼蓝由Sigma公司提供; 培养瓶、培养板和离心管为Nuculon公司产品; 小牛血清(NCS)和RPMI1640培养液购于Hyclone公司; Cello培养循环式人工毛细管培养系统购于美国Spectrum公司; 猪白蛋白ELISA检测试剂盒购自美国Bythyl公司, 尿素和氨检测试剂盒购自英国Randox公司.
1.2.1 消化分离肝细胞: 戊巴比妥钠(30 mg/kg)麻醉新生中国实验小型猪. 常规方法皮肤消毒, 开腹, 暴露门静脉并注入肝素钠100-150 U. 游离肝脏, 于肝门处剪下取出, 先用前灌流液(含EDTA、无Ca2+、Mg2+的Hanks液)以80-100 mL/min的速度灌流10-15 min, 再用浓度0.5 g/L胶原酶液以50- 70 mL/min的速度灌流10 min. 两种灌流液均保持在37℃-38℃. 灌流结束后, 用剪刀划破肝包膜, 剔除大块纤维结缔组织, 收集细胞悬液, 酌情再置37℃消化10-15 min. 用RPMI-1640培养液终止消化, 3层纱布过滤, 50 g、3 min离心, 洗涤肝细胞3-4次, 获得肝细胞. 台盼蓝拒染实验判断细胞活率>90%者用于实验.
1.2.2 观察肝细胞形态、活力、贴壁率、LDH、AST和细胞功能: 将新分离的肝细胞制成浓度1×109 /L的肝细胞悬液, 并装入循环细胞池中, 置37℃、50 mL/L CO2、饱和湿度条件下, 50 mL/min循环8 h. 在0 h、2 h、4 h、6 h、8 h时相点, 取细胞悬液, 其中0 h为循环前为对照组. 将各组细胞悬液, 稀释1倍分别接种6孔培养板, 置37℃培养箱培养8 h后, 在倒置相差显微镜(Olympus Ⅸ-70)下观察肝细胞形态变化. 同时将细胞悬液制成透射电镜标本, 在Philip TECNAI-10型透射电镜下观察肝细胞超微结构的变化. 将各组细胞悬液用台盼蓝拒染实验检测肝细胞活力. 同时接种6孔培养板, 置37℃培养箱培养4 h, 吸弃细胞培养液, 用胰酶消化贴壁细胞制成单个细胞悬液, 用血球计数板分别计数接种细胞数和贴壁细胞数. 根据以下公式计算细胞贴壁率: 细胞贴壁率(%) = (贴壁细胞数/接种细胞数)×100%. 取2 mL细胞悬液, 离心取上清, 在日立-7020型全自动生化分析仪上检测各组肝细胞培养上清液中草酰乙酸氨基转移酶(AST)和乳酸脱氢酶(LDH)的水平. 循环肝细胞功能的检测: (1)用特异猪白蛋白抗体ELISA法和脲酶-波氏比色法分别检测收集上清中猪白蛋白和尿素含量. (2)用含5 mmol/L氯化铵无血清RPMI-1640培养液循环肝细胞悬液. 在循环的0 h、2 h、4 h、6 h、8 h后, 从循环系统中取出2 mL细胞悬液, 离心取上清, 用谷氨酸脱氢酶-紫外法检测上清中氨的浓度.
统计学处理 计量资料使用Excel2000和SPSS12.0统计学软件处理, 以mean±SD表示, 并进行均数t检验或μ检验, 以P<0.05为差异有显著性, P<0.01为差异有非常显著性.
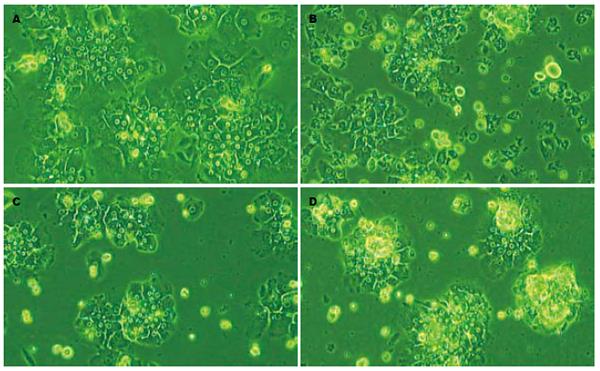
倒置相差显微镜观察, 循环2 h的肝细胞贴壁后的形态与对照组即未循环的肝细胞基本相同, 细胞碎片较对照组多, 可见少许漂浮细胞; 循环4 h的肝细胞有较多细胞贴壁, 但漂浮细胞开始增多, 细胞碎片变小; 循环6 h的肝细胞仍有较多细胞贴壁并呈集落状, 漂浮细胞明显增多, 细胞碎片小而多(图1A-D).
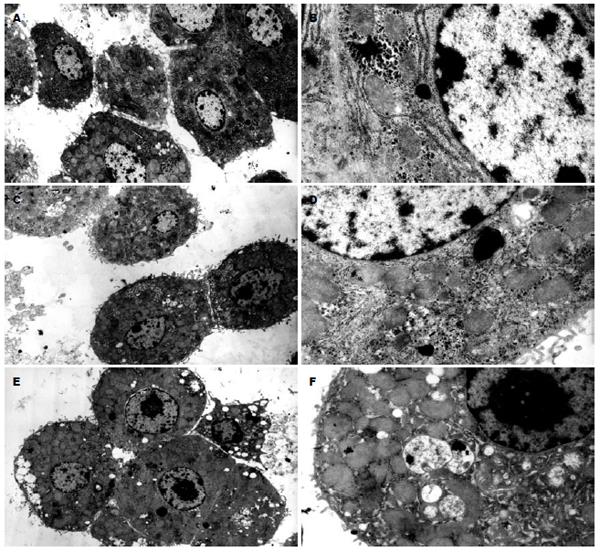
透射电镜观察, 对照组的肝细胞膜完整, 微绒毛丰富, 细胞内糖原颗粒丰富, 线粒体机构完整, 可见较多粗面内质网, 较少溶酶体(图2A-B); 循环4 h后细胞膜完整, 微绒毛丰富, 胞内糖原颗粒减少, 线粒体结构完整, 溶酶体增多, 部分细胞肿胀变性或开始蜕变(图2C-D); 循环8 h后正常细胞减少, 仍有较多完整的细胞, 胞膜基本完整, 微绒毛较少, 胞内普遍出现空泡且变大, 胞质中有溶解灶, 糖原颗粒少见, 见部分线粒体肿胀, 溶酶体增多, 出现蜕变坏死的肝细胞(图2E-F).
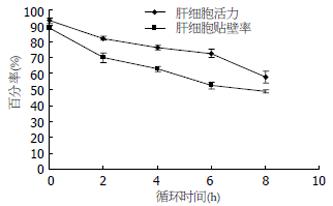
循环2 h、4 h、6 h、8 h的肝细胞活力和贴壁率与对照组肝细胞相比有显著降低(P<0.01), 并随着循环时间的延长而加剧, 8 h循环结束肝细胞的活力和贴壁率约50%左右(图3).
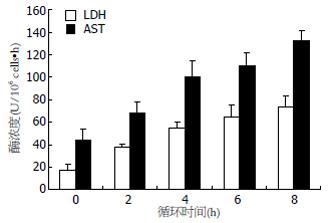
循环过程中肝细胞LDH和AST漏出量随着循环时间的延长而迅速升高, 循环2 h、4 h、6 h、8 h的肝细胞LDH和AST漏出量与循环前肝细胞相比有显著差异(P<0.01), 在8 h循环结束时肝细胞LDH和AST漏出量高达循环前的3倍以上(图4).
与对照组的肝细胞相比, 循环肝细胞白蛋白和尿素合成率显著降低(P<0.05), 循环时间越长下降的幅度越大, 循环4 h后肝细胞白蛋白和尿素合成率约为循环前的30%, 循环8 h结束后, 白蛋白和尿素合成率降至循环前的10%以下. 循环2 h后的肝细胞氨清除率与对照组无显著差异, 循环4 h、6 h、8 h后的肝细胞氨清除率较对照组显著降低, 其中循环4 h后肝细胞氨清除率可达循环前的60%, 在循环8 h结束时仅为对照组的10%(表1).
双向物质传输是BAL必须具备的重要特征, 也是治疗肝功能衰竭患者的必备条件[15]. 双向物质传输功能的欠缺, 将无法实现肝细胞对肝功能衰竭患者的人工肝支持治疗, 同样也不能对培养肝细胞进行营养补充以及保障其活性和功能. 目前, 已用于临床研究的BAL大多将肝细胞与肝功能衰竭患者血液通过半透膜加以阻隔[16-19], 以增加临床应用的安全性. 从免疫阻隔的角度考虑, 这无疑是最佳的方式, 但对双向物质传输而言, 则会增加液体弥散的阻力, 使一些重要物质的双向转运受到限制[20-22]. Shi et al[14]从流体力学及血液流变学的角度提出, 患者血液与生物反应器内肝细胞隔半透膜而流动最有利于双向物质传输. 但循环肝细胞悬液有可能使细胞受到较大的剪切力以及与管壁的机械摩擦及碰撞, 从而使细胞受损、功能下降.
正常肝脏有窦状间隙的内皮细胞和细胞外基质的保护, 肝细胞能够免受血液的剪切力作用, 而体外循环的肝细胞必须经受剪切力的作用. 剪切力对不同的细胞作用效果不同[23-24], 高剪切力可使中性粒细胞形成DNA碎片、细胞膜磷脂酰丝氨酸暴露、功能下降, 导致中性粒细胞凋亡[25], 而对内皮细胞抑制细胞凋亡并刺激细胞表面分子的表达[26]. 本研究表明循环4 h后肝细胞仍具有一定的活力和功能, 乳猪肝细胞悬液循环模式可用于BAL系统, 以加强肝功能衰竭患者血浆与肝细胞的物质交换. 继续观察发现, 随着循环时间的延长, 细胞碎片增多, LDH和AST显著升高, 细胞活力、贴壁率、白蛋白和尿素合成率、氨清除率显著下降, 表明长时间循环对肝细胞有较大的损伤, 需定期更换肝细胞悬液, 以保持细胞活性和BAL的肝支持效果. Tilles et al[27]的研究结果显示, 高剪切力作用下肝细胞功能迅速下降(这一点与本实验结果基本一致), 低剪切力作用下肝细胞功能维持稳定, 并显著高于高剪切力下肝细胞功能. 从中可以推测肝细胞损伤的主要原因可能是本研究中为了使肝细胞悬液能够循环, 使用了较高的循环速度, 产生较高的剪切力所致, 另一方面是循环的肝细胞与管壁的机械碰撞摩擦作用以及肝细胞通过脉冲泵受到的挤压作用, 共同造成肝细胞的机械损伤, 从而使有完整细胞功能的数量减少.
本研究发现, 循环8 h后存活的肝细胞大部分呈球形聚集, 提示在循环状态下, 肝细胞球形体有可能更有利于抵抗循环的损伤. 有研究报道认为, 在培养液流动产生低剪切力的条件下培养肝细胞, 可促使肝细胞聚集形成球形体, 并具有稳定的功能[28]. Kan et al[29]研究也证实, 剪切力可以通过激活非实质肝细胞诱导细胞连接和分泌细胞外基质, 促进肝细胞相互聚集形成三维结构, 有利于抵抗剪切力的作用. 根据Fiegel et al[30]的研究结果: 在流速为15 mL/min条件下, 可维持肝细胞数量的稳定并使肝细胞功能显著提高, 提示减慢循环速度可以减轻肝细胞数量和功能的丢失. 同时亦有研究显示适当持续的剪切力有利于保护肝组织的功能[31]. 因此, 也许通过采用球形体循环和进一步降低循环培养的速度, 减少细胞的损伤, 发挥高效地双向物质转运的优势, 有利于更好地维持循环培养肝细胞活性和BAL的肝支持效果.
肝功能衰竭是各种严重肝病的终末期表现, 在我国以十分常见的重型肝炎为其典型代表, 病情凶险, 预后极差, 病死率高达60%-80%. 原位肝移植或部分肝移植是治疗肝功能衰竭公认的最有效的治疗手段. 但由于健康供肝的短缺、昂贵的价格及需要终生应用免疫抑制剂等诸多原因, 大大地限制了原位肝移植在临床上的广泛应用. 因此, 多年来, 国外学者长期致力于生物人工肝(BAL)的研究, 以期为肝功能衰竭患者等待肝移植或通过自身肝再生恢复提供过渡的"桥梁".
肝细胞是BAL的核心原材料, BAL对肝功能衰竭患者的肝支持作用几乎完全依赖于所用肝细胞的生物学功能. 用于BAL的肝细胞要求以大量、高活性、高密度培养, 并且容易获得, 能有效的发挥肝支持作用. 目前, 生物人工肝治疗肝衰竭过程中的最大困难是人工肝支持治疗时间受限, 一般实施时间为6-8 h, 为了给肝衰竭患者提供更强有力的肝支持, 希望生物人工肝治疗时间愈长愈好. 因此, 研究提供高活性和可随时更换肝细胞的方法已成为生物人工肝研究的热点.
大多数研究表面单层培养肝细胞的功能随着培养时间延长逐渐下降, 特别是培养肝细胞的CYP活性和mRNA表达下降更为显著. 最近研究认为由于培养肝细胞为了恢复分离过程对肝细胞的损伤并适应新的微环境, 使编码细胞骨架和细胞外基质的基因表达上调, 而与之相应的编码代谢酶的基因表达下调, 导致培养肝细胞功能降低, 提示不贴壁的肝细胞悬液有可能具有更好的功能. Blanchard et al的研究认为肝细胞悬液在6 h内比单层培养的肝细胞具有更好地生物转化功能.
本文提示, 循环8 h的肝细胞仍具有较强的细胞功能, 说明将其应用于生物人工肝中发挥高效地双向物质转运的优势, 同时可以随时更换新的肝细胞悬液, 有利提高BAL的肝支持时间和支持效果.
生物人工肝(BAL): 将培养肝细胞置于体外循环装置(生物反应器)中, 当患者血液/血浆流过生物反应器, 通过半透膜或直接接触, 与培养肝细胞进行物质交换, 为肝功能衰竭患者提供肝脏支持功能.
本课题立题紧密结合临床, 有一定的创新性, 实验方法正确, 条理清楚, 结论可靠, 具有较强的学术价值.
编辑: 李军亮 电编: 郭海丽
| 1. | Chamuleau RA, Poyck PP, van de Kerkhove MP. Bioartificial liver: its pros and cons. Ther Apher Dial. 2006;10:168-174. [PubMed] [DOI] |
| 2. | Poyck PP, Hoekstra R, Chhatta A, Bloemendaal LT, van Wijk AC, Galavotti D, van Gulik TM, Chamuleau RA. Time-related analysis of metabolic liver functions, cellular morphology, and gene expression of hepatocytes cultured in the bioartificial liver of the Academic Medical Center in Amsterdam (AMC-BAL). Tissue Eng. 2007;13:1235-1246. [PubMed] [DOI] |
| 3. | Kanai H, Marushima H, Kimura N, Iwaki T, Saito M, Maehashi H, Shimizu K, Muto M, Masaki T, Ohkawa K. Extracorporeal bioartificial liver using the radial-flow bioreactor in treatment of fatal experimental hepatic encephalopathy. Artif Organs. 2007;31:148-151. [PubMed] [DOI] |
| 4. | Millis JM, Losanoff JE. Technology insight: liver support systems. Nat Clin Pract Gastroenterol Hepatol. 2005;2:398-405; quiz 434. [PubMed] [DOI] |
| 5. | Naruse K. Artificial liver support: future aspects. J Artif Organs. 2005;8:71-76. [PubMed] [DOI] |
| 6. | Pless G, Sauer IM. Bioartificial liver: current status. Transplant Proc. 2005;37:3893-3895. [PubMed] [DOI] |
| 7. | Sauer IM, Kardassis D, Zeillinger K, Pascher A, Gruenwald A, Pless G, Irgang M, Kraemer M, Puhl G, Frank J. Clinical extracorporeal hybrid liver support--phase I study with primary porcine liver cells. Xenotransplantation. 2003;10:460-469. [PubMed] [DOI] |
| 8. | Diekmann S, Glöckner P, Bader A. The influence of different cultivation conditions on the metabolic functionality of encapsulated primary hepatocytes. Int J Artif Organs. 2007;30:192-198. [PubMed] |
| 9. | Desille M, Mahler S, Seguin P, Mallédant Y, Frémond B, Sébille V, Bouix A, Desjardins JF, Joly A, Desbois J. Reduced encephalopathy in pigs with ischemia-induced acute hepatic failure treated with a bioartificial liver containing alginate-entrapped hepatocytes. Crit Care Med. 2002;30:658-663. [PubMed] [DOI] |
| 10. | Rahman TM, Selden C, Khalil M, Diakanov I, Hodgson HJ. Alginate-encapsulated human hepatoblastoma cells in an extracorporeal perfusion system improve some systemic parameters of liver failure in a xenogeneic model. Artif Organs. 2004;28:476-482. [PubMed] [DOI] |
| 11. | David B, Dufresne M, Nagel MD, Legallais C. In vitro assessment of encapsulated C3A hepatocytes functions in a fluidized bed bioreactor. Biotechnol Prog. 2004;20:1204-1212. [PubMed] [DOI] |
| 12. | Ambrosino G, Varotto S, Stefano Basso SM, Galavotri D, Cecchetto A, Carraro P, Naso A, De Silvestro G, Plebani M, Giron G. Development of a new bioartificial liver using a porcine autologous biomatrix as hepatocyte support. ASAIO J. 2002;48:592-597. [PubMed] [DOI] |
| 13. | Sun T, Chan ML, Quek CH, Yu H. Improving mechanical stability and density distribution of hepatocyte microcapsules by fibrin clot and gold nano-particles. J Biotechnol. 2004;111:169-177. [PubMed] [DOI] |
| 14. | Shi Q, Mitteregger R, Falkenhagen D, Yu YT. A novel configuration of bioartificial liver support system based on circulating microcarrier culture. Artif Cells Blood Substit Immobil Biotechnol. 2000;28:273-291. [PubMed] [DOI] |
| 15. | Adham M. Extracorporeal liver support: waiting for the deciding vote. ASAIO J. 2003;49:621-632. [PubMed] [DOI] |
| 16. | van de Kerkhove MP, Poyck PP, Deurholt T, Hoekstra R, Chamuleau RA, van Gulik TM. Liver support therapy: an overview of the AMC-bioartificial liver research. Dig Surg. 2005;22:254-264. [PubMed] [DOI] |
| 17. | Poyck PP, Pless G, Hoekstra R, Roth S, Van Wijk AC, Schwartländer R, Van Gulik TM, Sauer IM, Chamuleau RA. In vitro comparison of two bioartificial liver support systems: MELS CellModule and AMC-BAL. Int J Artif Organs. 2007;30:183-191. [PubMed] |
| 18. | Demetriou AA, Brown RS, Busuttil RW, Fair J, McGuire BM, Rosenthal P, Am Esch JS, Lerut J, Nyberg SL, Salizzoni M. Prospective, randomized, multicenter, controlled trial of a bioartificial liver in treating acute liver failure. Ann Surg. 2004;239:660-667; discussion 660-667. [PubMed] [DOI] |
| 19. | Monga SP, Hout MS, Baun MJ, Micsenyi A, Muller P, Tummalapalli L, Ranade AR, Luo JH, Strom SC, Gerlach JC. Mouse fetal liver cells in artificial capillary beds in three-dimensional four-compartment bioreactors. Am J Pathol. 2005;167:1279-1292. [PubMed] [DOI] |
| 20. | Hay PD, Veitch AR, Smith MD, Cousins RB, Gaylor JD. Oxygen transfer in a diffusion-limited hollow fiber bioartificial liver. Artif Organs. 2000;24:278-288. [PubMed] [DOI] |
| 21. | Samuel D, Ichai P, Feray C, Saliba F, Azoulay D, Arulnaden JL, Debat P, Gigou M, Adam R, Bismuth A. Neurological improvement during bioartificial liver sessions in patients with acute liver failure awaiting transplantation. Transplantation. 2002;73:257-264. [PubMed] [DOI] |
| 22. | Ho Ye S, Watanabe J, Takai M, Iwasaki Y, Ishihara K. High functional hollow fiber membrane modified with phospholipid polymers for a liver assist bioreactor. Biomaterials. 2006;27:1955-1962. [PubMed] [DOI] |
| 23. | Fernandez P, Bourget C, Bareille R, Daculsi R, Bordenave L. Gene response in endothelial cells cultured on engineered surfaces is regulated by shear stress. Tissue Eng. 2007;13:1607-1614. [PubMed] [DOI] |
| 24. | Nakatsuka H, Sokabe T, Yamamoto K, Sato Y, Hatakeyama K, Kamiya A, Ando J. Shear stress induces hepatocyte PAI-1 gene expression through cooperative Sp1/Ets-1 activation of transcription. Am J Physiol Gastrointest Liver Physiol. 2006;291:G26-G34. [PubMed] [DOI] |
| 25. | Green CE, Pearson DN, Camphausen RT, Staunton DE, Simon SI. Shear-dependent capping of L-selectin and P-selectin glycoprotein ligand 1 by E-selectin signals activation of high-avidity beta2-integrin on neutrophils. J Immunol. 2004;172:7780-7790. [PubMed] [DOI] |
| 26. | Gaucher C, Devaux C, Boura C, Lacolley P, Stoltz JF, Menu P. In vitro impact of physiological shear stress on endothelial cells gene expression profile. Clin Hemorheol Microcirc. 2007;37:99-107. [PubMed] |
| 27. | Tilles AW, Baskaran H, Roy P, Yarmush ML, Toner M. Effects of oxygenation and flow on the viability and function of rat hepatocytes cocultured in a microchannel flat-plate bioreactor. Biotechnol Bioeng. 2001;73:379-389. [PubMed] [DOI] |
| 28. | Török E JM, Ma PX, Vogel C, Dandri M, Petersen J, Burda MR, Kaufmann PM, Kluth D, Rogiers X. Hepatic tissue engineering on 3-dimensional biodegradable polymers within a pulsatile flow bioreactor. Dig Surg. 2001;18:196-203. [PubMed] [DOI] |
| 29. | Kan P, Miyoshi H, Yanagi K, Ohshima N. Effects of shear stress on metabolic function of the co-culture system of hepatocyte/nonparenchymal cells for a bioartificial liver. ASAIO J. 1998;44:M441-M444. [PubMed] [DOI] |
| 30. | Fiegel HC, Havers J, Kneser U, Smith MK, Moeller T, Kluth D, Mooney DJ, Rogiers X, Kaufmann PM. Influence of flow conditions and matrix coatings on growth and differentiation of three-dimensionally cultured rat hepatocytes. Tissue Eng. 2004;10:165-174. [PubMed] [DOI] |
| 31. | Torii T, Miyazawa M, Koyama I. Effect of continuous application of shear stress on liver tissue: continuous application of appropriate shear stress has advantage in protection of liver tissue. Transplant Proc. 2005;37:4575-4578. [PubMed] [DOI] |