修回日期: 2007-11-05
接受日期: 2007-11-11
在线出版日期: 2007-12-28
目的: 探讨多希紫杉醇温敏纳米胶束治疗人胃癌裸鼠移植瘤的疗效.
方法: 采用裸鼠BGC-823胃腺癌动物模型, 每组6只, 随机分配至设立的多希紫杉醇非热疗和热疗组, 多希紫杉醇温敏纳米胶束非热疗和热疗组以及生理盐水对照组等共8组, 采用尾静脉给药方式, 并恒温43℃对热疗组肿瘤部位进行热导向化疗, 动态观察并测定肿瘤的体积、瘤质量抑瘤率, 评价治疗效果, 并观察实验期间动物的全身情况及相对体质量变化, 评价毒副作用.
结果: 多希紫杉醇温敏纳米胶束热疗组人胃癌移植瘤表现出明显抑制, 体积和瘤质量抑瘤率分别为81.5%和85.4%, 显著高于多希紫杉醇温敏纳米胶束非靶向组(32.2%, 37.5%)和多希紫杉醇注射液组(49.2%, 58.0%)(P<0.05), 且多希紫杉醇温敏纳米胶束热疗组的小鼠体质量与其他各组比较相对平稳, 且饮食、活动正常, 对正常组织的毒副作用明显减轻.
结论: 温敏纳米胶束具有良好的高效低毒体内抗肿瘤作用, 作为一种新型的药物载体显示了良好的应用前景.
引文著录: 沈泽天, 杨觅, 禹立霞, 钱晓萍, 刘宝瑞. 多希紫杉醇温敏纳米胶束对人胃癌裸鼠移植瘤的靶向治疗作用. 世界华人消化杂志 2007; 15(36): 3782-3786
Revised: November 5, 2007
Accepted: November 11, 2007
Published online: December 28, 2007
AIM: To study the curative effects of docetaxel thermosensitive nano-micelles on human gastric cancer xenografts in nude mice.
METHODS: Human gastric cancer cell line BGC-823 was implanted into 48 nude mice. Different drugs were injected through the caudal vein in eight groups after establishment of the experimental model. Permanent temperature of the tumor was taken in the thermotherapy group. Tumor growth was monitored once every other day. Dynamic viewing and determining the rate of tumor regression in terms of tumor weight and volume were used to evaluate therapeutic efficacy. The side effect was evaluated through surveying all the condition and the relative variation in mouse body weight.
RESULTS: Tumor growth speed in the docetaxel thermosensitive nano-micelle thermotherapy group was significantly slower than that in the other groups. Tumor volume and weight regression in the docetaxel thermosensitive nano-micelle thermotherapy group were 81.5% and 85.4%, respectively, which were markedly higher than those of the docetaxel thermosensitive nano-micelle group (32.2% and 37.5%) and the docetaxel injection group (49.2% and 58.0%) (both P < 0.05). The drug side effects and toxicity of docetaxel thermosensitive nano-micelle thermotherapy were significantly less than those in the other groups.
CONCLUSION: Docetaxel thermosensitive nano-micelles show good inhibition of tumor growth, which indicates a favorable potential in clinical application.
- Citation: Shen ZT, Yang M, Yu LX, Qian XP, Liu BR. Targeting therapy with docetaxel thermosensitive nano-micelles of human gastric cancer xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2007; 15(36): 3782-3786
- URL: https://www.wjgnet.com/1009-3079/full/v15/i36/3782.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i36.3782
胃癌是最常见的恶性肿瘤之一, 尤其在我国的发病率和死亡率仍居首位[1]. 新近资料显示, 我国胃癌死亡率总体呈上升趋势[2]. 传统的手术治疗、放射治疗、化疗等疗效较差, 5年生存率很低. 化疗仍然是胃癌的标准治疗手段之一[3-5], 然而由于化疗药物对肿瘤细胞缺乏特异性且毒副作用大, 传统途径给药模式由于化疗药物用量大, 大多缺乏药理作用专一性, 对正常组织产生严重的不良反应. 因此, 提高药物抗肿瘤效果、减低毒副作用迫在眉睫, 实现这个目标的一个重要方法是将化疗药物与载体相结合[6-10], 以改变化疗药物在体内分布来提高肿瘤局部的药物浓度, 最大限度的降低非肿瘤部位的药物浓度, 从而减少化疗药物带来的毒副作用.
我们在研究工作中, 采用开环聚合及溶剂蒸发法制备了新型温敏纳米载体, 兼具热靶向和被动靶向性, 在体外显示出良好的肿瘤部位聚集效果[11]. 在前期体外实验的基础上, 本实验首次通过多希紫杉醇温敏纳米胶束对人胃癌裸鼠移植瘤抗瘤作用观察, 评价其作为热靶向治疗肿瘤的可行性, 为今后进一步深入研究提供实验依据.
动物: BALB/c nu/nu裸鼠(购自北京维通利华实验动物技术有限公司), SPF级, ♂, 6-7 wk龄, 18-20 g, 动物质量合格证号SCXX(2002-0003). 于南京大学医学院附属鼓楼医院实验动物中心无特殊病原菌(SPF)条件下饲养. 人低分化胃腺癌BGC-823细胞株为本室保存. 多希紫杉醇(北京协和药厂); 多希紫杉醇温敏纳米胶束(本实验室自行制备)[11]. RPMI-1640培养基系GIBCO公司产品, 按产品说明书配制, 过滤除菌备用; 胰蛋白酶系华文生物工程公司产品, 以1640培养液配制成2.5 g/L浓度备用; 新生小牛血清系兰州民海生物工程公司生产.
1.2.1 细胞培养: 将人胃癌BGC-823细胞培养于37℃, 50 mL/L CO2浓度的培养箱中, 采用含100 mL/L新生小牛血清的RPMI-1640培养液. 传代时用2.5 g/L的胰酶消化处理和PBS洗涤.
1.2.2 人胃癌裸鼠移植瘤模型的建立: 人胃癌BGC-823细胞生长至铺满培养瓶80%-90%时, 用2.5 g/L的胰酶消化后收集, 制成单细胞悬液, 悬浮于无血清的RPMI-1640培养液中, 显微镜下计数并调整细胞数至4-6×1010/L, 分别接种于裸鼠右后下肢皮下, 每只0.1 mL. 细胞种植14 d后, 选择肿瘤体积100 mm3左右的裸鼠为实验模型.
1.2.3 实验分组、给药方法: 移植性人胃癌裸鼠48只, 随机分为生理盐水对照组(A)和单纯热疗组(B)、空白温敏纳米胶束非热疗(C)和热疗组(D), 多希紫杉醇非热疗(E)和热疗组(F), 多希紫杉醇温敏纳米胶束非热疗(G)和热疗组(H)等8组, 每组6只, 隔天尾静脉注射给药. 各组多希紫杉醇剂量均按10 mg/kg体质量计算. 在肿瘤热疗的过程中将裸鼠固定, 暴露右后下肢肿瘤, 将肿瘤部位浸入水浴箱中43℃恒温热疗30 min.
1.2.4 肿瘤体积变化及抑瘤率: 第3, 5, 7, 9, 11 d用游标卡尺测量肿瘤长径a和垂直于a的最大横径b, 用电子天平称量裸鼠体质量. 第11 d拉脱颈椎处死裸鼠, 在超净工作台上解剖观察, 剥离瘤体称质量, 同时将肿瘤剥离拍照观察肿瘤体积变化差异. 按照以下公式: 瘤体积 = ab2/2, 体积抑瘤率(%) = [1-(实验组平均体积变化/对照组平均体积变化)]×100%, 瘤质量抑瘤率(%) = [1-(实验组平均瘤质量/对照组平均瘤质量)]×100%, 分别计算瘤体积、体积抑瘤率及瘤质量抑制率. 然后以每组动物移植瘤体积的平均值为纵坐标, 处理时间为横坐标, 绘制移植瘤生长曲线.
1.2.5 实验动物的全身状况和体质量变化: 每日观察各组动物的饮食、活动、皮色等方面的变化, 隔天测量裸鼠体质量, 观察体质量变化情况, 以每组动物体质量平均值为纵坐标, 处理时间为横坐标, 绘制体质量变化曲线.
统计学处理 通过SPSS11.5统计软件完成所有统计分析, 定量测定结果以mean±SD表示, 正态分布资料以F检验检测其方差齐性, 单因素方差分析(One-Way ANOVA)比较多个样本的均数, Dunnett-t检验检测多希紫杉醇温敏纳米胶束热疗组及生理盐水组与其他实验组均数的差异. P≤0.05为差异有统计学意义.
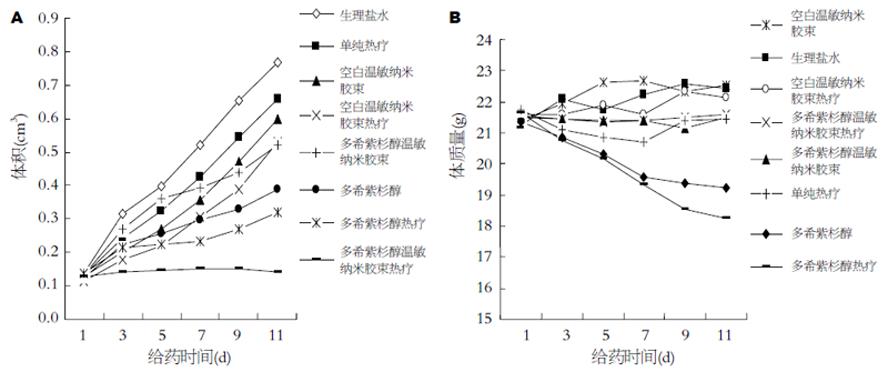
多希紫杉醇、多希紫杉醇热疗、多希紫杉醇温敏纳米胶束非热疗、多希紫杉醇温敏纳米胶束热疗组的体积抑瘤率分别为49.2%, 58.0%, 32.2%, 81.5%; 多希紫杉醇温敏纳米胶束热疗组的体积增长速度明显低于其他各组(P<0.05, 表1, 图1A).
| 分组 | 肿瘤体积(cm3) | 体积抑瘤率(%) | 1P | 2P | 肿瘤质量(g) | 质量抑制率(%) | 1P | 2P |
| A | 0.766±0.145 | 0 | - | 0.006 | 0.60±0.16 | 0 | - | 0.001 |
| B | 0.655±0.223 | 14.5 | 0.084 | 0.007 | 0.51±0.12 | 14.5 | 0.275 | 0.002 |
| C | 0.597±0.189 | 22.1 | 0.072 | 0.008 | 0.50±0.16 | 16.7 | 0.252 | 0.004 |
| D | 0.528±0.209 | 31.1 | 0.055 | 0.009 | 0.43±0.13 | 29.2 | 0.194 | 0.005 |
| E | 0.389±0.171 | 49.2 | 0.038 | 0.019 | 0.25±0.11 | 58.3 | 0.017 | 0.023 |
| F | 0.322±0.152 | 58.0 | 0.021 | 0.024 | 0.24±0.15 | 60.4 | 0.013 | 0.036 |
| G | 0.519±0.121 | 32.2 | 0.058 | 0.011 | 0.38±0.19 | 37.5 | 0.182 | 0.008 |
| H | 0.142±0.670 | 81.5 | 0.006 | - | 0.09±0.05 | 85.4 | 0.001 | - |
载药温敏纳米胶束热疗后瘤质量明显低于其他实验组(P<0.05), 抑瘤率最高, 与多希紫杉醇组相比, 多希紫杉醇温敏纳米胶束组热疗后瘤质量明显减轻(P<0.05), 抑瘤率显著增加, 而载药纳米胶束组未热疗时, 其瘤质量高于多希紫杉醇组(P<0.05) (表1).
在实验期间, 多希紫杉醇和多希紫杉醇热疗组的裸鼠后期反应迟钝, 饮食、活动都较差, 皮肤无光泽, 体质量下降较快. 各实验组由于药物毒性的差异显示相应变化, 多希紫杉醇和多希紫杉醇热疗组体质量出现下降, 而多希紫杉醇温敏纳米胶束热疗组的体质量与其他各组比较相对平稳, 且饮食、活动正常(图1B).
随着人们对肿瘤的认识逐步加强, 以及新型抗肿瘤药物的不断问世, 化疗在肿瘤治疗中的地位正逐步地提高, 成为许多肿瘤的主要治疗手段. 但系统化疗的主要问题在于: (1)存在全身的药物再分布; (2)药物缺乏对病变部位的特异亲和性; (3)用药达到很大剂量才能在靶部位产生一个较高的局部浓度; (4)因给药量大而对正常组织产生非特异性的毒副作用, 可造成肝肾损伤、骨髓抑制、胃肠道反应等多种毒副作用[12-13]. 药物靶向治疗可在一定程度上解决这些问题, 他使靶部位的药物浓度明显提高, 给药方式简化, 同时可减少用药量并使治疗费用降低, 减少药物对全身的毒副作用. 温敏药物载体属于靶向给药传递系统的一种新剂型, 被认为是较理想的载体. 普通的化疗药物进入体循环后主要分布在肝、脾和骨髓等网状内皮细胞较丰富的器官中, 往往被网状内皮系统(RES)的巨噬细胞吞噬, 造成对实性肿瘤疗效欠佳.
多希紫杉醇(docetaxel, DOC)是第二代紫杉烷类高效抗肿瘤药物, 目前临床上主要应用于转移性乳腺癌、非小细胞肺癌、卵巢癌、晚期胃癌等治疗[14-17]. 多希紫杉醇的主要不良反应有骨髓抑制、液体潴留、血管性水肿、过敏反应、神经毒性反应、消化道反应、皮肤毒性反应, 以及其他副反应[18-19]. 其中以骨髓抑制最为常见, 主要表现为白细胞及血小板的降低. 这样, 在杀伤肿瘤细胞的同时, 也产生全身严重的不良反应, 使临床应用受到限制. 已有文献证明, 骨髓抑制是剂量相关性的[20], 即抑制程度与多希紫杉醇的用量成正比.
本文通过首次自行合成的温敏纳米载体, 减轻了原药的过敏反应, 减少RES的吞噬、吸收, 延长药物在体内的循环时间. 将药物以温敏纳米材料为载体制成多希紫杉醇温敏纳米胶束, 在足够的体外热场引导下, 随血流运行, 选择性地到达并定位于肿瘤靶区. 药物以受控的方式从载体中释放, 然后在肿瘤组织的细胞或亚细胞水平上发挥药效作用. 将纳米载体和热靶向两者优点结合起来的温敏纳米载体属于第四代靶向给药系统. 温敏纳米载体作为化疗药物的载体应用于恶性肿瘤的治疗, 除具有一般载体的优点外, 还可以通过热疗作用使载体的靶向作用进一步提高.
以荷人胃癌裸鼠作为动物模型, 通过尾静脉注射多希紫杉醇温敏纳米载体, 肿瘤在恒温热疗的情况下, 该组肿瘤生长速度较其他各组明显减慢, 体积抑瘤率和瘤质量抑瘤率高达81.5%和85.4%, 而不热疗时温敏纳米胶束的体积和瘤质量抑瘤率显著降低, 说明加热能明显提高载药温敏纳米胶束的肿瘤抑制作用, 这是由于加热后药物在肿瘤组织中分布、释放及载体与肿瘤细胞作用均增加所致. 同时临床上常用的多希紫杉醇组的体积抑瘤率和瘤质量抑瘤率分别49.2%和58.3%, 热疗和不热疗时差异没有显著性, 而其和多希紫杉醇温敏纳米胶束相比, 差异有显著性(P值分别为0.0185, 0.0231), 多希紫杉醇温敏纳米胶束的抗肿瘤效果显著高于目前临床上常用的多希紫杉醇注射液. 在实验期间多希紫杉醇温敏纳米胶束热疗组体质量与其他各组相比较平稳, 且饮食、活动正常, 而多希紫杉醇和多希紫杉醇热疗组体质量下降比较明显, 可见经改变多希紫杉醇剂型, 其药物毒性明显降低, 并具有高效的肿瘤热靶向性. 其机制为在恒定热场作用下多希紫杉醇纳米胶束采用热触发机制靶向给予病灶部位, 而对非靶组织、器官、细胞影响很小, 从而提高疗效和减少药物的毒副作用.
肿瘤热靶向治疗, 可提高对肿瘤的杀伤效果、减少对正常组织的毒性, 具有很好的开发应用前景. 当然如果要让多希紫杉醇温敏纳米胶束早日应用于临床, 我们还将进一步优化制备工艺, 提高药物的载药量及负载效率, 并将进一步考察载药纳米胶束的毒性、生物相容性等方面的参数, 希望这一靶向制剂能够真正从实验室走向临床, 为肿瘤治疗提供一种新的途径.
总之, 多希紫杉醇温敏纳米胶束可抑制胃低分化腺癌细胞增殖活性, 同时降低药物的毒副作用; 在其体外抑制肿瘤细胞增殖的基础上[11], 本实验进一步证实了多希紫杉醇温敏纳米胶束的体内抗肿瘤作用, 为其应用于肿瘤治疗提供了更完善的理论依据. 目前热靶向治疗肿瘤, 国内外均处于起步阶段, 温敏纳米载体作为一种新型抗肿瘤药物载体显示了良好的应用前景.
化疗在肿瘤治疗中占有重要地位, 但由于化疗疗效较低, 毒副作用大, 如果降低给药剂量以减少毒副作用, 又会降低对肿瘤的治疗效果, 为了打破这一僵局, 研究者们一直在考虑尝试新的靶向给药途径.
在肿瘤药物靶向治疗领域, 形成了一个新的热靶向药物治疗研究分支, 温敏药物载体介导下的肿瘤热靶向化疗开始受到关注, 他将热疗与化疗相结合, 充分发挥两者的协同作用, 又能实现药物的靶向投递, 达到事半功倍的效果. 但选择什么样的材料, 采用什么样的工艺才能达到最佳效果, 是需要努力的方向.
经研究证实, 应用磁靶向过程是血管内血流对磁粒产生的力和磁铁产生磁力的竞争过程. 当磁力大于毛细血管(0.05 cm/s)的线性血流速率时, 磁性载体(<1 μm)被截留在靶部位, 并可能被靶组织的内皮细胞吞噬. 已经证明, 在载血流速率为0.55-0.1 cm/s的血管处, 在0.8T(8000GS)的外磁场下, 就足以使含有20%的磁性载体全部滞留. 因此, 磁靶向给药系统也是靶向给药系统的研究热点之一.
本文首次选用温敏纳米胶束为载体, 以热为触发机制实现化疗药物的肿瘤靶向投递, 并制备温敏多希紫杉醇纳米胶束, 证实了载药粒子具有高效低毒的特性, 显示了良好的热靶向性.
新构建了温敏载药纳米胶束, 可提高对肿瘤的杀伤效果、减少正常组织的毒性. 在后续的研究中如果能进一步优化制备工艺, 提高药物的载药量及负载效率, 并进一步考察载药粒子的毒性、生物相容性等方面的参数, 可使让这种新型的靶向制剂尽快走入临床.
多希紫杉醇温敏纳米胶束(载体): 药物以温敏纳米材料为载体制成多希紫杉醇温敏纳米胶束, 在足够的体外热场引导下, 随血流运行, 选择性地到达并定位于肿瘤靶区. 药物以受控的方式从载体中释放, 然后在肿瘤组织的细胞或亚细胞水平上发挥药效作用.
本文选题新颖, 设计合理, 结果可靠, 有利于其引申研究.
编辑: 程剑侠 电编: 马文华
| 1. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 乔 友林, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠. 中国1990-1992年胃癌死亡调查分析. 中华肿瘤杂志. 2002;24:4-8. |
| 2. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 3. | Alexiou C, Schmid RJ, Jurgons R, Kremer M, Wanner G, Bergemann C, Huenges E, Nawroth T, Arnold W, Parak FG. Targeting cancer cells: magnetic nanoparticles as drug carriers. Eur Biophys J. 2006;35:446-450. [PubMed] [DOI] |
| 6. | Abdollahi A, Hlatky L, Huber PE. Endostatin: the logic of antiangiogenic therapy. Drug Resist Updat. 2005;8:59-74. [PubMed] [DOI] |
| 7. | Tyagi P, Wu PC, Chancellor M, Yoshimura N, Huang L. Recent advances in intravesical drug/gene delivery. Mol Pharm. 2006;3:369-379. [PubMed] [DOI] |
| 8. | Ugwoke MI, Agu RU, Verbeke N, Kinget R. Nasal mucoadhesive drug delivery: background, applications, trends and future perspectives. Adv Drug Deliv Rev. 2005;57:1640-1665. [PubMed] [DOI] |
| 9. | Gavini E, Hegge AB, Rassu G, Sanna V, Testa C, Pirisino G, Karlsen J, Giunchedi P. Nasal administration of carbamazepine using chitosan microspheres: in vitro/in vivo studies. Int J Pharm. 2006;307:9-15. [PubMed] [DOI] |
| 10. | Vasir JK, Tambwekar K, Garg S. Bioadhesive microspheres as a controlled drug delivery system. Int J Pharm. 2003;255:13-32. [PubMed] [DOI] |
| 11. | Yang M, Ding Y, Zhang L, Qian X, Jiang X, Liu B. Novel thermosensitive polymeric micelles for docetaxel delivery. J Biomed Mater Res A. 2007;81:847-857. [PubMed] [DOI] |
| 12. | Airoldi M, Cattel L, Marchionatti S, Recalenda V, Pedani F, Tagini V, Bumma C, Beatrice F, Succo G, Maria Gabriele A. Docetaxel and vinorelbine in recurrent head and neck cancer: pharmacokinetic and clinical results. Am J Clin Oncol. 2003;26:378-381. [PubMed] [DOI] |
| 14. | Ajani JA. Chemotherapy for advanced gastric or gastroesophageal cancer: defining the contributions of docetaxel. Expert Opin Pharmacother. 2006;7:1627-1631. [PubMed] [DOI] |
| 15. | de Bree E, Theodoropoulos PA, Rosing H, Michalakis J, Romanos J, Beijnen JH, Tsiftsis DD. Treatment of ovarian cancer using intraperitoneal chemotherapy with taxanes: from laboratory bench to bedside. Cancer Treat Rev. 2006;32:471-482. [PubMed] [DOI] |
| 16. | Raez LE, Santos ES, Lopes G, Rosado MF, Negret LM, Rocha-Lima C, Tolba K, Farfan N, Hamilton-Nelson K, Silva O. Efficacy and safety of oxaliplatin and docetaxel in patients with locally advanced and metastatic non-small-cell lung cancer (NSCLC). Lung Cancer. 2006;53:347-353. [PubMed] [DOI] |
| 17. | Lopez M. [Metastatic breast cancer: new chemotherapy regimens with taxanes]. Clin Ter. 2005;156:311-315. [PubMed] |
| 18. | Lee JJ, Han JY, Lee DH, Kim HY, Chun JH, Lee HG, Yoon SM, Lee SY, Lee JS. A phase II trial of docetaxel plus capecitabine in patients with previously treated non-small cell lung cancer. Jpn J Clin Oncol. 2006;36:761-767. [PubMed] [DOI] |
| 19. | Guastalla JP, Diéras V. The taxanes: toxicity and quality of life considerations in advanced ovarian cancer. Br J Cancer. 2003;89 Suppl 3:S16-S22. [PubMed] [DOI] |
| 20. | Fossella FV. Overview of docetaxel (Taxotere) in the treatment of non-small cell lung cancer. Semin Oncol. 1999;26:4-8. [PubMed] |