修回日期: 2007-09-19
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 探讨不同肝移植术式术中凝血功能变化的规律及相关的影响因素.
方法: 将2006-06/2007-05我院15例亲体肝移植患者及29例原位肝移植患者, 分为肝癌组, 肝硬化和急性肝衰组. 综合评估患者术前状态, 于患者术前及术中(无肝前期、无肝期、再灌注期30 min、再灌注期1 h)检测凝血酶原时间(PT)、活化的部分凝血酶原时间(APTT)、国际标准化比值(INR)、纤维蛋白原(FIB)、血小板计数(PLT)、血红蛋白量(HB)、白蛋白(ALB)及CO2结合力(TCO2), 观察不同肝移植术式术中各组患者凝血功能及酸碱失衡的变化规律及特点, 分析术前和术中可能存在的影响因素及与凝血功能的相关性.
结果: 肝硬化患者组术前凝血状态介于肝癌组与急性肝衰组之间. 术前PLT明显减少, 与其他两组相比差异显著(P<0.05). 无肝期各项指标进一步恶化. 再灌注30 min PT, APTT, INR值达到峰值, FIB水平于无肝期达到最低点(亲体移植: 0.68±0.17 g/L vs 0.93±0.37 g/L, 0.77±0.19 g/L, 0.83±0.27 g/L, 0.72±0.31 g/L; 原位肝移植: 0.65±0.14 g/L vs 0.89±0.10 g/L, 0.71±0.26 g/L, 0.69±0.16 g/L, 0.70±0.23 g/L, P<0.05). 肝癌组各指标术前基本正常, 术中变化幅度均较前两组小(P<0.05). 急性肝衰组患者术前PT、APTT、INR延长最为显著, 凝血状态最差(P<0.05), 但术中恢复较快. 除无肝期外, FIB较其他两组明显减少(P<0.05). 应用Pearson相关分析术中出血量与围手术期因素的相关关系, 发现MELD评分与术中出血量具有相关性(r = 0.619, P<0.05). 与原位肝移植相比, 亲体肝移植术中凝血功能及代谢紊乱的变化较大, 尤以无肝前期及无肝期恶化明显. 再灌注后各项凝血指标恢复迅速(P<0.05).
结论: 应根据具体情况个性化治疗肝移植患者.
引文著录: 马焕先, 董家鸿, 段伟东, 陈永亮. 肝移植患者术中凝血功能的变化及影响因素. 世界华人消化杂志 2007; 15(35): 3728-3733
Revised: September 19, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To investigate intraoperative blood coagulation variation and correlative influential factors in liver transplantation.
METHODS: Twenty-nine cases undergoing orthotopic liver transplantation from cadaveric livers from 2006-06 to 2007-05 and 15 cases undergoing living-donor liver transplantation in the same period were studied retrospectively. We assessed prothrombin time (PT), activated partial thromboplastin time (APPT), international normalizing ratio (INR), fibrinogen (FIB), platelet (PLT), hemoglobin concentration(Hb),albumin (ALB) and total carbon dioxide (TCO2) during the pro-operation period, dissection period, anhepatic period, early and late neohepatic period, respectively. Changes of every value reflecting blood coagulation function and acid-base metabolism condition were observed in all groups, and fluctuation patterns of all values were studied between periods and groups. Perioperative influential factors were also analyzed. In addition, we compared values of living-donor liver transplantation with orthotopic liver transplantation from cadaveric livers in the same period and studied their correlations.
RESULTS: The average blood coagulation condition of CHC group was between the HCC group and FLF group. In the reperfusion 30 min reperfusion period, PT, APTT and INR were more abnormal than in any other period of the operation, while FIB level reached its lowest point in the anhepatic stage (Living-donor liver transplantation: 0.68 ± 0.17 g/L vs 0.93 ± 0.37 g/L, 0.77 ± 0.19 g/L, 0.83 ± 0.27 g/L, 0.72±0.31 g/L; Orthotopic liver transplantation: 0.65 ± 0.14 g/L vs 0.89 ± 0.10 g/L, 0.71 ± 0.26 g/L, 0.69 ± 0.16 g/L, 0.70 ± 0.23 g/L, P < 0.05). In the hepatocelluar carcinoma (HCC) group, their relative parameters were almost normal before LDLT and the change span during LDLT was less than those in the other two groups (P < 0.05). Patients in the FLF group were in the worst coagulation state with prolonged PT, APTT, INR and reduced FIB (P < 0.05). However, these patients recovered in the shortest time after reperfusion. The MELD score was negatively correlated with intraoperative blood loss and blood transfusion (r = 0.619, P < 0.05). Compared with liver transplantation from cadaveric liver, the change span of blood coagulation function and acid-base metabolism balance was wider than the frontier, especially in the coagulation function's aggravation aspect in the dissection and anhepatic periods. However, after reperfusion all parameters pertaining to blood coagulation function and acid-base metabolism balance recovered in a shorter time (P < 0.05).
CONCLUSION: Coagulopathy therapy should be individualized according to the perioperative condition of patients to aid the operation and reduce intraoperative blood loss.
- Citation: Ma HX, Dong JH, Duan WD, Chen YL. Change in blood coagulation and correlative influential factors in liver transplantation. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3728-3733
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3728.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3728
自肝脏移植作为治疗终末期肝病的有效治疗手段在全球得到公认后, 我国于上个世纪90年代迅速开展. 近1年来由于尸体肝源的匮乏, 亲体肝移植术逐渐取代尸体肝移植而成为主要治疗手段. 肝移植围手术期凝血功能的有效调控对确保手术顺利进行有至关重要的意义, 术中低凝状态导致患者术后并发症及死亡率升高, 而术后高凝状态致使肝动脉血栓形成使患者面临再次肝移植的风险[1]. 因此掌握其变化规律及影响因素则是解决这一难题的关键. 我们对本院2006-06/2007-05实施的15例亲体肝移植病例与同期实施的29例原位移植病例进行回顾性分析, 现阐述如下.
2006-06/2007-05实施的亲体肝移植病例15例, 男10例, 女5例, 年龄16-58(平均40.27)岁. 按原发病因不同分为3组: 慢性乙型肝炎肝硬化组4例, 原发性肝癌组6例, 急性肝功能衰竭组5例(药物性肝衰4例, 肝豆状核变性1例). 供肝均来自亲属部分肝脏. 供体无1例死亡, 受体1例因曲霉菌感染于术后11 d死亡. 同期实施的原位移植病例29例, 男26例, 女3例, 年龄27-59(平均45.18)岁. 按原发病因不同分为3组: 慢性乙型肝炎肝硬化组6例, 原发性肝癌组18例, 急性肝功能衰竭组4例, 1例肝门胆管癌除外. 供肝来自颅脑损伤致死者. 受体在住院期间无1例死亡.
按手术进程分别于术始、无肝前期、无肝期、再灌注30 min、再灌注1 h静脉采血, 检测凝血酶原时间(PT)、活化的部分凝血酶原时间(APTT)、国际标准化比值(INR)、纤维蛋白原(FIB)、血小板计数(PLT)、血红蛋白量(HB)、白蛋白(ALB)及CO2结合力(TCO2). 并根据检测结果针对性应用浓缩红细胞、新鲜冰冻血浆、机采血小板、凝血酶原复合物、纤维蛋白原、人血白蛋白等血液制品及药物, 以改善凝血功能. 统计患者术前的凝血、生化、血常规, model for end-stage liver disease(MELD)评分, 术中出血量、输血量及血液制品的用量.
统计学处理 所有检测数据以mean±SD表示. 采用Microsoft Excel软件进行统计描述, 同一指标组间的比较采用成组设计的两样本均数t检验, 而同一指标组内不同时期的比较采用配对设计的差值均数与总体均数比较的t检验, P<0.05差异有统计学意义. 应用Pearson相关分析术中出血量与围手术期因素的相关关系. 所有数据均应用SPSS12.0版本软件进行统计学分析.
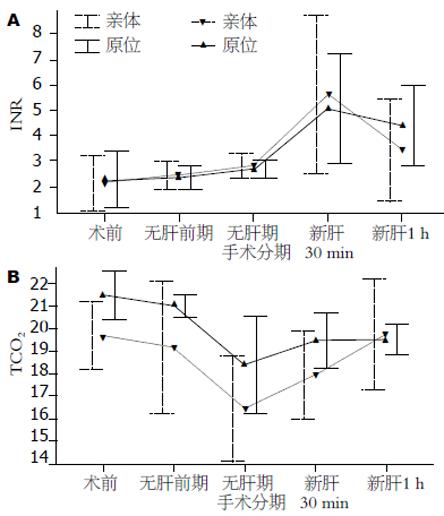
肝硬化患者的凝血指标检测结果提示, 本组患者从总体水平来看, 术前凝血状态介于肝癌组与急性肝衰组之间, 即PT、APTT、INR和FIB指标. 最为突出的是术前PLT明显减少, 亲体肝移植患者平均仅为32×109/L, 原位肝移植患者仅为39.70×109/L(100×109/L-300×109/L),与其他两组相比差异显著(P<0.05). 无肝前期各凝血指标的时间均有不同程度的延长, 但差异无显著性, FIB进一步降低. 此期PLT的短暂性升高与术前积极补充机采血小板有关. 无肝期各项指标进一步恶化, 至再灌注30 min, PT, APTT, INR值达到峰值, FIB水平于再灌注1 h后达到最低点, 与术前相比均差异显著(P<0.01), 再灌注1 h逐渐好转. 肝癌组与其他两组相比, 整个手术过程中的凝血指标检测结果较为乐观, 各指标术前基本正常, 术中变化幅度均较前两组小(P<0.05). 急性肝衰组患者术前PT、APTT、INR延长最为显著, 凝血状态最差(P<0.05), 但术中恢复较快. 无肝前期PT及INR有所缩短, 可能与手术开始后积极大量地补充血浆及各种凝血因子有关. 相比之下, FIB于各期均明显低于, 与其他两组相比(P<0.05). 三组患者HB、ALB与CO2于无肝期较术前均明显降低(P<0.05), 再灌注后缓慢恢复. 从表1、表2可以看出, 无论是亲体肝移植或原位移植,肝硬化组的患者整个术中的ALB水平较其他两组低, 无肝期与再灌注30 min最为明显(P<0.05). 应用Pearson相关分析术中出血量与围手术期因素(术前PT、APTT、INR、FIB、ALB、尿素氮、肌酐与MELD评分)的相关性, 发现MELD评分与术中出血量具有相关性(r = 0.619, P<0.05). 与原位肝移植相比,亲体肝移植术中凝血功能及代谢紊乱的变化较前者大, 尤以无肝前期及无肝期患者凝血功能的恶化较原位移植明显. 再灌注后各项凝血指标比原位移植组恢复迅速(P<0.05)(图1).
| 时间 | PT(s) | APTT(s) | INR | FIB(g/L) | PLT(×109/L) | HB(g/L) | ALB(g/L) | TCO2(mmol/L) |
| 肝硬化 | ||||||||
| 术前 | 23.55±9.55 | 73.00±38.09 | 2.14±1.08 | 0.93±0.37 | 32.00±7.96e | 74.50±14.15 | 31.20±3.57 | 22.20±2.78 |
| 无肝前期 | 28.73±5.34 | 76.38±24.96 | 2.48±0.55 | 0.77±0.19 | 38.50±9.95e | 68.50±23.00 | 26.83±5.09 | 20.83±2.51 |
| 无肝期 | 32.28±4.97a | 130.1±60.27a | 2.85±0.48a | 0.68±0.17a | 34.00±7.62e | 65.25±20.96 | 21.83±3.56ae | 16.53±3.65a |
| 再灌注30 min | 49.25±22.05b | 147.6±52.21b | 5.64±3.12b | 0.83±0.27 | 28.50±7.60ae | 67.00±19.20 | 21.05±4.42e | 18.48±2.86 |
| 再灌注60 min | 35.35±10.25a | 137.1±57.47b | 3.46±1.99a | 0.72±0.31 | 37.00±7.39e | 77.00±21.95 | 21.40±1.94e | 20.48±2.55 |
| 急性肝衰 | ||||||||
| 术前 | 36.90±12.82c | 97.26±44.79c | 4.29±1.57c | 0.62±0.26c | 91.4±38.06 | 74.40±26.75 | 32.44±8.17 | 19.66±1.48 |
| 无肝前期 | 23.48±3.94b | 112.5±71.97a | 2.11±0.48a | 0.68±0.12c | 79.2±44.81 | 74.00±16.14 | 29.42±4.43 | 19.16±2.91 |
| 无肝期 | 27.70±1.75a | 110.1±34.62a | 2.42±0.11a | 0.67±0.16 | 74.2±39.33 | 69.40±15.67 | 27.04±2.42 | 16.48±2.38 |
| 再灌注30 min | 35.44±3.85 | 152.9±60.16b | 3.80±0.27 | 0.51±0.12c | 74.6±36.54 | 73.20±14.74 | 27.90±5.15 | 17.94±1.94 |
| 再灌注60 min | 28.66±6.25a | 117.7±51.59a | 2.46±0.43a | 0.48±0.30c | 61.4±33.03a | 80.20±9.60 | 28.54±2.45 | 19.72±2.47 |
| 肝癌 | ||||||||
| 术前 | 18.13±2.71 | 40.00±23.11 | 1.49±0.28 | 2.28±0.93 | 70.00±61.94 | 97.67±41.79 | 34.43±3.62 | 17.87±4.84 |
| 无肝前期 | 24.30±7.94 | 47.73±9.33 | 2.69±1.33 | 1.60±0.59 | 75.33±66.40 | 101.67±42.0 | 29.43±2.65 | 17.80±4.51 |
| 无肝期 | 32.25±13.51b | 84.55±13.79b | 3.09±1.63b | 0.79±0.19b | 45.00±7.07a | 67.50±3.54a | 25.85±1.91a | 14.00±0.14a |
| 再灌注30 min | 30.17±16.16b | 72.27±22.16b | 3.41±2.11b | 1.26±0.53a | 64.33±42.15 | 91.33±25.92 | 28.00±1.00 | 16.00±6.08 |
| 再灌注60 min | 25.33±11.68a | 54.33±19.14a | 2.10±0.85a | 0.89±0.23b | 53.33±40.42 | 88.33±27.54 | 29.67±0.58 | 17.33±2.52 |
| 时间 | PT(s) | APTT(s) | INR | FIB(g/L) | PLT(×109/L) | HB(g/L) | ALB(g/L) | TCO2(mmol/L) |
| 肝硬化 | ||||||||
| 术前 | 20.32±7.19 | 75.00±28.17 | 2.25±1.12 | 0.89±0.10 | 39.70±7.96e | 69.13±17.95 | 30.42±6.35 | 20.14±1.63 |
| 无肝前期 | 25.43±5.17 | 75.64±23.00 | 2.37±0.45 | 0.71±0.26 | 41.50±6.54e | 71.34±10.79 | 28.68±3.58 | 19.64±3.18 |
| 无肝期 | 30.28±4.97 | 121.0±53.72b | 2.70±0.31a | 0.65±0.14a | 36.43±9.31e | 57.12±16.58 | 19.73±2.69ae | 17.22±1.02 |
| 再灌注30 min | 43.25±25.35b | 145.1±52.70b | 5.07±2.13b | 0.69±0.16 | 25.58±6.57ae | 63.87±25.49 | 20.56±4.17e | 17.49±2.60 |
| 再灌注60 min | 40.35±15.52a | 140.7±52.22b | 4.43±1.57a | 0.70±0.23 | 32.55±8.17e | 70.38±23.57 | 21.62±2.83 | 18.58±1.54 |
| 急性肝衰 | ||||||||
| 术前 | 38.40± 8.73c | 94.57±37.46c | 4.57±1.92c | 0.65±0.18c | 103.5±42.3 | 70.62±8.51 | 33.14±6.52 | 21.49±1.06 |
| 无肝前期 | 37.70± 4.61 | 115.0±47.13a | 4.00±0.83 | 0.67±0.23c | 89.44±35.17 | 73.65±20.19 | 29.88±2.79 | 21.00±0.53 |
| 无肝期 | 35.12±1.47 | 111.3±32.24a | 3.92±0.74 | 0.66±0.14 | 82.4±32.22 | 70.43±13.66 | 28.75±7.45 | 18.42±2.16 |
| 再灌注30 min | 32.44±6.75a | 147.9±53.73b | 3.49±0.62a | 0.50±0.21c | 79.59±45.62a | 72.76±15.37 | 27.43±3.81 | 19.47±1.23 |
| 再灌注60 min | 30.51±3.59a | 139.5±60.23a | 2.91±0.39a | 0.47±0.30c | 81.20±31.80 | 79.41±5.52 | 27.92±1.63 | 19.51±0.68 |
| 肝癌 | ||||||||
| 术前 | 19.00±5.30 | 45.83±16.22 | 1.06±0.25 | 2.37±0.76 | 83.60±50.31 | 90.65±45.33 | 32.15±2.33 | 17.63±3.34 |
| 无肝前期 | 19.97±4.36 | 48.14±7.53 | 1.87±0.58 | 2.01±0.91 | 79.42±57.05 | 95.86±41.97 | 30.64±1.77 | 18.09±2.71 |
| 无肝期 | 29.20±10.90a | 78.75±17.87b | 2.89±1.55a | 0.86±0.27b | 52.14±10.30a | 58.69±12.56 | 27.38±1.04 | 16.05±1.08 |
| 再灌注30 min | 32.17±14.19b | 75.64±12.26b | 2.97±1.94a | 1.01±0.46a | 53.62±39.35 | 85.14±9.62 | 28.52±4.25 | 16.72±4.60 |
| 再灌注60 min | 27.33±11.46a | 60.13±10.97a | 2.53±0.44a | 0.88±0.39b | 52.22±38.92 | 82.75±19.88 | 28.66±2.10 | 17.06±1.32 |
接受肝移植手术的患者常为慢性肝病晚期或急性暴发性肝功能衰竭. 由于各种原因导致肝实质破坏, 影响凝血因子的合成或致其质量下降[2], 内源性抗凝因子增加及原发或继发纤溶亢进, 从而出现凝血纤溶失衡而常常形成低凝状态导致肝移植术中的失血倾向. 晚期慢性肝病患者有70%合并脾亢而致的血小板数量减少功能异常加重这一出血. 肝移植术前应积极矫正低凝状态, 针对性补充体内缺乏的凝血因子如凝血酶原复合物、新鲜冰冻血浆和机采血小板等. 凝血因子的半衰期较短, 多在4-24 h, 故应在手术当日早晨给予. 新鲜冰冻血浆含有全部凝血及抗凝因子, 是改善凝血最理想的物质[3]. Camci et al[4]报道, 采用新鲜冰冻血浆作为置换液进行血浆置换可有效改善凝血障碍. Kimmings et al[5]报道, 高胆红素和胆汁酸血症可激活补体等因子而致凝血/纤溶紊乱促发弥散性血管内凝血(DIC). 因此若非急诊手术, 应于术前经皮肝穿刺胆管置管引流术(PTCD)纠正黄疸.
无肝前期, 手术解剖分离引起的出血及术中的输血补液使凝血因子丢失和稀释. 库存血含有的抗凝物质也随着进入血液循环, 而表现为凝血指标不同程度的下降. 这一时期应结合Sonoclot、凝血弹性描记图(thrombelastography, TEG)与PT、APTT、INR、PLT的监测结果指导输血给药, 减少出血量, 尽量保持凝血与纤溶平衡[6-8]. 同时随着手术时间的延长, 代谢性酸中毒、HB下降、白蛋白丢失使水电解质失衡、代谢紊乱、组织水肿,直接或间接地影响凝血功能, 应进行针对性调整, 保持内环境稳定. 进入无肝期后, 凝血因子迅速下降、组织纤溶酶原激活剂缺乏, 肝脏的清除作用而迅速增高、体内代谢产物及内毒素未经肝脏解毒直接进入血液循环、代谢性酸中毒、低钙血症、失血致凝血因子的进一步丢失等将进一步导致凝血功能进一步恶化. 这一时期凝血功能的维持主要依靠外来补充. 应根据检测结果积极补充新鲜冰冻血浆. 冷沉淀、凝血因子复合物、纤维蛋白原及新鲜冰冻血浆可明显改善凝血机制[9]. 且应注意代酸的调整, 此期尤为严重. Ozier et al[10]认为, 无肝后期和新肝早期凝血功能的明显低下可能与内源性凝血途径受抑制而纤溶活跃有关. 再灌注期, 门腔静脉系统的开放, APTT、INR明显延长, 纤维蛋白原达最低点[11]. 与文献报道相似[12]. 这些变化主要是由于移植肝窦内皮细胞大量组织因子、内源性肝素的释放[13]及再灌注引起的氧自由基, 白细胞介质释放, 大量酸性代谢产物进入循环与外源性肝素的入血所致. 再灌注早期主要表现为严重的低凝状态与纤溶亢进. 此期我们应该采用鱼精蛋白对抗肝素效应, 抑肽酶对抗纤溶和补充纤维蛋白原, 而凝血因子的补充不应过于积极. 亲体肝移植术移植肝脏冷缺血时间较短, 再灌注1 h后凝血功能明显改善. 从图1、图2中我们可以看到凝血功能的恢复常较代谢性酸中毒的纠正迟滞. 因此手术末期若酸中毒逐渐纠正的情况下, 凝血因子的补充同样不应过于积极, 以防止肝移植术后最重要的并发症-血管内血栓形成[14-15].
本文通过对整个手术过程中ALB及TCO2变化特点进行分析发现, 尽管在手术过程中根据检测结果间断补充人血ALB, 但肝硬化患者在进入无肝期后始终维持在20 g/L左右, 而其他两组患者则不然. 究其原因可能是由于肝硬化患者晚期全身各器官慢性损伤, 储备功能差. 外界侵入性操作易诱发全身炎症反应综合征(SIRS), 慢性肾功能不全常常伴术中中重度慢性代谢性酸中毒使全身性毛细血管通透性增高, 大量外源性人血ALB渗漏导致术野不清晰, 影响手术操作难度, 产生恶性循环. 因此这一现象提示, 我们肝硬化患者进行肝移植术中, 控制SIRS以及酸碱平衡显得尤为重要.
从本研究结果我们可以看到与原位移植相比, 亲体肝移植术中凝血功能及代谢紊乱的变化较前者大, 尤以无肝前期及无肝期患者凝血功能的恶化较原位移植明显. 再灌注后各项凝血指标的恢复又常常比原位移植迅速. 分析原因有: (1)亲体肝移植与原位移植相比, 是一项要求精细度更高的手术操作. 在进行各管道分支吻合的过程中增加了手术时间, 无肝期延长, 凝血功能随之恶化. (2)出血量前者常常大于后者. (3)与原位移植相比, 亲体肝移植最大的优势是冷缺血时间很短, 约20 min左右, 而热缺血时间几乎为零. 在这种状态下能确保供肝的质量, 因此在受体全身状态较为平稳的情况下可使供肝迅速发挥作用.
亲体肝移植术往往较原位移植出血凶猛, 较难控制. 本文肝硬化组平均出血量为13 425 mL, 其原因可能由于围手术期全身各器官慢性损伤, 储备功能差, 尤以肝肾为主, 常伴有慢性肾功能不全、慢性代谢性酸中毒、黄疸等症状, 造成凝血功能障碍且矫正困难, 从而导致大量出血. 另外, 晚期肝硬化患者PLT明显减少, 脾大, 脾功能亢进, 产生抗血小板自身抗体和肠源性内毒素, 血小板生成素(TPO)减少, 不仅数量减少, 功能也常常受到不同程度的影响. 肝硬化肝癌患者则出血较少, PT、APTT异常但较易保持轻度低凝状态. 本文肝癌患者术中平均出血量仅2200 mL, 与单纯肝硬化患者相比明显减少. 究其原因可能是由于原发性肝癌患者常表现有伴癌综合征的特点, 如红细胞增多、血液高凝等. 这些表现恰恰适度抵消肝功能不全引起的血液低凝. 急性肝功能衰竭组之出血量居肝硬化与原发性肝癌组之间. 此类患者常急诊行亲体肝移植术, 术时患者内环境紊乱, 在全身应激因子所致的级联反应影响之下, 各器官储备功能虽强但无以发挥. 急诊肝移植术后, 内环境纠正, 各器官功能得以迅速恢复, 其凝血功能亦然. 总体来说, 原位移植术较亲体肝移植平稳, 出血量亦少. 70%的患者仅使用补充凝血因子的药物即可保证手术的顺利进行而不需要额外的血液制品. 再灌注后机体各系统功能的近期恢复较亲体移植迟缓. 有关原位移植与亲体肝移植远期疗效的对比性研究我们还需要进一步的研究与探讨. 总之, 不同的移植方式与不同病因使受者术中的凝血功能变化不尽相同. 因此我们应根据患者的具体情况, 详尽分析与监测, 才能有效地改善移植患者围手术期凝血/纤溶功能, 保证手术顺利进行及术后患者的平稳恢复.
我国的临床肝移植近年来发展迅速, 95%的肝源来自死囚的捐献. 为了规范和加强人体器官捐献技术临床应用管理, 国务院于2007-03-21颁布了《人体器官移植条例》, 并于今年05-01全国实行. 这项条例的实行大大减少了"死囚"器官的来源, 继而亲体肝移植术在我院逐渐展开. 此项技术在我国医学领域尚属初步发展阶段, 科学地掌握亲体肝移植患者手术过程中凝血功能的变化及影响因素, 进而合理应用凝血药物及血制品对手术的顺利进行及患者的康复具有重要意义.
与原位肝移植相比, 亲体肝移植是一项操作难度大, 手术时间较长的技术. 手术操作的顺利进行往往依赖于患者相对平稳的机体状态, 其中凝血功能与代谢状态显得尤为重要. 影响因素繁多复杂, 就凝血状态而言就涉及凝血、抗凝、纤溶、抗纤溶不同领域. 因此彻底掌握亲体肝移植患者在手术过程中各系统在网络变化中的作用是非常重要的.
Ozier et al指出在肝移植过程中患者出血是多因素共同作用的结果, 在术前不可预知, 认为术中应用迅速而灵敏的仪器来监测凝血状态的变化是最重要的.
本文总结亲体肝移植术手术过程中凝血功能变化及影响因素的相关分析, 并与原位移植进行对比研究, 提出亲体肝移植术中特有的凝血功能变化规律曲线, 影响术中出血量的围手术期因素和相应治疗中的注意事项.
本研究掌握了亲体肝移植术中特有的凝血功能变化规律曲线及影响术中出血量的围手术期因素, 对纠正凝血紊乱, 减少术中出血有一定的指导意义.
本文内容丰富, 科学性强, 具有较好的临床实用价值.
编辑: 程剑侠 电编: 刘勇
| 1. | Bassas AF, Chehab MS, Al-Shahed MS, Djurberg HG, Al-Shurafa HA, Jawdat MT, Al-Hussaini HF, Zuleika MA, Al-Hebby HA, Wali SH. Pediatric living-related liver transplantation in Saudi Arabia. Saudi Med J. 2002;23:640-644. [PubMed] |
| 3. | Contreras M, Ala FA, Greaves M, Jones J, Levin M, Machin SJ, Morgan C, Murphy W, Napier JA, Thomson AR. Guidelines for the use of fresh frozen plasma. British Committee for Standards in Haematology, Working Party of the Blood Transfusion Task Force. Transfus Med. 1992;2:57-63. [PubMed] |
| 4. | Camci C, Akdogan M, Gurakar A, Gilcher R, Rose J, Monlux R, Alamain S, Wright H, Sebastian A, Nour B. The impact of total plasma exchange on early allograft dysfunction. Transplant Proc. 2004;36:2567-2569. [PubMed] [DOI] |
| 5. | Kimmings AN, van Deventer SJ, Obertop H, Rauws EA, Huibregtse K, Gouma DJ. Endotoxin, cytokines, and endotoxin binding proteins in obstructive jaundice and after preoperative biliary drainage. Gut. 2000;46:725-731. [PubMed] [DOI] |
| 6. | Salooja N, Perry DJ. Thrombelastography. Blood Coagul Fibrinolysis. 2001;12:327-337. [PubMed] [DOI] |
| 7. | 武 宙阳. Sonoclot凝血和血小板功能分析仪在体外循环中的应用. 《国外医学》麻醉学与复苏分册. 2003;24:55. |
| 8. | 邓 彩英, 邓 小明. Sonoclot凝血和血小板功能分析仪在临床中的应用. 《国外医学》麻醉学与复苏分册. 2001;22:168. |
| 9. | Takatsuki M, Chen CL, Chen YS, Cheng YF, Huang TL. Systemic thrombolytic therapy for late-onset portal vein thrombosis after living-donor liver transplantation. Transplantation. 2004;77:1014-1018. [PubMed] |
| 10. | Ozier Y, Steib A, Ickx B, Nathan N, Derlon A, Guay J, De Moerloose P. Haemostatic disorders during liver transplantation. Eur J Anaesthesiol. 2001;18:208-218. [PubMed] [DOI] |
| 11. | Leroy-Matheron C, Duvoux C, Van Nhieu JT, Leroy K, Cherqui D, Gouault-Heilmann M. Activated protein C resistance acquired through liver transplantation and associated with recurrent venous thrombosis. J Hepatol. 2003;38:866-869. [PubMed] [DOI] |
| 13. | Harding SA, Mallett SV, Peachey TD, Cox DJ. Use of heparinase modified thrombelastography in liver transplantation. Br J Anaesth. 1997;78:175-179. [PubMed] [DOI] |
| 14. | Chen JW, Chen DZ, Lu GZ. Asymptomatic process of hepatic artery thrombosis in a patient after orthotopic liver transplantation. Hepatobiliary Pancreat Dis Int. 2004;3:149-151. [PubMed] |
| 15. | Pawlak J, Grodzicki M, Leowska E, Małkowski P, Michałowicz B, Nyckowski P, Rowiński O, Pacho R, Zieniewicz K, Andrzejewska M. Vascular complications after liver transplantation. Transplant Proc. 2003;35:2313-2315. [PubMed] [DOI] |