修回日期: 2007-11-06
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 提取并纯化人宫颈癌细胞(HeLa)的线粒体DNA聚合酶γ(DNA polymerase γ, Pol γ), 鉴定其纯度和活性.
方法: 运用离子交换层析等方法提取纯化HeLa细胞的线粒体Pol γ, 并用Bradford法检测蛋白浓度. 经SDS-PAGE检测蛋白纯度和相对分子量, Western blotting验证蛋白. 用α-32P-dTTP掺入法, 液体闪烁计数器进行放射性测量以确定Pol γ的活性.
结果: 成功提取并纯化HeLa细胞的线粒体Pol γ, 经SDS-PAGE鉴定, 有一个大约140 kDa的亚基单位, Western blotting证实为Pol γ. 对其进行150倍纯化, 收得率为6%, 酶的总活力为4.81 U, 比活力为36.17 U/mg.
结论: HeLa细胞的线粒体Pol γ通过离子交换层析法提取和纯化后活性较高, 可用于体外药物线粒体毒性的检测.
引文著录: 张颖慧, 林菊生, 李岩, 高琳琳, 王晓燕. DNA聚合酶γ的提取、纯化和鉴定. 世界华人消化杂志 2007; 15(35): 3715-3721
Revised: November 6, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To purify and identify the mitochondrial DNA polymerase gamma (polymerase γ, Pol γ) from HeLa cells.
METHODS: Ion exchange chromatography was used to isolate Pol γ from HeLa cells. Protein concentration was measured using the Bradford method. SDS-PAGE was performed to determine the molecular weights of the subunits of Pol γ. Following the incorporation of α-32P-dTTP, the activity of Pol γ was counted using a liquid scintillation spectrometer.
RESULTS: Pol γ was purified by 150-fold to apparent homogeneity, with a 6% yield. SDS-PAGE indicated the presence of one subunit of 140 kDa, and Western blotting identified the specificity. Total activity and specific activity of Pol γ were determined to be 4.81 U and 36.17 U/mg, respectively, by chromatography.
CONCLUSION: Pol γ can be purified by ion exchange chromatography. It can then be activated and used as a target to detect the toxicity of some compounds to mitochondria in vitro.
- Citation: Zhang YH, Lin JS, Li Y, Gao LL, Wang XY. Isolation, purification and identification of DNA polymerase gamma. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3715-3721
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3715.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3715
DNA聚合酶可以进行严格的DNA复制和修复DNA损伤, 对于保持基因组的完整性是不可缺少的[1]. 在人类细胞中, 现已发现15种不同的DNA聚合酶, 然而只有4种参与DNA的复制, 余下的参与DNA的修复和特定DNA合成[2-3]. 虽然大部分酶参与核DNA的复制和修复, 然而至今, DNA聚合酶γ(DNA polymerase γ, Pol γ)仍然是线粒体内唯一的DNA聚合酶[4], 由核基因编码[5], 对于线粒体DNA(mtDNA)的复制﹑合成与修复起着独一无二的作用[2,6].
最近有许多抗病毒核苷类似物如治疗HIV的叠氮胸苷(AZT), 治疗乙肝的拉米呋定(lamivudine)和恩替卡韦(entecavir)等, 在治疗方面起了很大的作用, 但其毒副作用不容忽视. 这些药物的毒副作用主要作用于线粒体, 其中Pol γ对其高度敏感[7]. 很多体外研究表明这些药物可以抑制线粒体DNA聚合酶活性从而影响线粒体DNA的合成, 以至影响线粒体的功能[8-9]. 本研究旨在提取并纯化得到有活性的Pol γ, 以利于以后有关药物对于线粒体毒性的研究.
HeLa S3细胞来自于本学院免疫教研室, 换液传代后, 按批冻存在-70℃冰箱待用. 层析所需预溶胀DE52填料、磷酸纤维素填料(P11)均为Whatman产品, 羟基磷灰石填料(HTP)为Bio-Rad产品, SDS-PAGE所用装置为Bio-Rad MiNi Protean-Ⅲ电泳系统, 兔抗人聚合酶γ抗体购自Neomarkers. 层析柱购自上海锦华层析设备厂, 规格有1.0×20 cm, 1.6×25 cm, 0.5×20 cm. 检测酶活性所需的活化小牛胸腺DNA购自Sigma, 反应底物dNTP为BioLabs公司产品.
1.2.1 细胞培养: 常规HeLa S-3细胞培养, 收集处于对数生长期的细胞, 按照马歇克主编的《蛋白质纯化与鉴定实验指南》制备冰冻细胞-70℃保存.
1.2.2 细胞碎片制备: 若未特别说明, 所有实验均在0℃-4℃进行, 洗脱液中均含有0.5 mmol/L二硫苏糖醇(DTT). 将分批冻存的细胞从-70℃冰箱取出约20 g, 冰冻细胞悬浮在含有10 mmol/L NaCl, 1 mmol/L K3PO4(pH7.8), 0.5 mmol /L DTT的80 mL溶液中, 零度放置20 min后用匀浆器将细胞破碎, 1000 r/min离心10 min, 分离细胞质和细胞核, 留取上清细胞质组分. 将细胞核重悬在含有0.32 mmol/L蔗糖, 1 mmol/L MgCl2, 1 mmolL K3PO4(pH6.8), 0.3% Triton N-101, 0.5 mmol/L DTT的120 mL溶液中, 匀浆后100 r/min离心10 min, 上清中含有细胞质碎片. 将所得上清与第一次上清混合, 20 000 g离心20 min后, 收集上清即为细胞质碎片(含有目的蛋白).
1.2.3 第一次DEAE除核酸: 按照说明书, 所用填料的质量根据抽出样品测得的蛋白量决定. 称取一定量的预溶胀DEAE填料, 用0.4 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT平衡填料, 用同样的溶液平衡1.0×20 cm柱子. 将100 mL细胞质碎片上柱, 再用10倍柱子填料体积的0.4 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT洗脱, 核酸被吸附到柱子上, 酶被洗脱. 将洗脱下来的酶溶液用蔗糖溶液浓缩过夜, 并用0.02 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT透析平衡.
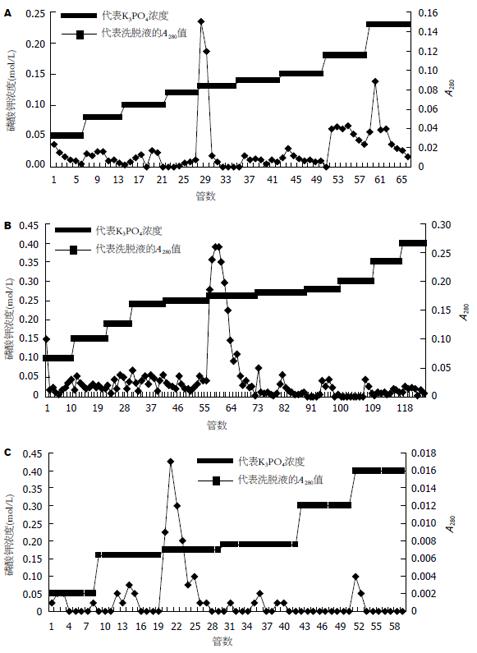
1.2.4 第二次DEAE层析: 用0.02 mol/L K3PO4 (pH 7.5)和0.5 mmol/L DTT平衡填料. 灌柱平衡后, 将透析后所得的溶液加入1.0×20 cm柱子, 用一倍填料体积的0.02 mol/L K3PO4(pH7.5)冲洗柱子, 然后用0.05-0.23 mol/L K3PO4(pH7.5)的浓度梯度、八倍填料的体积洗脱液洗脱柱子. 分别收集得到的洗脱液后测A280值, 找出洗脱峰. 用大量峰值的K3PO4(pH7.5)溶液洗脱柱子, 得到的溶液即为含有Pol γ的洗脱液, 蔗糖溶液浓缩过夜, 再用0.01 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT透析平衡.
1.2.5 磷酸纤维素(P11)层析: 用0.01 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT溶胀P11填料, 灌1.6×25 cm柱平衡过夜. 将从DEAE层析获得的透析后的峰值碎片上柱, 八倍体积的K3PO4(pH7.5)洗脱液按浓度梯度0.1-0.28 mol/L冲洗柱子. 根据测得的洗脱成分A280值, 找出洗脱峰对应的K3PO4(pH7.5)浓度. 大量此溶液冲洗柱子, 洗脱下来的溶液即为含有Pol γ的溶液, 蔗糖溶液浓缩后用0.05 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT透析平衡.
1.2.6 羟基磷灰石(HTP)层析: 按照说明书用0.05 mol/L K3PO4(pH7.5)和0.5 mmol/L DTT平衡HTP粉剂, 灌入0.5×20 cm柱子待其平衡好后, 将P11层析后经过透析平衡后的溶液上柱, 10倍体积的K3PO4(pH7.5)洗脱液按浓度梯度0.05-0.40 mol/L冲洗柱子. 收集洗脱成分测其A280, 用大量出现洗脱峰时的K3PO4(pH7.5)溶液洗脱柱子上的吸附蛋白. 收集后放在透析袋中, 用蔗糖晶体浓缩溶液一直到不能再浓缩为止.
1.2.7 线粒体Pol γ活性检测: 参照文献[10-11]建立酶活性检测反应体系: 50 μL的反应总溶液, 其中含有45 mg/L牛血清白蛋白, 50 mmol/L Tris-HCl(pH8.5), 7.5 mmol/L MgCL2, 0.5 mmol/L DTT, 100 μg/mL活化的小牛胸腺DNA作为模板, 100 μmol/L dATP, dGTP, dCTP和α-32P-dTTP 3.7×104 Bq, 37℃孵育30 min. 酶活性定义为: 37℃反应条件下30 min, 催化结合1 nmol脱氧核苷酸的量.
1.2.8 SDS-PAGE变性聚丙烯酰胺凝胶电泳: 制成分离胶浓度为80 mL/L, 浓缩胶为50 mL/L, 层析后抽出的1 mL样品. 分别抽出一部分将其与上样缓冲液混合, 煮沸后进行聚丙烯酰胺凝胶电泳. 其中浓缩胶所用电压为80 V, 分离胶为120 V. 电泳结束后, 考马斯亮兰染色过夜, 脱色后在凝胶成像系统下拍照.
1.2.9 Western blot检测Pol γ: 样品按照SDS-PAGE变性聚丙烯酰胺凝胶电泳结束后进行转膜, 然后用兔抗人聚合酶γ抗体进行一抗孵育, 结束后羊抗兔二抗孵育, 最后用DAB在膜上显色.
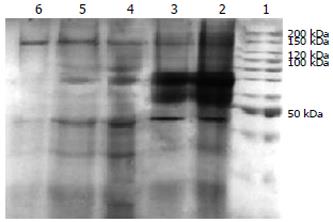
将破碎细胞离心所得组分上入DEAE柱除去核酸后, 收集得到的洗脱液浓缩测得体积为120 mL, 用考马斯亮兰法测得蛋白浓度为2.1 g/L. 经SDS-PAGE电泳看到一条140 kDa的亚基(图1), 并用Western blot证实其特异性(图2). 所得蛋白透析后用不同浓度梯度的K3PO4(pH7.5)经过第二次DEAE层析(图3A),收集峰值的洗脱液, 浓缩后约60 mL, 测得蛋白浓度为0.68 g/L. 透析后上磷酸纤维素柱子(图3A), 出现A280峰值时所用的K3PO4(pH7.5)溶液洗脱柱子, 收集得到的洗脱液浓缩后约13 mL, 蛋白浓度为0.22 g/L. 透析后进行羟基磷灰石层析(图3A). 按照图中所示的K3PO4浓度梯度洗脱柱子, 收集峰值的洗脱液, 即为最后纯化所得的DNA聚合酶γ, 浓缩到最后溶液约为1.9 mL, 测得其浓度为0.07 g/L. 电泳后在140 kDa处看到一条很浅的条带, Western blotting表明此为线粒体DNA聚合酶.
在Pol γ的逐步层析纯化中对每一步浓缩后的蛋白进行电泳(图1)鉴定其纯度, 发现其杂蛋白条带逐渐减少, 其目的蛋白的一个亚基(140 kDa)条带颜色逐步变浅, 证明其蛋白得到了有效的纯化. 进行Western blot印迹(图2)特异性结合鉴定其为Pol γ. 在纯化过程中每次层析后测得其总蛋白、总活力、比活力、纯化倍数及蛋白收得率, 结果显示酶的活力虽然逐渐降低, 但是其比活力、纯化倍数却逐渐增高, 获得率逐渐降低, 表明目的蛋白得到了逐步的纯化, 杂蛋白量渐少(表1, 图1). 纯化完后蛋白的纯化倍数为150, 达到了较高的纯化, 说明此方法可用来提纯纯度较高的Pol γ.
| 步骤 | 总蛋白(mg) | 总活力(Ukat) | 比活力(Ukat/mg) | 纯化倍数 | 收得率(%) |
| 破碎细胞后所得 | 330 | 78 | 0.24 | / | / |
| 第1次DEAE层析 | 252 | 103 | 0.40 | 2 | 132 |
| 第2次DEAE层析 | 40.8 | 67 | 1.64 | 7 | 86 |
| P11层析 | 2.86 | 54 | 18.88 | 78 | 69 |
| HTP层析 | 0.133 | 4.81 | 36.17 | 150 | 6 |
Pol γ位于线粒体基质[1-2], 是唯一存在于线粒体中的DNA聚合酶. 虽然只占线粒体蛋白的0.008%, 但是对于维持mtDNA连续性和正确性起着重要作用, 保证线粒体正常行使功能[13-14]. 在此, 我们从人HeLa细胞中提取了Pol γ, 并用多步离子交换层析纯化. 虽然收得率较低, 但是得到了较高纯化倍数并具有活性的DNA聚合酶, 经SDS-PAGE电泳表明含有一个明确的亚基(140 kDa). 完整的Pol γ应包含有两个亚基, 一个较大的催化亚基Pol γ A(140 kDa)和一个较小的调节亚基Pol γ B(55 kDa). 大亚基除了主要的聚合酶作用外, 还有3'-5'核酸外切酶的作用, 在碱基切除修复中去除5'脱氧核糖核酸(dRP). 小亚基Pol γ B有增加大亚基持续合成的能力, 在碱基切除修复中起到增强催化亚基的作用, 通过识别RNA引物激发mtDNA的合成[15-19]. 双链DNA(dsDNA)的结合也是通过Pol γ B协助Pol γ A进行定位[20]. 生物化学对于人Pol γ的鉴定表明, 在酶的纯化过程中, 由于Pol γ B的缔合常数太小可导致其丢失[21-22], 故我们电泳只看到一个大的催化亚基, 小亚基可能已丢失. 但是通过活性检测证明, 在体外他仍然有正确合成DNA的作用并具有较高的活性. 酵母菌中提取出来的聚合酶本身就只有一个大亚基, 但是仍然有高的持续合成能力[23].
最近研究显示, 许多疾病与Pol γ的功能密切相关, 如进行性眼外肌麻痹(PEO)[24-26], 弥漫性进行性脑灰质变性[27]、感觉性共济失调、神经病变、发音困难和帕金森综合征[28], 男性不育[29-31]也与其聚合酶的活性有关. 正常mtDNA由于Pol γ的存在, 其错配率很低. 但是随着年龄的增长, 由于Pol γ的活性和功能的下降, 修复氧化损伤的能力会随着DNA聚合酶的活性及碱基切除修复的能力的下降而下降. 线粒体是进行有氧呼吸的主要场所, 导致活性氧族的堆积, 与氧化损伤的有关疾病如黄斑变性和阿尔茨海默病也由此出现[12]. 曾有研究者用有Pol γ功能缺陷的转基因小鼠模型, 但他缺乏核酸外切酶的校正功能不能保证mtDNA的正确复制, 从而增加线粒体DNA的突变率[32]和心肌病的危险性[33-34]. 另外常染色体显性或隐性疾病的发生也与线粒体DNA聚合酶的活性有关. 如PEO就是由于大脑中突变的mtDNA超过总数的50%, 而Pol γ的功能异常不能正常修复[35-37]. 近年来有许多对于抗HBV和HIV的抗病毒药物(拉米呋定﹑恩替卡韦和叠氮胸苷等)的研究, 其机制为竞争抑制病毒的逆转录酶或者病毒的DNA聚合酶. 而作为人线粒体中唯一的DNA聚合酶Pol γ对其敏感性很高, 毒性大[38-42]. 大量的基础和临床研究一致报道, 核苷类逆转录酶抑制剂(NRTIs)如扎西他宾、地达诺新、司他夫定对于Pol γ有很强的抑制作用[43-50]. 由此可见DNA聚合酶γ在临床疾病的发生发展及治疗中起着巨大的作用. 他可提供一个新的药理治疗的目标来推动DNA的修复, 也可用于核苷类似物药物的毒性检测及药物的筛选等. 我们提纯有活性的酶以利于体外研究, 而在纯化的过程中, 洗脱液里都加了少量的抗氧化剂DTT. 虽然酶的活性好, 并得到了很好的纯化, 但是酶的获得量仍然很少, 用此来做药物的毒性检测尚可, 但是若要用于其他研究就远远不够. 因此, 我们应寻找到更好的提取与纯化此酶的方法以得到大量有活性的酶.
DNA聚合酶γ(Pol γ)指导着线粒体DNA的正确合成, 保证线粒体很好行使其功能. 近年来新出现的核苷类抗病毒药物毒副作用主要也作用与Pol γ, 并且与许多疾病的发生(如PEO)密切相关.
本文经过多次离子交换层析得到有活性的纯度较高的Pol γ, 并且将其用做体外抗病毒药物毒性的研究.
Pol γ可以用于药物毒性的体外研究, 也可研究其对mtDNA复制和修复的相关机制.
DEAE: 一种阴离子交换纤维素, 装柱后可以使交换剂的外水空间增大, 结构更牢固, 并且电荷分布更均匀, pH变化范围宽, 可以根据需要选择不同的种类吸附不同电荷大小的蛋白质或者核酸, 稳定性较好.
本文思路清晰, 实验步骤严谨, 讨论较为系统, 具有一定的学术价值和临床指导意义.
编辑: 李军亮 电编: 郭海丽
| 1. | Graziewicz MA, Longley MJ, Copeland WC. DNA polymerase gamma in mitochondrial DNA replication and repair. Chem Rev. 2006;106:383-405. [PubMed] [DOI] |
| 2. | Hance N, Ekstrand MI, Trifunovic A. Mitochondrial DNA polymerase gamma is essential for mammalian embryogenesis. Hum Mol Genet. 2005;14:1775-1783. [PubMed] [DOI] |
| 3. | Burgers PM, Koonin EV, Bruford E, Blanco L, Burtis KC, Christman MF, Copeland WC, Friedberg EC, Hanaoka F, Hinkle DC. Eukaryotic DNA polymerases: proposal for a revised nomenclature. J Biol Chem. 2001;276:43487-43490. [PubMed] [DOI] |
| 4. | Kaguni LS. DNA polymerase gamma, the mitochondrial replicase. Annu Rev Biochem. 2004;73:293-320. [PubMed] [DOI] |
| 5. | Stuart GR, Santos JH, Strand MK, Van Houten B, Copeland WC. Mitochondrial and nuclear DNA defects in Saccharomyces cerevisiae with mutations in DNA polymerase gamma associated with progressive external ophthalmoplegia. Hum Mol Genet. 2006;15:363-374. [PubMed] [DOI] |
| 6. | Fan L, Kim S, Farr CL, Schaefer KT, Randolph KM, Tainer JA, Kaguni LS. A novel processive mechanism for DNA synthesis revealed by structure, modeling and mutagenesis of the accessory subunit of human mitochondrial DNA polymerase. J Mol Biol. 2006;358:1229-1243. [PubMed] [DOI] |
| 7. | Lim SE, Ponamarev MV, Longley MJ, Copeland WC. Structural determinants in human DNA polymerase gamma account for mitochondrial toxicity from nucleoside analogs. J Mol Biol. 2003;329:45-57. [PubMed] [DOI] |
| 8. | Simpson MV, Chin CD, Keilbaugh SA, Lin TS, Prusoff WH. Studies on the inhibition of mitochondrial DNA replication by 3'-azido-3'-deoxythymidine and other dideoxynucleoside analogs which inhibit HIV-1 replication. Biochem Pharmacol. 1989;38:1033-1036. [PubMed] [DOI] |
| 9. | Chen CH, Cheng YC. Delayed cytotoxicity and selective loss of mitochondrial DNA in cells treated with the anti-human immunodeficiency virus compound 2',3'-dideoxycytidine. J Biol Chem. 1989;264:11934-11937. [PubMed] |
| 10. | Ogihara M, Tanno M, Izumiyama N, Nakamura H, Taguchi T. Increase in DNA polymerase gamma in the hearts of adriamycin-administered rats. Exp Mol Pathol. 2002;73:234-241. [PubMed] [DOI] |
| 11. | Gray H, Wong TW. Purification and identification of subunit structure of the human mitochondrial DNA polymerase. J Biol Chem. 1992;267:5835-5841. [PubMed] |
| 12. | Graziewicz MA, Day BJ, Copeland WC. The mitochondrial DNA polymerase as a target of oxidative damage. Nucleic Acids Res. 2002;30:2817-2824. [PubMed] [DOI] |
| 13. | Longley MJ, Ropp PA, Lim SE, Copeland WC. Characterization of the native and recombinant catalytic subunit of human DNA polymerase gamma: identification of residues critical for exonuclease activity and dideoxynucleotide sensitivity. Biochemistry. 1998;37:10529-10539. [PubMed] [DOI] |
| 14. | Cortina MS, Gordon WC, Lukiw WJ, Bazan NG. Oxidative stress-induced retinal damage up-regulates DNA polymerase gamma and 8-oxoguanine-DNA-glycosylase in photoreceptor synaptic mitochondria. Exp Eye Res. 2005;81:742-750. [PubMed] [DOI] |
| 15. | Carrodeguas JA, Bogenhagen DF. Protein sequences conserved in prokaryotic aminoacyl-tRNA synthetases are important for the activity of the processivity factor of human mitochondrial DNA polymerase. Nucleic Acids Res. 2000;28:1237-1244. [PubMed] [DOI] |
| 16. | Carrodeguas JA, Kobayashi R, Lim SE, Copeland WC, Bogenhagen DF. The accessory subunit of Xenopus laevis mitochondrial DNA polymerase gamma increases processivity of the catalytic subunit of human DNA polymerase gamma and is related to class II aminoacyl-tRNA synthetases. Mol Cell Biol. 1999;19:4039-4046. [PubMed] [DOI] |
| 17. | Fan L, Sanschagrin PC, Kaguni LS, Kuhn LA. The accessory subunit of mtDNA polymerase shares structural homology with aminoacyl-tRNA synthetases: implications for a dual role as a primer recognition factor and processivity clamp. Proc Natl Acad Sci U S A. 1999;96:9527-9532. [PubMed] [DOI] |
| 18. | Lim SE, Longley MJ, Copeland WC. The mitochondrial p55 accessory subunit of human DNA polymerase gamma enhances DNA binding, promotes processive DNA synthesis, and confers N-ethylmaleimide resistance. J Biol Chem. 1999;274:38197-38203. [PubMed] [DOI] |
| 19. | Wang Y, Farr CL, Kaguni LS. Accessory subunit of mitochondrial DNA polymerase from Drosophila embryos. Cloning, molecular analysis, and association in the native enzyme. J Biol Chem. 1997;272:13640-13646. [PubMed] [DOI] |
| 20. | Pinz KG, Bogenhagen DF. The influence of the DNA polymerase gamma accessory subunit on base excision repair by the catalytic subunit. DNA Repair (Amst). 2006;5:121-128. [PubMed] [DOI] |
| 21. | Johnson AA, Tsai Yc, Graves SW, Johnson KA. Human mitochondrial DNA polymerase holoenzyme: reconstitution and characterization. Biochemistry. 2000;39:1702-1708. [PubMed] [DOI] |
| 22. | Graves SW, Johnson AA, Johnson KA. Expression, purification, and initial kinetic characterization of the large subunit of the human mitochondrial DNA polymerase. Biochemistry. 1998;37:6050-6058. [PubMed] [DOI] |
| 23. | Lucas P, Lasserre JP, Plissonneau J, Castroviejo M. Absence of accessory subunit in the DNA polymerase gamma purified from yeast mitochondria. Mitochondrion. 2004;4:13-20. [PubMed] [DOI] |
| 24. | Van Goethem G, Dermaut B, Löfgren A, Martin JJ, Van Broeckhoven C. Mutation of POLG is associated with progressive external ophthalmoplegia characterized by mtDNA deletions. Nat Genet. 2001;28:211-212. [PubMed] [DOI] |
| 25. | Lamantea E, Tiranti V, Bordoni A, Toscano A, Bono F, Servidei S, Papadimitriou A, Spelbrink H, Silvestri L, Casari G. Mutations of mitochondrial DNA polymerase gammaA are a frequent cause of autosomal dominant or recessive progressive external ophthalmoplegia. Ann Neurol. 2002;52:211-219. [PubMed] [DOI] |
| 26. | Copeland WC, Ponamarev MV, Nguyen D, Kunkel TA, Longley MJ. Mutations in DNA polymerase gamma cause error prone DNA synthesis in human mitochondrial disorders. Acta Biochim Pol. 2003;50:155-167. [PubMed] |
| 27. | Davidzon G, Mancuso M, Ferraris S, Quinzii C, Hirano M, Peters HL, Kirby D, Thorburn DR, DiMauro S. POLG mutations and Alpers syndrome. Ann Neurol. 2005;57:921-923. [PubMed] [DOI] |
| 28. | Van Goethem G, Martin JJ, Dermaut B, Löfgren A, Wibail A, Ververken D, Tack P, Dehaene I, Van Zandijcke M, Moonen M. Recessive POLG mutations presenting with sensory and ataxic neuropathy in compound heterozygote patients with progressive external ophthalmoplegia. Neuromuscul Disord. 2003;13:133-142. [PubMed] [DOI] |
| 29. | Rovio AT, Marchington DR, Donat S, Schuppe HC, Abel J, Fritsche E, Elliott DJ, Laippala P, Ahola AL, McNay D. Mutations at the mitochondrial DNA polymerase (POLG) locus associated with male infertility. Nat Genet. 2001;29:261-262. [PubMed] [DOI] |
| 30. | Krausz C, Guarducci E, Becherini L, Degl'Innocenti S, Gerace L, Balercia G, Forti G. The clinical significance of the POLG gene polymorphism in male infertility. J Clin Endocrinol Metab. 2004;89:4292-4297. [PubMed] [DOI] |
| 31. | Aknin-Seifer IE, Touraine RL, Lejeune H, Jimenez C, Chouteau J, Siffroi JP, McElreavey K, Bienvenu T, Patrat C, Levy R. Is the CAG repeat of mitochondrial DNA polymerase gamma (POLG) associated with male infertility? A multi-centre French study. Hum Reprod. 2005;20:736-740. [PubMed] [DOI] |
| 32. | Trifunovic A, Wredenberg A, Falkenberg M, Spelbrink JN, Rovio AT, Bruder CE, Bohlooly-Y M, Gidlöf S, Oldfors A, Wibom R. Premature ageing in mice expressing defective mitochondrial DNA polymerase. Nature. 2004;429:417-423. [PubMed] [DOI] |
| 33. | Zhang D, Ezekiel UR, Chang SW, Zassenhaus HP. Gene expression profile in dilated cardiomyopathy caused by elevated frequencies of mitochondrial DNA mutations in the mouse heart. Cardiovasc Pathol. 2005;14:61-69. [PubMed] [DOI] |
| 34. | Zhang D, Mott JL, Chang SW, Stevens M, Mikolajczak P, Zassenhaus HP. Mitochondrial DNA mutations activate programmed cell survival in the mouse heart. Am J Physiol Heart Circ Physiol. 2005;288:H2476-H2483. [PubMed] [DOI] |
| 35. | Luoma P, Melberg A, Rinne JO, Kaukonen JA, Nupponen NN, Chalmers RM, Oldfors A, Rautakorpi I, Peltonen L, Majamaa K. Parkinsonism, premature menopause, and mitochondrial DNA polymerase gamma mutations: clinical and molecular genetic study. Lancet. 2004;364:875-882. [PubMed] [DOI] |
| 36. | Moslemi AR, Melberg A, Holme E, Oldfors A. Autosomal dominant progressive external ophthalmoplegia: distribution of multiple mitochondrial DNA deletions. Neurology. 1999;53:79-84. [PubMed] [DOI] |
| 37. | Ponamarev MV, Longley MJ, Nguyen D, Kunkel TA, Copeland WC. Active site mutation in DNA polymerase gamma associated with progressive external ophthalmoplegia causes error-prone DNA synthesis. J Biol Chem. 2002;277:15225-15228. [PubMed] [DOI] |
| 38. | Lewis W, Simpson JF, Meyer RR. Cardiac mitochondrial DNA polymerase-gamma is inhibited competitively and noncompetitively by phosphorylated zidovudine. Circ Res. 1994;74:344-348. [PubMed] [DOI] |
| 39. | Feng JY, Murakami E, Zorca SM, Johnson AA, Johnson KA, Schinazi RF, Furman PA, Anderson KS. Relationship between antiviral activity and host toxicity: comparison of the incorporation efficiencies of 2',3'-dideoxy-5-fluoro-3'-thiacytidine-triphosphate analogs by human immunodeficiency virus type 1 reverse transcriptase and human mitochondrial DNA polymerase. Antimicrob Agents Chemother. 2004;48:1300-1306. [PubMed] [DOI] |
| 40. | Birkus G, Hitchcock MJ, Cihlar T. Assessment of mitochondrial toxicity in human cells treated with tenofovir: comparison with other nucleoside reverse transcriptase inhibitors. Antimicrob Agents Chemother. 2002;46:716-723. [PubMed] [DOI] |
| 41. | Moyle G. Toxicity of antiretroviral nucleoside and nucleotide analogues: is mitochondrial toxicity the only mechanism? Drug Saf. 2000;23:467-481. [PubMed] [DOI] |
| 42. | White AJ. Mitochondrial toxicity and HIV therapy. Sex Transm Infect. 2001;77:158-173. [PubMed] [DOI] |
| 43. | Foli A, Benvenuto F, Piccinini G, Bareggi A, Cossarizza A, Lisziewicz J, Lori F. Direct analysis of mitochondrial toxicity of antiretroviral drugs. AIDS. 2001;15:1687-1694. [PubMed] [DOI] |
| 44. | Cossarizza A, Pinti M, Moretti L, Bricalli D, Bianchi R, Troiano L, Fernandez MG, Balli F, Brambilla P, Mussini C. Mitochondrial functionality and mitochondrial DNA content in lymphocytes of vertically infected human immunodeficiency virus-positive children with highly active antiretroviral therapy-related lipodystrophy. J Infect Dis. 2002;185:299-305. [PubMed] [DOI] |
| 45. | McComsey G, Tan DJ, Lederman M, Wilson E, Wong LJ. Analysis of the mitochondrial DNA genome in the peripheral blood leukocytes of HIV-infected patients with or without lipoatrophy. AIDS. 2002;16:513-518. [PubMed] [DOI] |
| 46. | Walker UA, Setzer B, Venhoff N. Increased long-term mitochondrial toxicity in combinations of nucleoside analogue reverse-transcriptase inhibitors. AIDS. 2002;16:2165-2173. [PubMed] [DOI] |
| 47. | Walker UA, Bickel M, Lütke Volksbeck SI, Ketelsen UP, Schöfer H, Setzer B, Venhoff N, Rickerts V, Staszewski S. Evidence of nucleoside analogue reverse transcriptase inhibitor--associated genetic and structural defects of mitochondria in adipose tissue of HIV-infected patients. J Acquir Immune Defic Syndr. 2002;29:117-121. [PubMed] [DOI] |
| 48. | Miró O, López S, Pedrol E, Rodríguez-Santiago B, Martínez E, Soler A, Milinkovic A, Casademont J, Nunes V, Gatell JM. Mitochondrial DNA depletion and respiratory chain enzyme deficiencies are present in peripheral blood mononuclear cells of HIV-infected patients with HAART-related lipodystrophy. Antivir Ther. 2003;8:333-338. [PubMed] |
| 49. | López S, Miró O, Martínez E, Pedrol E, Rodríguez-Santiago B, Milinkovic A, Soler A, García-Viejo MA, Nunes V, Casademont J. Mitochondrial effects of antiretroviral therapies in asymptomatic patients. Antivir Ther. 2004;9:47-55. [PubMed] |
| 50. | Côté HC, Brumme ZL, Craib KJ, Alexander CS, Wynhoven B, Ting L, Wong H, Harris M, Harrigan PR, O'Shaughnessy MV. Changes in mitochondrial DNA as a marker of nucleoside toxicity in HIV-infected patients. N Engl J Med. 2002;346:811-820. [PubMed] [DOI] |