修回日期: 2007-11-02
接受日期: 2007-11-11
在线出版日期: 2007-12-18
目的: 检测幽门螺杆菌(H pylori)标准菌株NCTC11637及临床菌株外膜蛋白的三种基因(OipA、HopX、HopW)及比较NCTC11637中三种基因与国际标准菌株(26695和J99)的同源性, 为H pylori疫苗的筛选提供实验依据.
方法: 运用PCR方法检测标准菌株NCTC 11637及27例临床菌株中的三种基因, 并对其进行测序. 运用GenBank比较与国际标准菌株(26695和J99)的同源性.
结果: 在标准菌株NCTC11637中检测到三种基因. 在27例临床菌株中, 有10例检测到OipA基因. 在23例中检测到HopX基因, 在27例中均检测到HopW基因. NCTC11637中OipA基因与26695和J99的核苷酸序列同源性分别为95.38%、94.60%, 均低于两株国际标准菌株的同源性95.50%. HopX基因的同源性分别为94.90%和95.15%, 同样低于两株国际标准菌株的同源性96.49%. HopW基因与26695和J99的同源性分别为97.38%、94.90%, 两株标准菌株的同源性为95.20%.
结论: 在标准菌株NCTC11637和临床菌株中检测到三种基因. H pylori HopW基因核苷酸序列具有一定的保守性.
引文著录: 王华, 邵世和. 幽门螺杆菌OipA、HopX、HopW基因的检测及序列分析. 世界华人消化杂志 2007; 15(35): 3710-3714
Revised: November 2, 2007
Accepted: November 11, 2007
Published online: December 18, 2007
AIM: To detect three genes of Helicobacter pylori (H pylori) outer membrane proteins in NCTC11637 and clinical strains, and to make a homologous comparison of the nucleotides in strains 26695 and J99.
METHODS: The three genes were detected with PCR in H pylori strains NCTC11637 and 27. The PCR products were sent for nucleotide sequence analysis, and compared with those in strains 26695 and J99 using GenBank.
RESULTS: The sequences of the genes of interest were obtained in strain NCTC11637. Among 27 clinical samples, OipA and HopX genes were detected in 10 and 23 H pylori strains, respectively. Only the HopW gene was obtained in 27 H pylori strains. Moreover, in NCTC11637, the homology of the OipA gene between NCTC11637 and 26695, and J99 in nucleotide acid was 95.38% and 94.60%, respectively, which was lower than the homology between 26695 and J99, at 95.50%. The homology of the HopX gene between NCTC11637 and 26695, and J99 in nucleotide acid was 94.90% and 95.15%, respectively, which was lower than the homology between 26695 and J99, at 96.49%. The homology of the HopW gene between NCTC11637 and 26695, and J99 in nucleotide acid was 97.38% and 94.90%, respectively. The homology between 26695 and J99 was 95.20%.
CONCLUSION: The gene sequences can be obtained in NCTC11637 and clinical strains. The HopW gene sequence is conservative.
- Citation: Wang H, Shao SH. Detection and analysis of OipA, HopX and HopW of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3710-3714
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3710.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3710
幽门螺杆菌(H pylori)的全基因组序列显示, 在其95个平行基因家族中存在着一个庞大的外膜蛋白(H pylori outer membrane protein, Hop)家族, 编码黏附素样蛋白、前炎症蛋白、微孔蛋白等[1-2]. 他们在诊断、保护性免疫和致病性等方面的意义已逐渐引起国内外学者们的关注. 前炎症蛋白(outer inflammatory protein, OipA)作为H pylori的外膜蛋白之一, 其重要性日益受到关注. 有研究表明其在H pylori感染致病上的重要性甚至超越传统认识上的CagA[3]. 而对于HopX和HopW, Peck et al[4]用其重组体免疫小鼠, 结果得到血清中的抗体是特异的. 目前对于他们的功能和致病性还不是很清楚. 国内外关于OipA、HopW和HopX基因的研究文献报道很少. 本研究运用PCR方法, 对标准菌株NCTC11637和临床菌株三种基因进行检测、测序并对其编码基因与国际标准菌株26695与J99进行同源性比较分析, 以探索研制H pylori疫苗的新途径.
菌种NCTC11637购自中国预防科学院流行病学研究所, 哥伦比亚培养基、厌氧袋购自Oxoid公司, Taq酶、dNTP、marker(DL2000、DL15000)购自TaKaRa公司, marker(DL200)购自Gereray公司, PCR基因扩增仪(Mastercycler Gracent, Eppendor公司), 自动凝胶成像系统(美国UVP公司). 其他常规试剂按照《分子克隆实验指南》要求配置.
NCTC11637标准菌株按常规微需氧方法培养. 临床菌株分离培养: 将尿素酶试验阳性的胃溃疡和十二指肠溃疡患者的胃黏膜活检组织直接涂布于哥伦比亚培养基上, 置37℃微需氧培养, 96 h后挑取可疑菌落进行革兰染色及生化反应鉴定. H pylori鉴定标准: 革兰染色阴性的S形、弧形、海鸥形细菌, 其尿素酶、氧化酶、触酶试验为阳性. 按照《分子克隆实验指南》提取基因组H pylori染色体DNA, -20℃保存备用. 根据GenBank中已报道的H pylori 26695的OipA和HopX、HopW基因的序列设计引物, 由上海博亚公司合成. 其序列及其反应条件(表1, 表2). PCR产物经14 g/L琼脂糖凝胶电泳分析鉴定, 用标准菌株NCTC11637的反应体系及反应条件检测临床菌株中的OipA、HopX及HopW基因. 将NCTC11637的OipA、HopX及HopW PCR产物送往TaKaRa公司进行核苷酸序列测定, 其测序结果通过GenBank与H pylori国际标准菌株26695与J99相对应的基因进行核苷酸序列比对.
| 基因 | 引物序列 |
| OipA | 5'-CCGGATCCATGAAAAAAGCTCTCTTACT-3' |
| 5'-CGCGGCTCGAGTTAATGTTTGTTTTTAAAGTT-3' | |
| HopX | 5'-AAAAGGATCCGAAGACGATGGCTTTTATATGGGA-3' |
| 5'-AAAACTCGAGTTAAAAACCTATCGTGTAGTTGAT-3' | |
| HopW | 5'-AAAAAAGGTACCCATGAAAAGAATGGCGCGTTTGTG-3' |
| 5'-AAAAAAAAGCTTTTATCAAAAAGTATAAACATAGCGCAA-3' |
| Gene | 反应体系 | 反应条件 |
| OipA | 50 μL反应体系(10×buffer 5 μL、dNTP 4 μL、DNA模板2 μL、浓度为10 μmol/L的引物各1 μL、2 min、72℃ 55 s, 72℃ 7 min Taq聚合酶0.25 μL、ddH2O 36 μL | 94℃ 4 min, 94℃ 2 min、51.7℃ 2 min、72℃ 55 s, 72℃ 7 min(2-4, 40个循环) |
| HopX | 50 μL反应体系(10×buffer 5 μL、dNTP 4 μL、DNA模板2 μL、浓度为10 μmol/L的引物各1.2 μL、Taq聚合酶0.4 μL、ddH2O 36 μL | 3 min, 94℃ 30 s、56℃ 30 s、72℃ 1 min, 72℃ 7 min(2-4, 30个循环) |
| HopW | 50 μL反应体系(10×buffer 5 μL、dNTP 4 μL、DNA模板2 μL、浓度为10 μmol/L的引物各1.2 μL、Taq聚合酶0.4 μL、ddH2O 36 μL | 3 min, 94℃ 30 s、56℃ 30 s、72℃ 1 min, 72℃ 7 min(2-4, 30个循环) |
培养96 h的NCTC11637、H pylori1和H pylori2革兰染色后, 油镜下可见海鸥状、弧形、S形的革兰阴性菌(图1).
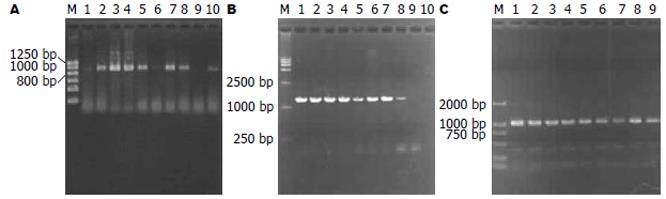
根据三种基因(OipA、HopX及HopW)的PCR反应条件及反应体系, 以标准菌株和临床菌株DNA为模板, 扩增反应片段. 反应结束后, 用14 g/L的琼脂糖凝胶电泳鉴定, 可见反应条带分别在800-1000 bp之间(大约在900 bp左右)和1000-2000 bp之间(大约在1200 bp左右). 在1000 bp 左右, 为目的条带(图2).
取100例胃黏膜标本, 检测并培养出H pylori阳性的标本27例. 提取基因组DNA, 按上述条件、方案, 检测临床菌株OipA、HopX及HopW基因. 可见12例十二指肠溃疡中4株检测出OipA基因, 7例胃溃疡中检测出6株, 而在胃炎和胃癌病例中均未检测到OipA基因. 对于HopX基因, 在27例中只有4例阴性, 其中3例来源于十二指肠溃疡, 1例是胃炎. 只有HopW基因在27例中均检测到. NCTC11637 PCR(OipA、HopX及HopW基因)测序结果分别与标准菌株26695, J99相应的基因序列进行同源性比较, 结果为NCTC11637中OipA基因与两株国际标准菌株26695和J99的核苷酸序列同源性分别为95.38%、94.60%, 26695和J99为95.50%. HopX基因的同源性分别为94.90%和95.15%, 26695和J99为96.49%, HopW基因与26695和J99的同源性分别为97.38%、94.90%, 26695和J99为95.20%.
H pylori自1994年被国际癌症研究机构定为Ⅰ类致癌原后受到国内外学者的普遍重视[5]. 以往对H pylori的研究多集中在尿素酶和细胞相关毒素、空泡毒素等方面. 然而, H pylori的全基因组序列显示, 在其95个平行基因家族中存在着一个庞大的外膜蛋白家族, 如黏附素样蛋白和前炎症蛋白、微孔蛋白等.
OipA是一种编码相对分子量为34 kDa的幽门螺杆菌外膜蛋白基因, 又称HopH, 基因位置HP0638, 编码产物称前炎症蛋白OipA. 早在1998年, Yamaoka et al[6]就发现分子量界于33-35 kDa的外膜蛋白与IL-8的水平呈正相关, 而这种相关性是与其他抗原包括CagA在内都无关. 在2000年, Yamaoka做了进一步的研究, 发现HP0638突变株诱导IL-8的量明显减少可达50%, 因此将HP0638基因定名为OipA[7]. 还有学者发现HP0638的状态与CagA、vacA、iceA的基因型密切相关[8]. 同时Yamaoka et al[9]发现OipA的状态是唯一能够将十二指肠溃疡从胃炎中区分出来的指标. 功能性的OipA与H pylori的密度、中性粒细胞浸润的严重程度以及胃黏膜高水平的IL-8密切相关. 我国学者陈道荣 et al对OipA基因进行了克隆和序列分析[10].
微孔蛋白为细菌外膜蛋白的一种. 其功能主要是组成亲水样通道, 有选择地允许一些营养物质和小分子通过, 阻止大分子物质和青霉素、溶菌酶等进入细胞[11], 并且是离子进出外膜的主要通路. 此外, 还具有抗原性和致病性. 根据微孔蛋白的理化性质, 组成形式和所处环境的不同, 可以以三聚体或单体形式存在[12]. 三聚体结合牢固, 仅在特殊条件下(如加入SDS前加热至70℃以上)才被裂解. 微孔蛋白的另一个显著特点是他在细菌外膜的高表达, 有些细菌的每个细胞可达104-106拷贝[7]. 这些特点使微孔蛋白具有高度特异性和可变性, 发挥着多种生物学功能. 他与宿主细胞的凋亡, 信号传导及细菌致病性方面都有一定的关系.
微孔蛋白可为特异性和非特异性2个类型. 非特异性的微孔蛋白具有较宽的孔道, 而特异性的微孔蛋白有特异性的底面结合位点, 其传导力只是非特异性的十分之一. H pylori中非特异性的微孔蛋白HopE[1]、HopV和HopX孔道的传导力分别为1.5、1.4和3.0 ns, 而特异性的微孔蛋白HopA、HopB、HopC和HopD的传导力分别为0.36、0.36、0.32和0.24[13]. 虽然目前关于HopW和HopX的功能还不是很清楚, 但与H pylori其他基因不同的是在HopW和HopX的启动区域没有核苷酸结构的重复及G、C含量的聚集[1,14]. 因此, 在H pylori感染的各个阶段均有其蛋白产物的表达. 此外, Peck et al[4]用HopW和HopX的重组体免疫小鼠, 结果得到血清中的抗体是特异的, 没有其他的外膜蛋白抗体, 说明这个保守序列不包含其他的抗原决定簇. 而且, 在免疫荧光实验的检测中, 增加HopW的孵育时间产生了明显的信号.
疫苗抗原编码基因的保守性是决定抗原免疫保护率的重要因素. 但目前对多数H pylori基因的研究结果表明, H pylori不同菌株间基因变异非常大. 因此, 掌握多种H pylori不同分离株中同一基因的同源关系, 能够为疫苗抗原的基因筛选提供重要依据.
本实验运用PCR方法在标准菌株NCTC 11637中检测到三种基因. 在27例临床菌株中, 有10例检测到OipA基因, 在23例中检测到HopX基因, 而HopW基因在27例中均被检测到. 标准菌株NCTC11637中OipA基因与两株国际标准菌株26695和J99的核苷酸序列同源性分别为95.38%、94.60%, 均低于两株国际标准菌株的同源性95.50%. 而HopX基因的同源性分别为94.90%和95.15%, 同样低于两株国际标准菌株的同源性96.49%. 与前两个基因不同的是, HopW基因与26695和J99的同源性分别为97.38%、94.90%, 两株标准菌株的同源性为95.20%. 在这三种基因中HopW的核苷酸序列同源性高, 而且在27株临床菌株中均检测到了HopW基因. 上述结果表明, 标准菌株NCTC11637带有三种基因(OipA、HopX及HopW), 但不同菌株的三种基因序列有所不同, 且不同胃部疾病检测到的三种基因的比例各不相同. 其中, HopW基因核苷酸序列的同源性最高, 并且在27例临床菌株中均检测到. HopW能否作为疫苗的候选抗原, 其核酸的突变点是否引起氨基酸变化, 是否对其抗原性有影响以及他的免疫源性如何还有待进一步研究.
幽门螺杆菌(H pylori)是定植于胃黏膜表面的革兰阴性、生长缓慢的螺旋状微需氧菌. 目前已证实, H pylori感染是慢性胃炎、消化性溃疡发生的主要病因, 并与胃癌, MALT淋巴瘤的发生密切相关. 近年来, 我国人群感染率呈上升趋势, 达到60%以上. 因此, H pylori致病机制的研究及其感染的合理治疗和预防成为关注的热点.
本文运用PCR方法, 对标准菌株NCTC11637和临床菌株3种基因进行检测, 测序并对其编码基因与国际标准菌株26695与J99进行同源性比较分析, 探索研制H pylori疫苗的新途径.
本文为H pylori致病机制的探讨和疫苗的研发提供了依据.
本文选题新颖, 具有一定的创新性, 结果真实可靠, 符合逻辑.
编辑: 程剑侠 电编: 何基才
| 1. | Tomb JF, White O, Kerlavage AR, Clayton RA, Sutton GG, Fleischmann RD, Ketchum KA, Klenk HP, Gill S, Dougherty BA. The complete genome sequence of the gastric pathogen Helicobacter pylori. Nature. 1997;388:539-547. [PubMed] [DOI] |
| 2. | Alm RA, Bina J, Andrews BM, Doig P, Hancock RE, Trust TJ. Comparative genomics of Helicobacter pylori: analysis of the outer membrane protein families. Infect Immun. 2000;68:4155-4168. [PubMed] [DOI] |
| 3. | Graham DY, Opekun AR, Osato MS, El-Zimaity HM, Lee CK, Yamaoka Y, Qureshi WA, Cadoz M, Monath TP. Challenge model for Helicobacter pylori infection in human volunteers. Gut. 2004;53:1235-1243. [PubMed] [DOI] |
| 4. | Peck B, Ortkamp M, Nau U, Niederweis M, Hundt E, Knapp B. Characterization of four members of a multigene family encoding outer membrane proteins of Helicobacter pylori and their potential for vaccination. Microbes Infect. 2001;3:171-179. [PubMed] [DOI] |
| 5. | NIH Consensus Conference. Helicobacter pylori in peptic ulcer disease. NIH Consensus Development Panel on Helicobacter pylori in Peptic Ulcer Disease. JAMA. 1994;272:65-69. [PubMed] [DOI] |
| 6. | Yamaoka Y, Kodama T, Graham DY, Kashima K. Search for putative virulence factors of Helicobacter pylori: the low-molecular-weight (33-35 K) antigen. Dig Dis Sci. 1998;43:1482-1487. [PubMed] [DOI] |
| 7. | Yamaoka Y, Kwon DH, Graham DY. A M(r) 34,000 proinflammatory outer membrane protein (oipA) of Helicobacter pylori. Proc Natl Acad Sci U S A. 2000;97:7533-7538. [PubMed] [DOI] |
| 8. | Ando T, Peek RM, Pride D, Levine SM, Takata T, Lee YC, Kusugami K, van der Ende A, Kuipers EJ, Kusters JG. Polymorphisms of Helicobacter pylori HP0638 reflect geographic origin and correlate with cagA status. J Clin Microbiol. 2002;40:239-246. [PubMed] [DOI] |
| 9. | Yamaoka Y, Kikuchi S, el-Zimaity HM, Gutierrez O, Osato MS, Graham DY. Importance of Helicobacter pylori oipA in clinical presentation, gastric inflammation, and mucosal interleukin 8 production. Gastroenterology. 2002;123:414-424. [PubMed] [DOI] |
| 10. | Chen DR, Huang AL, Tao XH, Wang PL, Jiang Z. Cloning and sequence analysis of gene oipA encoding an outer membrane protein of human Helicobacter pylori. World J Gastroenterol. 2004;10:3205-3207. [PubMed] [DOI] |
| 12. | Koebnik R, Locher KP, Van Gelder P. Structure and function of bacterial outer membrane proteins: barrels in a nutshell. Mol Microbiol. 2000;37:239-253. [PubMed] [DOI] |
| 13. | Exner MM, Doig P, Trust TJ, Hancock RE. Isolation and characterization of a family of porin proteins from Helicobacter pylori. Infect Immun. 1995;63:1567-1572. [PubMed] |
| 14. | Haas R, Meyer TF. Vaccine development against Helicobacter pylori infections. Biologicals. 1997;25:175-177. [PubMed] [DOI] |