修回日期: 2007-11-05
接受日期: 2007-12-05
在线出版日期: 2007-12-18
目的: 建立非酒精性脂肪肝和非酒精性脂肪性肝炎离体细胞模型.
方法: 以正常人肝细胞株HL-7702为实验对象, 采用临床常用静脉营养药物脂肪乳剂加入细胞培养液培养肝细胞建立脂肪肝细胞模型, 并在此基础上传代培养, 建立非酒精性脂肪性肝炎模型. 以细胞内脂滴数量、甘油三酯含量和细胞培养液细胞转氨酶泄漏量等指标, 评价该离体细胞模型与实验动物模型的相似性及其实际应用意义.
结果: 用含20%脂肪乳剂1.0 mL/L的培养液培养肝细胞48 h即可使肝细胞产生明显甘油三酯堆积. 传代培养两代发现肝细胞损伤, 产生炎症性损伤.
结论: 利用脂肪乳剂可以在短时间内建立非酒精性脂肪肝和非酒精性脂肪性肝炎细胞模型.
引文著录: 王炳芳, 朱韶杰, 田培营. 脂肪肝细胞模型的建立及其生物学特性. 世界华人消化杂志 2007; 15(35): 3674-3677
Revised: November 5, 2007
Accepted: December 5, 2007
Published online: December 18, 2007
AIM: To establish non-alcoholic fatty liver and non-alcoholic steatohepatitis models at a cellular level.
METHODS: Liver cells HL-7702 were cultured with RPMI-1640 medium containing long chain fat emulsion, which is a nutritional emulsion used in the clinic. Cells were subcultured for two generations to obtain non-alcoholic steatohepatitis models. The similarities between the cellular and animal models were evaluated, especially the utility of the cellular model.
RESULTS: After 48 hours in culture, the TG content in HL-7702 cells cultured in RPMI-1640 medium containing long chain fat emulsion increased remarkably, while there were few variations in biochemical indices such as ALT. When these cells were subcultured for two generations, they showed inflammatory injury.
CONCLUSION: Cellular models of non-alcoholic fatty liver and non-alcoholic steatohepatitis in vivo can be generated in a short time by mixing medium with long chain fat emulsion.
- Citation: Wang BF, Zhu SJ, Tian PY. Establishment of a cellular model of non-alcoholic fatty liver and its biological characteristics. Shijie Huaren Xiaohua Zazhi 2007; 15(35): 3674-3677
- URL: https://www.wjgnet.com/1009-3079/full/v15/i35/3674.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i35.3674
随着人们生活水平提高, 非酒精性脂肪肝(non-alcoholic fatty liver, NAFL)[1]及非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)[2,11]发病率呈现逐年升高趋势. NAFL是肝损伤的初期表现, 其后可能会继发NASH、肝纤维化和肝硬化, 成为隐源性肝硬化发生的重要因素之一[3,12]. NAFL还是代谢综合征表现之一[4,25], 常伴有中心性肥胖、胰岛素抵抗、糖耐量异常、血脂代谢异常等, 严重影响人们的生活质量[10,13-14]. 建立NAFLD和NASH体外细胞模型对研究NAFL和NASH的发病机制及防治具有重要的理论意义与广泛的实用价值.
人正常肝细胞株HL-7702购自中科院细胞研究所细胞库, RMPI-1640培养基和血清购自上海实生生物公司, 中长链脂肪乳注射液购自广州乔光制药公司, 油酸(细胞培养用)购自Sigma公司, 油红O购自上海博光试剂公司, 丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、甘油三酯(TG)试剂盒购自南京建成公司.
人正常肝细胞株HL-7702, 用含100 mL/L小牛血清、青链霉素各10万U/L的1640培养基传代培养. 肝细胞培养于12孔板, 一孔用正常培养液培养做对照, 其余各孔用含不同浓度脂肪乳剂(中长链脂肪乳剂注射液)的培养液培养48 h后, 油红O染色[5], 测定培养液中ALT、AST值并用台盼兰染色确定细胞活力[5]. 选取导致肝细胞活力与正常培养时无明显差异, 肝细胞内脂滴大而明显, 转氨酶升高不明显且浓度最低作为诱导细胞成为脂肪肝细胞的最佳浓度.
1.2.1 脂肪肝细胞离体细胞模型的建立: 将离体培养的肝细胞分为空白对照组和实验组. 空白对照组: 用正常1640培养基培养. 实验组按照每毫升正常培养基中加入20%脂肪乳剂浓度不同分3组: 0.5 mL/L组, 1.0 mL/L组, 2.0 mL/L组. 采用上述条件, 分两部分进行实验. 第一部分各组在细胞相同条件下, 种入6孔板细胞爬片培养3 d, 油红O染色观察脂滴数量, 收集培养液测定ALT和AST的变化确定有无肝细胞损伤. 第二部分各组在细胞相同条件下, 每组分别种入3个培养瓶中培养, 第3天, 将细胞冻融, 收集细胞冻溶液测定其中TG的含量[6].
1.2.2 NASH细胞离体模型建立: 在上述加脂肪乳剂建立脂肪肝细胞模型基础上, 进一步用脂肪乳剂传代培养法, 建立NASH细胞离体模型. 分为两组, 即对照组(脂肪肝细胞模型组+不含脂肪乳剂的培养基)和实验组(脂肪肝细胞模型组+含脂肪乳剂的培养基). 脂肪乳剂剂量根据2.3实验后的结果而定. 传代培养两代后, 观察细胞形态变化, 并且收集细胞培养液, 测定ALT和AST变化.
1.2.3 生化检测: 冻溶液中TG、ALT和AST的检验严格按试剂盒规范操作.
统计学处理 实验结果以mean±SD表示, 采用SPSS10.0软件包进行方差分析及多重比较.
实验结果表明, 用含10 mL/L及其以下浓度脂肪乳剂(20%)的培养液培养正常肝细胞, 其活力均无下降, 不影响细胞分裂生长且表现出一定的促进作用. 培养液中转氨酶亦无升高, 油红O染色自0.5 mL/L始见较多红色脂滴. 10 mL/L以上浓度会因脂肪乳剂过多, 培养液变得不透明, 显微镜下难以观察. 且以选择最低浓度为肝细胞脂肪变性最佳浓度为原则, 故选择0.5 mL/L、1.0 mL/L和2.0 mL/L作为致肝细胞脂肪变性最佳浓度.
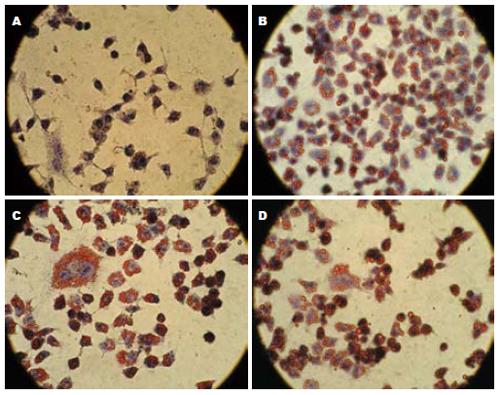
2.2.1 光镜下形态学观察及油红O染色结果: 对照组: 细胞边缘清晰, 呈多角形排列呈铺路石样, 细胞间结合紧密, 无缝隙. 油红O染色示细胞边缘清晰, 核大, 细胞内少见红色脂滴. 光镜下观察同对照组. 油红O染色示大部分细胞内开始出现红色脂滴, 数量较少位于细胞膜内侧. 0.5 mL/L组: 细胞边缘清晰, 大部分多角形, 有些细胞变圆, 细胞间结合欠紧密. 油红O染色示细胞内红色脂滴较多, 部分细胞内脂滴成环状位于细胞膜内侧, 可见较大的脂滴. 1.0 mL/L组: 细胞较多变圆, 棱角不清, 细胞间结合不紧密. 油红O染色示细胞内较大脂滴, 偶见较多脂滴将细胞核挤向一侧, 呈印戒样改变. 2.0 mL/L组: 光镜下观察及染色基本同1.0 mL/L组, 脂滴更大脂肪堆积更明显(图1).
2.2.2 脂肪乳剂对肝细胞生化指标和细胞内甘油三酯含量的影响: 自培养液中脂肪乳剂浓度0.5 mL/L始, 细胞内TG含量明显增加. 经统计学处理, 各实验组与对照组比较皆有显著性差异. 转氨酶无显著变化, 肝细胞活力无明显下降, 符合脂肪肝患者和动物NAFL模型特征(表1).
从实验结果分析可知, 根据非酒精性脂肪肝的发病机制[7]中脂肪进入细胞增加, 用脂肪乳剂加入培养液中培养肝细胞, 短期内能够使肝细胞脂质代谢紊乱、累积大量TG, 形成脂肪肝体外模型. 这种细胞水平的实验性脂肪肝具有基本一致的病理现象, 如细胞内出现大量脂滴, 形成印戒样细胞而无转氨酶升高等炎症性损伤变化[8,17,20]. 因此我们认为, 通过本实验方法, 能够建立有效的非酒精性脂肪肝细胞模型, 作为与动物模型相互补充的手段, 共同用于该疾病发病机制的研究, 以及治疗方法和药物的筛选和药效学研究.
目前, 对于脂肪肝的研究多见酒精性肝炎和NASH的动物模型[9,16], 存在个体差异较大, 实验条件不易控制, 整体影响因素众多等不利因素. 建立细胞模型, 能克服个体差异的影响, 更好的控制实验条件, 能针对性地研究非酒精性脂肪肝发病机制且能有效的选择治疗方法并缩短筛选治疗药物的进程. 所查文献资料未见应用脂肪乳剂建立非酒精性脂肪肝和NASH的体外模型报道. 本文采用临床上常用静脉营养药物脂肪乳剂作用于离体培养的肝细胞[26], 造成肝细胞脂肪代谢紊乱. 模拟NAFL发病过程, 结合NAFL和NASH的常规检测指标, 即TG含量、脂滴数量以及ALT、AST量, 验证该细胞模型和实验动物模型可比性, 为NAFL乃至代谢综合征的发病机制、药物研究提供一条有效可行的新途径[21,23].
实验还发现, 对用含有脂肪乳剂变性后的肝细胞进行传代培养, 细胞活力下降, 生长变慢, 培养后培养液中转氨酶升高, 且各组细胞内累积的TG含量比传代之前显著增高. 结果显示用含脂肪乳剂培养液传代培养肝细胞, 累积损伤肝细胞可导致肝细胞炎症性损伤及细胞活力下降. 根据NASH的"二次打击学说"[1,7,18-19], 可在脂肪肝细胞模型建立的基础上, 加入游离脂肪酸或者其他可导致细胞内氧自由基增多的药物诱导肝细胞进一步损伤. 模拟体内过氧化物增多的二次打击导致的NASH的发病过程[22-24], 建立NASH离体细胞模型, 从而为NASH的发病机制、药物研究提供一条有效可行的新途径, 有望为进一步降低隐源性肝硬化发病率找到好的方法.
非酒精性脂肪性肝病(NAFLD)是一种肝组织病理学改变与酒精性肝病类似但无过量饮酒史的临床综合征. 其疾病谱包括单纯性脂肪肝, 非酒精性脂肪性肝炎, 脂肪性肝纤维化3种主要类型. 随着社会经济发展, NAFLD患病率迅速增长,已经成为危害人类健康的三大肝病之一, 与Ⅱ型糖尿病, 中心性肥胖, 高脂血症等代谢综合征密切相关. 因此积极治疗NAFLD具有深刻的社会和经济意义, 也是当今研究的热点.
目前对于脂肪肝的研究多见酒精性肝炎和非酒精性脂肪性肝炎的的动物模型, 存在个体差异较大, 实验条件不易控制等不利因素. 脂肪肝研究的细胞模型尚未见成熟的报道, 这可能与加入干扰因素后细胞的生长传代难以继续下去有关.
1 本文建立细胞模型, 能克服个体差异的影响, 更好的控制实验条件, 能针对性地研究非酒精性脂肪肝发病机制.
2 本文采用静脉营养药物脂肪乳剂作用于离体培养的肝细胞, 造成肝细胞脂肪代谢紊乱, 模拟非酒精性脂肪肝发病过程.
通过本文所述的方法建立起非酒精性脂肪肝的细胞模型, 为非酒精性脂肪肝乃至代谢综合征的发病机制和药物研究提供一条有效可行的新途径.
本文研究内容新颖, 具有一定的理论意义和可读性.
编辑: 程剑侠 电编: 郭海丽
| 2. | Bahrami H, Daryani NE, Mirmomen S, Kamangar F, Haghpanah B, Djalili M. Clinical and histological features of nonalcoholic steatohepatitis in Iranian patients. BMC Gastroenterol. 2003;3:27. [PubMed] [DOI] |
| 3. | Shimada M, Hashimoto E, Kaneda H, Noguchi S, Hayashi N. Nonalcoholic steatohepatitis: risk factors for liver fibrosis. Hepatol Res. 2002;24:429-438. [PubMed] [DOI] |
| 4. | Reaven G, Abbasi F, McLaughlin T. Obesity, insulin resistance, and cardiovascular disease. Recent Prog Horm Res. 2004;59:207-223. [PubMed] [DOI] |
| 10. | Abdelmalek MF, Diehl AM. Nonalcoholic fatty liver disease as a complication of insulin resistance. Med Clin North Am. 2007;91:1125-1149, ix. [PubMed] [DOI] |
| 11. | Yeh MM, Brunt EM. Pathology of nonalcoholic fatty liver disease. Am J Clin Pathol. 2007;128:837-847. [PubMed] [DOI] |
| 12. | Yoneda M, Endo H, Nozaki Y, Tomimoto A, Fujisawa T, Fujita K, Yoneda K, Takahashi H, Saito S, Iwasaki T. Life style-related diseases of the digestive system: gene expression in nonalcoholic steatohepatitis patients and treatment strategies. J Pharmacol Sci. 2007;105:151-156. [PubMed] [DOI] |
| 13. | Chow WC, Tai ES, Lian SC, Tan CK, Sng I, Ng HS. Significant non-alcoholic fatty liver disease is found in non-diabetic, pre-obese Chinese in Singapore. Singapore Med J. 2007;48:752-757. [PubMed] |
| 14. | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, Romanelli AJ, Shulman GI. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004;279:32345-32353. [PubMed] [DOI] |
| 15. | Canbay A, Gieseler RK, Gores GJ, Gerken G. The relationship between apoptosis and non-alcoholic fatty liver disease: an evolutionary cornerstone turned pathogenic. Z Gastroenterol. 2005;43:211-217. [PubMed] [DOI] |
| 16. | Otogawa K, Kawada N. [Rabbit model for the study of human NASH]. Nihon Rinsho. 2006;64:1043-1047. [PubMed] |
| 17. | Xu P, Zhang XG, Li YM, Yu CH, Xu L, Xu GY. Research on the protection effect of pioglitazone for non-alcoholic fatty liver disease (NAFLD) in rats. J Zhejiang Univ Sci B. 2006;7:627-633. [PubMed] [DOI] |
| 18. | Kawada N, Otogawa K. Role of oxidative stress and Kupffer cells in hepatic fibrosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S85-S86. [PubMed] [DOI] |
| 19. | Fan J, Zhong L, Wang G, Wu X, Li M, Jing D, Zhang P. The role of Kupffer cells in non-alcoholic steatohepatitis of rats chronically fed with high-fat diet. Zhonghua Gan Zang Bing Za Zhi. 2001;9:16-18. [PubMed] |
| 20. | Browning JD, Horton JD. Molecular mediators of hepatic steatosis and liver injury. J Clin Invest. 2004;114:147-152. [PubMed] [DOI] |
| 21. | Medina J, Fernández-Salazar LI, García-Buey L, Moreno-Otero R. Approach to the pathogenesis and treatment of nonalcoholic steatohepatitis. Diabetes Care. 2004;27:2057-2066. [PubMed] [DOI] |
| 22. | de Almeida IT, Cortez-Pinto H, Fidalgo G, Rodrigues D, Camilo ME. Plasma total and free fatty acids composition in human non-alcoholic steatohepatitis. Clin Nutr. 2002;21:219-223. [PubMed] [DOI] |
| 23. | Diraison F, Moulin P, Beylot M. Contribution of hepatic de novo lipogenesis and reesterification of plasma non esterified fatty acids to plasma triglyceride synthesis during non-alcoholic fatty liver disease. Diabetes Metab. 2003;29:478-485. [PubMed] [DOI] |
| 24. | Malhi H, Bronk SF, Werneburg NW, Gores GJ. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. J Biol Chem. 2006;281:12093-12101. [PubMed] [DOI] |
| 25. | Baou K, Vlachopoulos C, Manesis E, Archimandritis A, Stefanadis C. Non-alcoholic fatty liver and cardiovascular disease: an emerging relationship. Hellenic J Cardiol. 2007;48:37-41. [PubMed] |