修回日期: 2007-11-24
接受日期: 2007-11-28
在线出版日期: 2007-12-08
目的: 探讨肝转移性胃肠道间质瘤(GISTs)的临床病理、免疫组化特点.
方法: 复习文献, 分析15例肝转移性GISTs的临床表现、组织学及免疫组化特征.
结果: 本组15例肝转移性GISTs, 原发灶分别位于小肠(6例)、胃(5例)及网膜(2例), 余2例来源不明. 发现肝转移灶与原发肿瘤手术相距时间为0 d-86 mo(平均25 mo±9 mo). 肿瘤大小为1.5-30.0(平均7.1±1.2) cm. 6例伴有出血、坏死或囊性变. 组织学分型: 梭形细胞型11例, 上皮样细胞型2例, 混合型2例. 免疫组化结果: 肿瘤细胞弥漫表达CD117(86.7%)、CD34(46.7%), 灶性表达SMA(33.3%)、S-100(20%), Desmin均为阴性.
结论: 肝脏是GISTs最常见的转移部位, 原发部位多为小肠和胃. 其临床表现、组织形态及免疫组化表型与原发灶基本一致, 预后较差. CD117和CD34联合应用有助于鉴别诊断.
引文著录: 朱红波, 张秀辉, 廖殿英, 李俸媛. 肝转移性胃肠道间质瘤临床病理分析15例. 世界华人消化杂志 2007; 15(34): 3654-3659
Revised: November 24, 2007
Accepted: November 28, 2007
Published online: December 8, 2007
AIM: To study the clinicopathological and immunophenotypical features of hepatic metastatic gastrointestinal stromal tumors (GISTs).
METHODS: Clinical and pathological data of 15 patients with hepatic metastatic GISTs were analyzed, and the related literature was reviewed.
RESULTS: The tumors mainly originated from the small bowel (6/15) and stomach (5/15). The length of time after surgical treatment of the primary tumor to detection of a hepatic metastatic tumor was 0 d-86 mo (mean 25 mo ± 9 mo). Tumor size varied from 1.5 cm to 30.0 cm (mean 7.1 cm ± 1.2 cm). Cystification, hemorrhage or necrosis was observed in 6 tumors. Histologically, 11 were of the spindle cell type, 2 the epithelioid cell type and 2 mixture type. CD117 and CD34 showed diffuse expression, with a positive rate of 86.7% and 46.7%, respectively. Some cases were focally positive for SMA (33.3%) and S-100 (20%). Desmin was negative in all the 15 tumors.
CONCLUSION: The liver is the most metastatic site of GISTs. The most common primary sites of hepatic metastatic GISTs are the small bowel and stomach. Hepatic metastatic GISTs have similar clinical and pathological features as primary GISTs, and a poor prognosis. The combination of CD117 and CD34 is helpful for differential diagnosis.
- Citation: Zhu HB, Zhang XH, Liao DY, Li FY. Clinicopathological analysis of hepatic metastatic gastrointestinal stromal tumors: an analysis of 15 cases. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3654-3659
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3654.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3654
胃肠道间质瘤(gastrointestinal stromal tumors, GISTs)这一概念最早是由Mazur和Clark在1983年提出[1], 后又发现少数原发于腹腔软组织的胃肠道外间质瘤(extra-gastrointestina1 stromal tumors, EGISTs)[2]. 国内多于20世纪九十年代中后期才开始在临床实践中引入GISTs概念. 关于GISTs的临床病理研究集中于胃肠道原发灶, 转移性GISTs的研究仅限于个案报道. 肝脏是GISTs最常见的转移部位. 本文总结了15例肝转移性GISTs, 以探讨其临床病理特征.
收集华西医院病理科1995-01-01/ 2006-12-31诊断为GISTs病例共185例. 所有病例均参照GISTs目前公认的组织形态学特点并行免疫组化染色确诊, 其中肝转移性GISTs 15例.
对15例肝转移性GISTs患者的临床病理及随访资料进行回顾性分析. 肿瘤组织标本经40 g/L甲醛固定, 常规石蜡包埋切片(4 μm), HE染色, 并采用EnVision二步法进行免疫组化染色. 抗体选用CD117(c-KIT)、CD34、SMA、Desmin及S-100. CD117、CD34、SMA、Desmin及EnVision试剂盒购自丹麦DAKO公司, S-100购自北京中杉公司. 用已购阳性切片作阳性对照, PBS缓冲液代替一抗作阴性对照. 染色步骤和抗体稀释度均按产品说明书进行. 结果判定: 结构清晰, 着色明显强于背景, 在相应部位(CD117: 细胞膜, CD34: 细胞膜, SMA: 细胞质, S-100: 细胞核/质, Desmin: 细胞质)出现棕黄色颗粒者为阳性细胞; 不着色或显色强度与背景无差别者为阴性细胞. 每例切片随机选择5-10个高倍镜视野(×400), 统计阳性细胞数, 取平均值: 无着色或<10%为阴性(-), 10%-25%为弱阳性(+), 26%-50%为中等强度阳性(++), >50%为强阳性(+++).
统计学处理 应用SPSS13.0统计软件进行分析. 数据用mean±SD表示, 采用计数资料的χ2检验及Spearman等级相关分析, P<0.05有统计学意义.
185例GISTs中, 良性27例, 其余为交界性或恶性. 经手术切除行病理检查确诊转移的29例, 转移部位分别为: 肝脏15例, 网膜10例, 腹膜后4例, 腹壁皮下3例, 脾脏1例. 15例肝转移性GISTs中, 男9例, 女6例, 男女比为 1.5:1, 年龄35-73(平均56±3)岁, ≥50岁11例, 占73.3%. 多数病例表现为腹部疼痛或不适, 极少数患者无症状, 于体检、腹部其他手术或复查时偶被发现. 原发部位为小肠6例、胃5例、网膜2例, 另2例未发现明确原发灶. 6例为原发部位肿瘤与肝脏转移瘤同时诊断, 7例为原发部位肿瘤诊断后1 mo-86 mo发现肝脏转移. 原发部位肿瘤初次诊断为GISTs 9例、恶性外周神经鞘瘤(MPNSTs)2例、平滑肌瘤1例、平滑肌肉瘤1例. 本组有随访资料者6例(40%), 随访时间从3 mo-7年, 生存时间为术后0 d-65 mo(平均25±9 mo), 5年生存率为16.7%(1/6)(表1).
| 编号 | 性别 | 年龄(岁) | 临床表现 | 原发部位情况 | 随访结果 | ||
| 部位 | 初次诊断距 | 肝转移时间(mo) | |||||
| 1 | 男 | 66 | 腹膜包块术后复查, CT发现肝脏占位 | 网膜 | MPNSTs | 31 | 术后4 mo再发, 再次手术3 mo后死亡 |
| 2 | 男 | 73 | 腹膜包块术后复查, CT发现肝脏占位 | 网膜 | GISTs | 12 | 术后失访 |
| 3 | 女 | 69 | 右上腹不适15 d | 胃 | 平滑肌瘤 | 50 | 术后化疗12 mo后再发, 3 mo后死亡 |
| 4 | 男 | 62 | 右上腹不适7 d, CT发现肝脏占位 | 小肠 | MPNSTs | 86 | 术后失访 |
| 5 | 男 | 67 | 发现腹部包块1年 | 小肠 | GISTs | 0 | 术后失访 |
| 6 | 男 | 59 | 反复黑便2年, 加重1 mo | 小肠 | GISTs | 0 | 术后6 mo复发, 再次术后2 mo死亡 |
| 7 | 女 | 39 | 小肠间质瘤术后复查, CT发现肝脏占位 | 小肠 | GISTs | 1 | 术后失访 |
| 8 | 女 | 58 | 发现腹部包块8 mo | 不明 | 术后失访 | ||
| 9 | 男 | 67 | 小肠肿瘤术后复查, CT发现肝脏占位 | 小肠 | GISTs | 60 | 术后失访 |
| 10 | 女 | 38 | 体检发现肝脏占位 | 胃 | 平滑肌肉瘤 | 84 | 术后失访 |
| 11 | 男 | 35 | 体检发现肝脏占位 | 小肠 | GISTs | 0 | 术后2 d死亡 |
| 12 | 女 | 45 | 右上腹不适1 mo | 胃 | GISTs | 0 | 术后失访 |
| 13 | 男 | 55 | 右上腹不适10 d | 胃 | GISTs | 0 | 术后65 mo健在 |
| 14 | 男 | 55 | 右上腹不适6 mo, 加重1 mo | 胃 | GISTs | 0 | 术后失访 |
| 15 | 女 | 53 | 发现腹部包块1 mo | 不明 | 术中死亡 | ||
2.2.1 肉眼: 13例为多发, 2例为单发结节状肿物, 均为肝内浸润性生长. 直径1.5-30.0(平均7.1±1.2) cm, 切面灰白、灰红色, 多为鱼肉状, 质地较软. 6例伴明显出血坏死(5例直径≥10 cm), 其中3例囊性变(表2).
| 编号 | 肉眼 | 镜下 | 免疫组化 | ||||||
| 数目 | 大小(cm) | 类型 | 核分裂数/50HPF | CD117 | CD34 | SMA | S-100 | Desmin | |
| 1 | 多发 | 最大5×4×3 | 梭形细胞型 | 58 | +++ | +++ | + | +1 | - |
| 2 | 多发 | 直径0.5-1 | 梭形细胞型 | 17 | + | ++ | - | - | - |
| 3 | 多发 | 最大4.5×3.8×3.8 | 混合型 | 22 | +++ | +++ | - | - | - |
| 4 | 多发 | 最大10×8.5×6出血坏死 | 上皮细胞型 | 22 | ++ | - | - | - | - |
| 5 | 多发 | 最大14×11×10出血坏死囊性变 | 梭形细胞型 | 8 | +++ | - | - | - | - |
| 6 | 多发 | 最大7×5.5×5.5 | 梭形细胞型 | 32 | +++ | - | +1 | - | - |
| 7 | 多发 | 最大10×8×5 | 上皮细胞型 | 12 | +++ | +++ | - | - | - |
| 8 | 多发 | 最大15×10×9出血坏死囊性变 | 梭形细胞型 | 16 | +++ | - | +1 | - | - |
| 9 | 多发 | 最大7×5×4 | 梭形细胞型 | 47 | ++ | +++ | - | - | - |
| 10 | 多发 | 最大14×10×4出血坏死 | 梭形细胞型 | 9 | -2 | +++1 | - | -2 | - |
| 11 | 多发 | 最大5×4×3出血坏死 | 梭形细胞型 | 118 | +++ | - | +1 | - | - |
| 12 | 多发 | 最大6×5.6×4 | 梭形细胞型 | 20 | - | ++ | - | -2 | - |
| 13 | 单发 | 1.5×1.5×1 | 混合型 | 6 | ++ | - | +1 | - | - |
| 14 | 单发 | 2×1.6×1.6 | 梭形细胞型 | 54 | +++ | - | - | ++ | - |
| 15 | 多发 | 最大30×17×10出血坏死囊性变 | 梭形细胞型 | 34 | +++ | - | - | +1 | - |
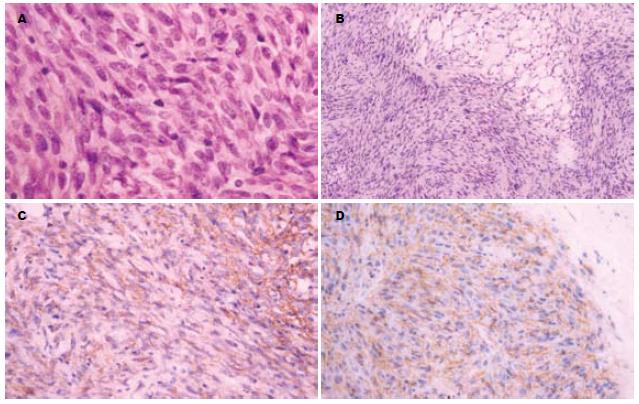
2.2.2 镜下: 11例以梭形细胞为主, 2例以上皮样细胞为主, 余2例为两种成分混合存在. 多数病例瘤细胞呈长梭形、短梭形和圆形, 胞质弱嗜酸, 常见核端空泡, 有时呈印戒样或透明细胞样(图1A); 排列呈漩涡状、栅栏状、巢状或弥漫性分布, 部分区细胞稀少, 胶原丰富, 可有血管外皮瘤样改变(图1B); 核分裂为6-118/50HPF; 间质血管丰富, 管周易见玻璃样变及黏液样变. 部分病例出血坏死较明显(表2).
2.2.3 免疫组化: 肿瘤细胞弥漫表达CD1l7 (86.7%)(图1C)、CD34(46.7%)(图1D), 灶性表达SMA(33.3%)、S-100(20%), Desmin均为阴性. 2例原发灶与转移灶肿瘤细胞免疫表型不一致(表2).
肝脏是GISTs最常见转移部位. Bauer et al[3]报道90例转移性GISTs中, 肝转移占62例. 国内报道GISTs发生肝转移的数据略高于国外. M. D. Anderson肿瘤中心研究显示, GISTs的肝转移率为17%[4]. 国内李俊霞 et al[5]报道31例原发GISTs的肝转移率为25.8%, 蔡国响 et al[6]报道99例原发GISTs的肝转移率为29%. 本研究中, GISTs各部位的转移率分别为肝脏8.1%, 网膜5.4%, 腹膜后2.2%, 腹壁皮下1.6%, 脾脏0.5%. 肝脏与网膜转移率明显高于其他部位(P<0.05). 但本组肝转移率明显低于国内外报道数据, 原因可能为仅影像学提示转移而未行病理检查的病例未被纳入, GISTs病例失访率较高, 临床诊断和治疗水平提高. 肝原发GISTs国内外未见报道, 故一般认为肝脏的GISTs均为转移性.
肝转移性GISTs见于各年龄段. 本组年龄35-73(平均56±3)岁, ≥50岁者11例, 占73.3%, 差异显著(P<0.05). 男女比为1.5:1. 临床常见症状为腹部疼痛或不适, 仅极少数患者无症状, 偶于体检、腹部其他手术或复查时被发现.
其肿瘤大体表现以多发结节为主(86.7%), 大小不等, 最大直径可达30 cm. 6例伴出血、坏死或囊性变的病例中, 5例直径≥10 cm(P<0.05). 镜下依据梭形细胞和上皮样细胞的比例可将GISTs分为梭形细胞型(上皮样细胞<10%)、上皮样细胞型(上皮样细胞>50%)和混合型(上皮样细胞10%-50%). 原发GISTs中多为梭形细胞型(70%), 常见于结肠、直肠, 上皮样细胞型(20%)主要见于胃, 混合型(10%)多见于胃和小肠. 本组15例中各型分别占73.3%、13.3%和13.3%, 与原发性GISTs无明显差异(P>0.05), 提示GISTs组织形态与转移无明显相关.
临床病理诊断中常需要借助免疫组化鉴别GISTs与其他梭形细胞肿瘤, 常用标记有CD117、CD34、SMA、S-100、Desmin. 其中CD117、CD34对诊断GISTs有特异性. 本组CD117的表达率为86.7%, 与原发性GISTs一致(84.2%-98.9%)(P>0.05); CD34为46.7%, 明显低于原发性GISTs(70.8%-95.4%)(P<0.05)[7-10]. 有文献[11]提出CD34与Desmin阴性的GISTs侵袭、转移能力更强. 本组研究结果较支持这一观点. 我们观察到部分肝转移性GISTs也可灶性表达SMA和S-100, 说明其与原发性GISTs相似, 可有肌样或神经样分化. 但本组中2例转移灶肿瘤细胞与原发灶的免疫表型不一致, 提示GISTs在转移的过程中可能发生免疫表型的变化.
CD117是GISTs诊断中的重要标记, 但GISTs也存在CD117阴性[12]. 本组2例CD117阴性, 此时可通过外显子的检测来确定[13-14]. 但目前该检测在临床的应用尚未成为常规病理检测手段, 所以仍有大约5%左右的GISTs有待于进一步确诊. 另一方面, 有文献报告精原细胞瘤、肥大细胞瘤、恶性黑色素瘤均表达CD117[15]. 某些透明细胞肉瘤、Ewing肉瘤、原始神经外胚层肿瘤、Kaposi肉瘤、血管肉瘤、隆突性皮肤纤维肉瘤、肌纤维母细胞瘤、孤立性纤维瘤、纤维瘤病、分化良好脂肪肉瘤和转移性小细胞癌都可不同程度表达CD117, 这增加了GISTs诊断的难度.
肝转移性GISTs与肝脏其他肿瘤的鉴别同样要依靠免疫组化: (1)平滑肌瘤和平滑肌肉瘤: 是最常与GISTs相混淆的肿瘤, 主要由梭形细胞呈束状排列而成, 特征为核似"雪茄烟样". SMA和Desmin弥漫强阳性, CD117阴性. (2)MPNST: 当GISTs出现神经分化时, S-100可为阳性, 易误诊为MPNSTs, 但MPNSTs CD117阴性. 本组中2例初诊为MPNSTs, 行CD117检测后修正为GISTs. (3)肉瘤样肝细胞癌: 是肝脏梭形细胞肿瘤中最常见的类型, 多处取材可见小梁状肝细胞和肉瘤样成分的移行, 且CK阳性. (4)血管肉瘤: 部分肝脏血管肉瘤可表现为梭形细胞形态, 且CD117和CD34可不同程度表达. 但仔细查找, 可见特征性的胞质内血管腔形成, 腔内偶见红细胞. (5)恶性黑色素瘤: CD117、SMA也可呈阳性, 其特征性标记为HMB45阳性. 此外, 还应鉴别一些肝脏少见的肿瘤如孤立性纤维性肿瘤、炎症性肌纤维母细胞瘤、Kaposi肉瘤、恶性纤维组细胞瘤等.
Masuoka et al[16]研究显示, GISTs多在原发部位诊断后出现肝转移, 肝转移距原发肿瘤手术的中位时间为12 mo. 国内研究[17]提出, 在原发性GISTs术后1年内应密切注意肝脏的变化. 但本研究结果与之有较大差异. 原发肿瘤与肝转移同时发现者6例, 非同时发现者7例, 且后者肝转移距原发肿瘤手术的时间多在1年以上(6/7), 最长者达86 mo. 这可能与病例的选择和临床检查治疗手段有关. 文献曾报道1例胃GISTs和1例直肠GISTs分别于术后11年和12年发生肝转移[16,18]. 因此, 临床应对GISTs术后患者进行长期观察和随访.
肝转移性GISTs的5年生存率较原发GISTs低, 为10%-20%[19]. 本组仅6例患者有随访资料, 随访率为40%, 随访时间3 mo-7年不等, 生存时间为术后0 d-65 mo, 1例超过5年(16.7%). 多数文献认为, 小肠GISTs的恶性程度最高, 发生肝转移的概率最高, 预后最差[20]. 目前手术治疗的进展使这一状况得到一定改善. DeMatteo et al[21]对34例行肝转移灶完全切除的GISTs患者进行生存分析, 5年生存率可达30%, 中位生存时间为39 mo. 临床正确认识肝转移性GISTs, 加强GISTs患者随访和复查, 早期诊断, 及时治疗, 有利于提高患者的生存质量, 延长生存期.
GISTs因其为消化道最常见的间叶性肿瘤而成为近年来研究的热点, 其好发部位为胃和小肠, 最常见的转移部位为肝脏. 肝脏转移性GISTs仅依赖组织形态特征易与其他梭形细胞肿瘤混淆, 需结合临床病史和免疫组织化学染色确诊, 其预后较原发性GISTs差, 临床应随访和复查.
目前GISTs相关研究主要集中于分子生物学水平, 基因靶向治疗将成为未来研究的重点.
以往GISTs研究多集中于胃肠道原发灶. 本文通过总结肝脏转移性GISTs的临床病理资料、免疫组化特点及预后, 配合国内外文献的学习, 归纳出肝脏转移性GISTs的临床病理特征.
本文总结了肝脏转移性GISTs的临床病理资料, 有助于临床医生提高对该病的认识, 加强随访和复查, 避免漏诊误诊.
本文设计合理, 思路清晰, 有一定的临床意义.
编辑: 程剑侠 电编:何基才
| 1. | Mazur MT, Clark HB. Gastric stromal tumors. Reappraisal of histogenesis. Am J Surg Pathol. 1983;7:507-519. [PubMed] |
| 2. | Miettinen M, Monihan JM, Sarlomo-Rikala M, Kovatich AJ, Carr NJ, Emory TS, Sobin LH. Gastrointestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery: clinicopathologic and im-munohistochemical study of 26 cases. Am J Surg Pathol. 1999;23:1109-1118. [PubMed] |
| 3. | Bauer S, Hartmann JT, de Wit M, Lang H, Grabellus F, Antoch G, Niebel W, Erhard J, Ebeling P, Zeth M. Resection of residual disease in patients with metastatic gastrointestinal stromal tumors responding to treatment with imatinib. Int J Cancer. 2005;117:316-325. [PubMed] |
| 4. | Patel SR, Benjamin RS. Management of peritoneal and hepatic metastases from gastrointestinal stromal tumors. Surg Oncol. 2000;9:67-70. [PubMed] |
| 6. | 蔡 国响, 蔡 三军, 师 英强, 杜 春燕, 侯 英勇, 徐 烨, 廉 朋, 管 祖庆, 施 达仁. 26例胃肠道间质瘤肝转移的临床特征和生存分析. 中华消化杂志. 2005;25:521-525. |
| 7. | 贺 慧颖, 方 伟岗, 钟 镐镐, 李 燕, 郑 杰, 杜 娟, 衡 万杰, 吴 秉铨. 165例胃肠道间质瘤中c-kit和PDGFRA基因突变的检测和临床诊断意义. 中华病理学杂志. 2006;35:262-266. |
| 11. | Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol. 2005;29:52-68. [PubMed] |
| 12. | Medeiros F, Corless CL, Duensing A, Hornick JL, Oliveira AM, Heinrich MC, Fletcher JA, Fletcher CD. KIT-negative gastrointestinal stromal tumors: proof of concept and therapeutic implications. Am J Surg Pathol. 2004;28:889-894. [PubMed] |
| 13. | Willmore-Payne C, Layfield LJ, Holden JA. c-KIT mutation analysis for diagnosis of gastrointestinal stromal tumors in fine needle aspiration specimens. Cancer. 2005;105:165-170. [PubMed] |
| 14. | 顾 国利, 王 石林, 任 力, 魏 学明, 李 德昌, 周 晓武, 黄 蓉蓉. 胃肠道间质瘤的临床病理分析和免疫组化特点. 世界华人消化杂志. 2006;14:2241-2246. [DOI] |
| 15. | Hornick JL, Fletcher CD. Immunohistochemical staining for KIT (CD117) in soft tissue sarcomas is very limited in distribution. Am J Clin Pathol. 2002;117:188-193. [PubMed] |
| 16. | Masuoka H, Kawagishi N, Inoue T, Ohkohchi N, Fujimori K, Koyamada N, Sekiguchi S, Tsukamoto S, Satomi S. Giant hepatic metastasis from gastrointestinal stromal tumor of the rectum 12 years after surgery. Hepatogastroenterology. 2003;50:1454-1456. [PubMed] |
| 18. | Ballarini C, Intra M, Ceretti AP, Prestipino F, Bianchi FM, Sparacio F, Berti E, Perrone S, Silva F. Gastrointestinal stromal tumors: a "benign" tumor with hepatic metastasis after 11 years. Tumori. 1998;84:78-81. [PubMed] |
| 19. | Lang H, Nussbaum KT, Kaudel P, Frühauf N, Flemming P, Raab R. Hepatic metastases from leiomyosarcoma: A single-center experience with 34 liver resections during a 15-year period. Ann Surg. 2000;231:500-505. [PubMed] |
| 20. | Emory TS, Sobin LH, Lukes L, Lee DH, O'Leary TJ. Prognosis of gastrointestinal smooth-muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol. 1999;23:82-87. [PubMed] |