修回日期: 2007-10-18
接受日期: 2007-10-28
在线出版日期: 2007-12-08
目的: 研究Cdk3在结肠息肉、结肠腺瘤、结肠癌组织中的表达, 探讨Cdk3在结肠癌变过程中的演变规律及其意义.
方法: 用免疫组织化学和原位杂交的方法检测22例结肠癌组织、22例结肠腺瘤组织、24例结肠息肉组织中Cdk3蛋白和mRNA的表达.
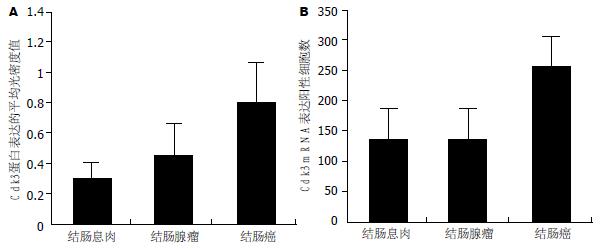
结果: Cdk3蛋白和mRNA在结肠息肉、结肠腺瘤、结肠癌组织中的表达呈核-质型, 以质为主. 图像分析结果显示, 结肠癌组织中Cdk3蛋白表达平均光密度值(0.80±0.36)明显高于结肠腺瘤组织(0.48±0.22)和结肠息肉组织(0.25±0.13)(P<0.05), 结肠腺瘤组织中Cdk3蛋白表达平均光密度值明显高于结肠息肉组织(P<0.05), 结肠癌组织中的阳性细胞数(266.5±40.2)明显高于结肠腺瘤组织(132.0±37.4)和结肠息肉组织(129.3±26.7).
结论: Cdk3在结肠癌变过程中表达逐步增强, 在结肠癌组织中异常高表达, 可能在结肠癌变过程中发挥重要作用.
引文著录: 黄大毛, 王巍巍, 莫莉, 冯德元, 颜亚晖, 蒋海鹰, 唐发清. Cdk3在结肠癌变过程中的表达及其意义. 世界华人消化杂志 2007; 15(34): 3649-3653
Revised: October 18, 2007
Accepted: October 28, 2007
Published online: December 8, 2007
AIM: To investigate the expression profile of Cdk3 in colon poplyp, adenoma and its adjacent tissues and its significance in the evolution of colon cancer.
METHODS: Using immunohistochemistry and in situ hybridization, Cdk3 protein and mRNA expressions were detected in 22 cases of colon cancer, 22 cases of colonic adenoma and 24 cases of colonic polyp.
RESULTS: Immunohistochemistry and in situ hybridization showed Cdk3 protein in the cytoplasts and cytoplasms of colonic polyp, colonic adenoma and cancer tissues. Cdk3 was mainly expressed in cytoplasm. Image analysis revealed that the mean optical density of Cdk3 protein in colon cancer tissue (0.80 ± 0.36) was significantly higher than that in colon adenoma (0.48 ± 0.22) and polyp tissues (0.25 ± 0.13, P < 0.05), and the mean optical density of colonic adenomas was significantly higher than that of colon polyps (P < 0.05). The results of in situ hybridization showed significantly more cells expressing Cdk3 mRNA in colon cancer tissue (266.5 ± 40.2) than in colon adenoma (132.0 ± 37.4) and polyp tissues (129.3 ± 26.7, P < 0.05).
CONCLUSION: Cdk3 expression gradually increases during the course of colon cancerization. Cdk3 may be involved in colon carcinogenesis.
- Citation: Huang DM, Wang WW, Mo L, Feng DY, Yan YH, Jiang HY, Tang FQ. Expression of Cdk3 in colon carcinogenesis and its significance. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3649-3653
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3649
Cdk3是一种新的与CDC2相关的细胞周期依赖性蛋白激酶, 在细胞周期中发挥重要作用[1-3]. 作为一种细胞正性调控因子, Cdk3不仅参与细胞周期G1/S转换[4-6]和促进G0期退出[4], 而且能够促进细胞停泊非依赖性生长[7]. 在大多数正常组织或细胞中Cdk3表达极低, 而在肿瘤组织中表达以及异常活化情况目前尚不清楚. 结肠癌(colon cancer)是胃肠道常见的恶性肿瘤. 我们研究Cdk3在结肠癌变过程中的表达, 以获得Cdk3在结肠癌变过程中的表达规律及其在结肠癌中高表达证据, 为研究Cdk3在肿瘤发生、发展过程中的作用提供实验依据.
中南大学湘雅医院病理科2005/06-10的住院和门诊患者送检标本68例, 其中结肠癌22例, 男12例, 女10例, 平均年龄(49.3±15.3)岁; 结肠腺瘤22例, 男13例, 女9例, 平均年龄(57.8±12.1)岁; 结肠息肉24例, 男13例, 女11例, 平均年龄(53.8±14.0)岁, 均经临床诊断和病理诊断确诊. 兔抗人Cdk3 mAb(Santa Cruz, CA), SABC免疫组化染色试剂盒、Cdk3原位杂交试剂盒、DAB购于武汉博士德公司, HPIAS-1000高清晰度彩色病理图文报告分析系统购于同济千屏影像公司.
1.2.1 免疫组化法检测Cdk3蛋白: 实验操作严格按照SABC免疫组化染色试剂盒说明书进行. 一抗稀释度为1:100, 用0.01 mol/L柠檬酸盐缓冲液进行微波抗原修复, DAB显色, 苏木素复染, 干燥后中性树脂封片. 实验结果采用HPIAS-1000高清晰度彩色病理图文报告分析系统进行分析. 每张组织切片随机选取15个高倍视野(×400)测量光密度, 计算平均光密度值.
1.2.2 原位杂交实验检测Cdk3 mRNA: 对同一标本用原位杂交的方法检测Cdk3 mRNA表达, 实验操作严格按照Cdk3原位杂交试剂盒说明书进行. 用30 g/L柠檬酸新鲜稀释的胃蛋白酶暴露mRNA核酸片段, 然后进行后固定、预杂交和杂交, 滴加生物素化鼠抗地高辛和生物素化过氧化物酶后DAB显色, 苏木素复染, 干燥后中性树脂封片, 显微镜下观察结果. 以细胞核或细胞质出现浅黄色至深棕黄色颗粒为阳性反应细胞. 实验结果采用HPIAS-1000高清晰度彩色病理图文报告分析系统进行分析. 每张组织切片选取15个高倍视野(×400)计数阳性细胞数.
统计学处理 资料采用SPSS10.0统计软件对数据进行统计学分析, 数值用mean±SD表示. 多组间均数比较采用方差分析.
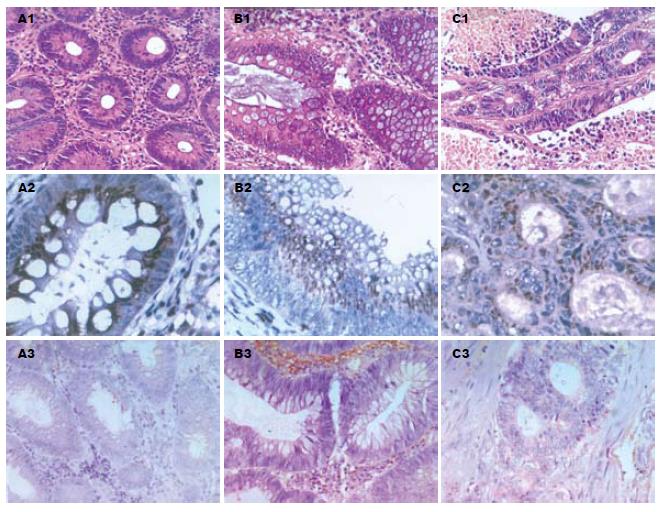
显微镜下观察结果显示, Cdk3蛋白和mRNA在结肠息肉、结肠腺瘤、结肠癌组织中的表达呈核-质型, 以质为主(图1). 以细胞核或细胞质出现浅黄色颗粒为弱阳性, 出现黄色颗粒至深棕黄色颗粒为阳性, 不出现上述显色颗粒为阴性(表1). 结果显示, 结肠息肉、腺瘤、癌组织中Cdk3蛋白表达阳性率分别为29.17%, 45.45%和81.82%; 结肠息肉、腺瘤、癌组织中Cdk3 mRNA表达阳性率分别为33.33%, 45.45%和86.36%. 其中免疫组化和原位杂交均阴性26例(38.24%), 均阳性(包括弱阳性)31例(45.59%). 结果表明, Cdk3蛋白和mRNA在结肠息肉、结肠腺瘤和结肠癌阳性率呈逐步上升的趋势.
| 编号 | 病理号 | 病理 类型 | 免疫组 化结果 | 原位杂 交结果 |
| 1 | 643966 | 息肉 | - | - |
| 2 | 643251 | 息肉 | - | - |
| 3 | 642889 | 息肉 | - | - |
| 4 | 641810 | 息肉 | + | + |
| 5 | 641763 | 息肉 | ± | + |
| 6 | 641605 | 息肉 | + | - |
| 7 | 640714 | 息肉 | - | - |
| 8 | 640551 | 息肉 | - | ± |
| 9 | 640179 | 息肉 | + | + |
| 10 | 640002 | 息肉 | - | - |
| 11 | 639610 | 息肉 | + | ± |
| 12 | 639098 | 息肉 | + | ± |
| 13 | 638864 | 息肉 | ± | - |
| 14 | 638783 | 息肉 | - | - |
| 15 | 638094 | 息肉 | - | + |
| 16 | 636821 | 息肉 | - | - |
| 17 | 636474 | 息肉 | - | - |
| 18 | 635248 | 息肉 | - | - |
| 19 | 635128 | 息肉 | - | - |
| 20 | 634783 | 息肉 | - | - |
| 21 | 633969 | 息肉 | - | - |
| 22 | 633373 | 息肉 | - | - |
| 23 | 633344 | 息肉 | - | - |
| 24 | 633156 | 息肉 | + | + |
| 25 | 641971 | 腺瘤 | + | + |
| 26 | 644139 | 腺瘤 | - | - |
| 27 | 644044 | 腺瘤 | + | + |
| 28 | 639941 | 腺瘤 | ± | - |
| 29 | 643179 | 腺瘤 | - | - |
| 30 | 640587 | 腺瘤 | - | - |
| 31 | 641092 | 腺瘤 | - | + |
| 32 | 640584 | 腺瘤 | - | - |
| 33 | 638863 | 腺瘤 | - | - |
| 34 | 638782 | 腺瘤 | - | + |
| 35 | 638334 | 腺瘤 | + | + |
| 36 | 637900 | 腺瘤 | - | - |
| 37 | 637258 | 腺瘤 | + | ± |
| 38 | 636767 | 腺瘤 | + | + |
| 39 | 636475 | 腺瘤 | - | - |
| 40 | 636059 | 腺瘤 | - | - |
| 41 | 635997 | 腺瘤 | + | + |
| 42 | 639943 | 腺瘤 | ± | + |
| 43 | 635378 | 腺瘤 | - | - |
| 44 | 633637 | 腺瘤 | + | + |
| 45 | 640600 | 腺瘤 | + | - |
| 46 | 643033 | 腺瘤 | - | - |
| 47 | 643912 | 腺癌 | + | + |
| 48 | 643640 | 腺癌 | + | + |
| 49 | 643517 | 腺癌 | + | + |
| 50 | 643465 | 腺癌 | - | - |
| 51 | 642925 | 腺癌 | ± | + |
| 52 | 642534 | 腺癌 | + | + |
| 53 | 642535 | 腺癌 | + | + |
| 54 | 642211 | 腺癌 | + | + |
| 55 | 642188 | 腺癌 | + | + |
| 56 | 642160 | 腺癌 | - | - |
| 57 | 641643 | 腺癌 | ± | ± |
| 58 | 640839 | 腺癌 | + | + |
| 59 | 640040 | 腺癌 | + | + |
| 60 | 639884 | 腺癌 | + | ± |
| 61 | 639419 | 腺癌 | - | + |
| 62 | 639158 | 腺癌 | + | ± |
| 63 | 638836 | 腺癌 | + | + |
| 64 | 638790 | 腺癌 | ± | + |
| 65 | 638565 | 腺癌 | + | - |
| 66 | 638475 | 腺癌 | - | + |
| 67 | 638403 | 腺癌 | + | ± |
| 68 | 638174 | 腺癌 | + | + |
Cdk3是一种重要的细胞周期依赖性蛋白激酶, 在细胞周期调节过程中起着重要作用[8-10]. Cdk3通过DP-1与E2F1-3结合增强他们的转录活性而参与G1/S转换[4-6]. 作为一个蛋白激酶, Cdk3与cyclin C结合使pRb Ser 807/811位磷酸化而促进G0期退出, Cdk3-DN能够导致G1期阻止[6]和抑制pRb Ser 807/811位磷酸化而阻止G0期退出[4]. Cdk3与CDC2(Cdk1)和Cdk2有高度的同源性, 但在细胞周期调节中的作用又截然不同[6,11-12]. Cdk3显性负性突变体(Cdk3 dominant-negative mutant, Cdk3-DN)介导的G1期阻止能够被野生型Cdk3解除[7], 却不能被Cdk2解除[6]. 另外Cdk3介导ik-3 Ser 274位磷酸化而参与细胞周期的调节[13-15]. Cdk3参与细胞周期的调控的研究取得了一定进展, 而Cdk3的确切生物学功能和在肿瘤发生、发展中的作用并不十分清楚.
Cdk3参与G1/S转换以及促进G0期退出等都表明Cdk3具有促进细胞增殖的功能. Cdk3也是一种细胞周期正性调控因子[16-17], 许多细胞周期正性调控因子具有致癌潜能[18]. 但是Cdk3是否与其他细胞周期正性调控因子一样具有致癌潜能却并不清楚. 要研究Cdk3的致癌潜能, 我们首先要考察其在肿瘤组织中异常表达情况. 在正常生理状况下, Cdk3在大多数细胞和组织中活性极低[4]. 然而当受到EGF刺激或在细胞癌变过程中基因高度重排时Cdk3活性显著升高[19]. 另外研究表明Cdk3能够促进Myc介导的细胞停泊非依赖性生长[5]. 这些都强烈提示Cdk3可能参与肿瘤的形成. 而目前有关Cdk3在肿瘤组织中的表达和异常活化情况国内外尚未见报道. 结肠癌发生、发展的演进过程具有明显的形态学时相. 正常的结肠黏膜由最初的上皮增生发展成为良性腺瘤, 再经腺癌转变为具有浸润转移潜力的结肠癌. 细胞形态学上, 由单纯性增生发展为异型增生, 再转化为癌[20]. 这为我们研究Cdk3在癌变过程中表达规律提供了良好的模型. 因此, 我们分别用免疫组化和原位杂交的方法检测结肠癌组织、结肠腺瘤组织、结肠息肉组织中的Cdk3蛋白和mRNA的表达, 结果显示, Cdk3蛋白和mRNA在结肠息肉、腺瘤、癌组织中表达逐步升高, 而且蛋白和mRNA的表达呈现高度的一致性, 结肠癌组织中Cdk3蛋白和mRNA表达明显高于结肠息肉和腺瘤组织. 这表明Cdk3在结肠癌变过程中的表达逐步增强, 在结肠癌组织中异常活化, 因而Cdk3可能在结肠癌变过程中发挥重要作用. Cdk3在结肠腺瘤组织的高表达, 说明Cdk3异常活化发生在结肠癌变的早期, 可能为结肠癌的早期诊断提供新的分子靶标.
本研究发现, Cdk3在结肠癌变过程中异常活化以及在结肠癌组织中高表达. 因此, 我们认为Cdk3可能参与结肠癌变. 这为研究Cdk3在肿瘤发生、发展过程中的作用提供了实验依据, 也为结肠癌变的分子机制研究提供了新的思路. 而Cdk3参与癌变的作用机制尚需进一步研究.
Cdk3基因在乳腺癌等肿瘤组织中高度重排, 在体外能够促进细胞转化, 但是否参与癌变以及作用机制并不十分清楚. 研究Cdk3在结肠癌等肿瘤组织中的表达有助于寻找Cdk3在肿瘤组织中异常活化的证据, 为研究Cdk3与肿瘤的关系提供新的实验依据.
Cdk3是一种细胞周期正性调控因子, 其生物学功能研究是当前细胞周期研究的热点. 是否与其他细胞周期正性调控因子(如Cdk4, cyclin D1等)一样具有致癌潜能是目前有关Cdk3研究的难点. 为明确Cdk3是否参与癌变, 首先考察其在癌变过程的异常表达和异常活化.
国外研究发现高水平的Cdk3可以促进Myc介导的细胞增殖和细胞停泊非依赖性生长, Cdk3基因在乳腺癌以及其他肿瘤组织中高度重排.
Cdk3在结肠癌变早期结肠腺瘤中就开始高表达, 可能为结肠癌的早期诊断提供新的分子靶标.
本文设计合理, 数据可信, 对基础研究有一定的参考意义.
编辑: 何燕 电编:何基才
| 2. | Meyerson M, Enders GH, Wu CL, Su LK, Gorka C, Nelson C, Harlow E, Tsai LH. A family of human cdc2-related protein kinases. EMBO J. 1992;11:2909-2917. [PubMed] |
| 3. | Lew J, Wang JH. Neuronal cdc2-like kinase. Trends Biochem Sci. 1995;20:33-37. [PubMed] |
| 5. | Hofmann F, Martelli F, Livingston DM, Wang Z. The retinoblastoma gene product protects E2F-1 from degradation by the ubiquitin-proteasome pathway. Genes Dev. 1996;10:2949-2959. [PubMed] |
| 6. | van den Heuvel S, Harlow E. Distinct roles for cyclin-dependent kinases in cell cycle control. Science. 1993;262:2050-2054. [PubMed] |
| 7. | Braun K, Holzl G, Soucek T, Geisen C, Moroy T, Hengstschlager M. Investigation of the cell cycle regulation of cdk3-associated kinase activity and the role of cdk3 in proliferation and transformation. Oncogene. 1998;17:2259-2269. [PubMed] |
| 8. | Draetta GF. Mammalian G1 cyclins. Curr Opin Cell Biol. 1994;6:842-846. [PubMed] |
| 9. | Zwicker J, Muller R. Cell-cycle regulation of gene expression by transcriptional repression. Trends Genet. 1997;13:3-6. [PubMed] |
| 10. | Sage J, Miller AL, Perez-Mancera PA, Wysocki JM, Jacks T. Acute mutation of retinoblastoma gene function is sufficient for cell cycle re-entry. Nature. 2003;424:223-228. [PubMed] |
| 11. | Hofmann F, Livingston DM. Differential effects of cdk2 and cdk3 on the control of pRb and E2F function during G1 exit. Genes Dev. 1996;10:851-861. [PubMed] |
| 12. | Braun K, Holzl G, Pusch O, Hengstschlager M. Deregulated expression of CDK2- or CDK3-associated kinase activities enhances c-Myc-induced apoptosis. DNA Cell Biol. 1998;17:789-798. [PubMed] |
| 13. | Yamochi T, Semba K, Tsuji K, Mizumoto K, Sato H, Matsuura Y, Nishimoto I, Matsuoka M. ik3-1/Cables is a substrate for cyclin-dependent kinase 3 (cdk 3). Eur J Biochem. 2001;268:6076-6082. [PubMed] |
| 14. | Matsuoka M, Matsuura Y, Semba K, Nishimoto I. Molecular cloning of a cyclin-like protein associated with cyclin-dependent kinase 3 (cdk 3) in vivo. Biochem Biophys Res Commun. 2000;273:442-447. [PubMed] |
| 15. | Sato H, Nishimoto I, Matsuoka M. ik3-2, a relative to ik3-1/cables, is associated with cdk3, cdk5, and c-abl. Biochim Biophys Acta. 2002;1574:157-163. [PubMed] |
| 16. | Wu JR, Gilbert DM. The replication origin decision point is a mitogen-independent, 2-aminopurine-sensitive, G1-phase event that precedes restriction point control. Mol Cell Biol. 1997;17:4312-4321. [PubMed] |
| 17. | Keezer SM, Gilbert DM. Evidence for a pre-restriction point Cdk3 activity. J Cell Biochem. 2002;85:545-552. [PubMed] |
| 18. | Haas K, Staller P, Geisen C, Bartek J, Eilers M, Moroy T. Mutual requirement of CDK4 and Myc in malignant transformation: evidence for cyclin D1/CDK4 and p16INK4A as upstream regulators of Myc. Oncogene. 1997;15:179-192. [PubMed] |
| 19. | Bullrich F, MacLachlan TK, Sang N, Druck T, Veronese ML, Allen SL, Chiorazzi N, Koff A, Heubner K, Croce CM. Chromosomal mapping of members of the cdc2 family of protein kinases, cdk3, cdk6, PISSLRE, and PITALRE, and a cdk inhibitor, p27Kip1, to regions involved in human cancer. Cancer Res. 1995;55:1199-1205. [PubMed] |