修回日期: 2007-11-10
接受日期: 2007-11-28
在线出版日期: 2007-12-08
目的: 体外诱导小鼠骨髓间充质干细胞分化(BMSCs)为肝样细胞, 提高分化效率.
方法: 将第一代BMSCs随机分为诱导组和对照组. 诱导组加肝细胞生长因子、成纤维生长因子、表皮生长因子、抑瘤素M等进行诱导培养, 观察细胞形态, 检测甲胎蛋白(AFP)、白蛋白(Alb)、细胞角蛋白18(CK18)、酪氨酸氨基转移酶(TAT)和细胞色素P4502b9(CYP2b9)的mRNA表达, Alb合成以及Alb和CK18蛋白标记细胞阳性率.
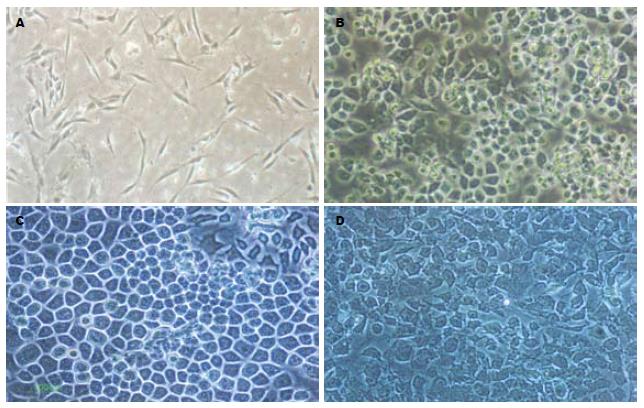
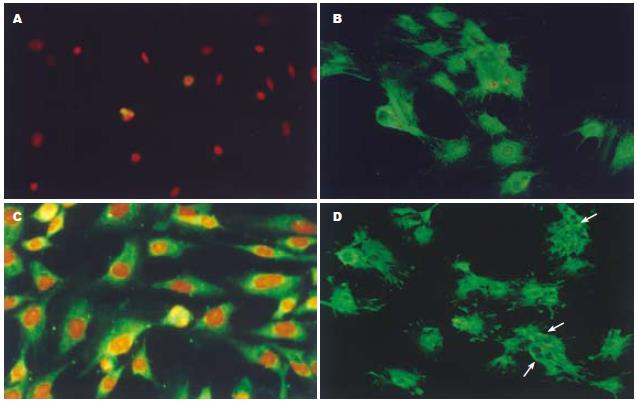
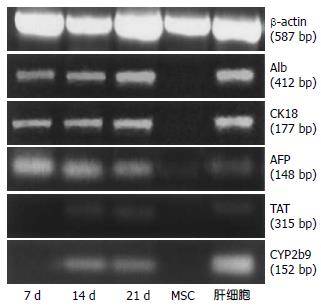
结果: 诱导组第3天出现多边形细胞, 5-7 d上皮样细胞呈岛状分布, 14 d呈铺路石状. 对照组细胞为长梭形. 第7, 14, 21天, 诱导组细胞AFP, Alb, CK18 mRNA和Alb蛋白检测阳性; 第14, 21天, 细胞表达TAT和CYP2b9 mRNA. 对照组除AFP mRNA呈弱阳性外, 其余均为阴性. 第7, 14, 21天, 诱导组CK18阳性率分别为71.4%, 75.9%, 80.6%; Alb阳性率分别为75.0%, 79.7%, 81.1%. 而对照组第7天CK18和Alb阳性率仅2.3%, 1.7%, 与诱导组相比有显著差异(PCK18 = 1.97×10-5, PAlb = 3.08×10-6).
结论: BMSCs在体外可以被诱导分化为肝样细胞, 诱导率最高可达80%以上.
引文著录: 俞瑞珺, 刘海林. 体外诱导小鼠骨髓间充质干细胞分化为肝样细胞. 世界华人消化杂志 2007; 15(34): 3577-3582
Revised: November 10, 2007
Accepted: November 28, 2007
Published online: December 8, 2007
AIM: To induce hepatocyte-like cells from mouse bone marrow mesenchymal stem cells, and improve their differentiation rate in vitro.
METHODS: Bone marrow mesenchymal stem cells were collected from C57 mice, and cultured in differentiation medium including HGF, FGF4, EGF, OSM, Dex and ITS. Expression of hepatocyte specific genes, such as AFP, Alb, CK18, TAT and CYP2b9 was detected by RT-PCR. Cells expressing Alb and CK18 proteins were identified by immunofluorescence staining and flow cytometry.
RESULTS: In the differentiation group, some polygonal cells appeared on day 3 in culture, cobblestone-shaped epithelial-like cells appeared after 5 to 7 days and increased in number until day 14, while control group cells retained their spindle morphology. AFP, Alb and CK18 mRNA could be detected on days 7, 14 and 21. TAT and CYP2b9 mRNA were also detected on days 14 and 21. However, Alb, CK18, TAT and CYP2b9 mRNAs were not detected in the control group, and only low levels of AFP mRNA were detected. In the differentiation group, Alb protein was detected by immunofluorescence on days 7, 14 and 21. The percentages of cells that were Alb-positive were 75.0%, 79.7% and 81.1% on days 7, 14, 21 respectively, and the percentages that were CK18-positive were 71.4%, 75.9% and 80.6%, respectively.
CONCLUSION: Bone marrow mesenchymal stem cells can differentiate into hepatocyte-like cells in vitro, which provides a solid experimental basis for hepatocyte transplantation.
- Citation: Yu RJ, Liu HL. Differentiation of mouse bone marrow mesenchymal stem cells into hepatocyte-like cells in vitro. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3577-3582
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3577.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3577
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSCs)是成体干细胞中最易获得的干细胞之一, 具有多向分化潜能[1-4], 并且采集方便、容易培养、增殖能力强、性质稳定[5], 适合自体移植[6-9]. 研究表明BMSCs可以分化为上皮样细胞[10-11], 如肺泡上皮支气管上皮细胞[12-13]、皮肤[14]、肾[15]、胰腺[16]和胃肠[17]等. 在适当条件下可以向肝脏细胞分化[18-28], 移植入体内可改善肝功能[29-30]. 但对提高诱导分化的效率和稳定性尚有待进一步研究. 我们选择在肝脏细胞发育成熟过程中发挥关键性作用的细胞因子肝细胞生长因子(HGF)、成纤维生长因子4(FGF4)、抑瘤素M(OSM)、表皮生长因子(EGF)组成诱导体系, 对体外培养的BMSCs进行定向诱导, 通过观察细胞形态变化, 检测肝细胞相关标志如甲胎蛋白(AFP)、白蛋白(Alb)、细胞角蛋白18(CK18)、酪氨酸氨基转移酶(TAT)、细胞色素P4502b9(CYP2b9)的表达, 评价其诱导BMSCs分化为肝细胞的效率, 为开展肝细胞移植奠定基础.
1周龄C57小鼠(上海中科院实验动物中心), Ficoll分离液(Pharmacia公司), L-DMEM培养液(Gibco公司), MCDB-201培养液(Sigma公司), HGF(R&D systems公司), FGF4(R&D systems公司), OSM(R&D systems公司), EGF(Chemicon international公司), ITS(Gibco公司), Alb抗体(Rockland 公司), TRIzol试剂盒(Sigma-Aldrich公司), TaKaRa RNA PCR试剂盒(Biotech公司), RT-PCR引物(上海生工生物工程公司合成), CK18(Santa Cruz 公司).
1.2.1 BMSCs标本的分离培养和诱导: 从C57小鼠股骨和胫骨获取骨髓细胞, Ficoll分离液密度梯度离心900 g, 30 min. 收集单个核细胞, PBS洗涤2次, 台盼兰染色、计数, 按密度2.5×105/cm2接种于培养皿, 加入基础培养液, 37℃、50 mL/L CO2, 饱和湿度培养. 将第一代BMSCs, 以5×103/cm2密度接种于培养皿中, 随机分为诱导组和对照组. 对照组为基础培养液(L-DMEM, 含100 mL/L胎牛血清、NaHCO3、L-谷氨酰胺、青霉素和链霉素), 诱导组培养液为540 g/L L-DMEM, 360 g/L MCDB-201, 其他同基础培养液, 另加20 μg/L HGF, 20 μg/L FGF4, 10 μg/L EGF, 20 μg/L OSM, 10-8 mol/L地塞米松和1×ITS(胰岛素铁硒传递蛋白).
1.2.2 形态学观察: 应用倒置相差显微镜, 每天观察细胞的生长情况和形态特征变化. 免疫细胞化学: 细胞爬片, 丙酮固定5 min, 羊血清封闭30 min, 加兔抗鼠的Alb抗体, 4℃过夜, 加FITC标记抗兔二抗, 37℃孵育30 min, 900 mL/L的丙三醇封片, 荧光显微镜观察.
1.2.3 逆转录-聚合酶链反应: 采用TRIzol试剂盒分别提取细胞和小鼠肝组织总RNA, TaKaRa RNA PCR试剂盒进行RT-PCR反应. 逆转录反应体系由MgCl2 4 μL, 10×RNA Buffer 2 μL, RNase Free双蒸水7.5 μL, dNTP 2 μL, 逆转录酶1 μL, Oligo dT-Adaptor primer 1 μL, RNase inhibitor 0.5 μL, RNA样品2 μL组成, 30℃ 10 min, 42℃ 60 min, 99℃ 5 min, 5℃ 5 min. PCR反应体系由MgCl2 1.6 μL, 10×RNA PCR Buffer 2 μL, 灭菌蒸馏水14.05 μL, TaKaRa Taq 0.25 μL, dNTP0.5 μL, cDNA 1 μL, 上游引物0.3 μL, 下游引物0.3 μL组成, 94℃ 3 min变性, 然后94℃ 30 s, 55℃
30 s, 72℃ 1 min, 共35个循环, 72℃ 5 min终止反应. 反应产物经12 g/L琼脂糖凝胶电泳, GIS-2800凝胶图像处理系统测定mRNA水平. 引物序列见表1.
| 基因Gene | 正向引物Sense primer | 反向引物Reverse primer | 产物大小Product size(bp) |
| Alb | GCATGAAGTTGCCAGAAGACATCC | TCTGCAGTTTGCTGGAGATAGTCG | 412 |
| CK18 | CGATACAAGGCACAGATGGA | CTTCTCCATCCTCCAGCAAG | 177 |
| AFP | GTGAAACAGACTTCCTGGTCCT | GCCCTACAGACCATGAAACAAG | 148 |
| TAT | GACGAGGAAGGCTTTGTGAG | CTTCATGGCTTGGGTCACTT | 315 |
| CYP2b9 | GATGATGTTGGCTGTGATGC | CTGGCCACCATGAAAGAGTT | 152 |
| β-actin | CCAAGGCCAACCGCGAGAAGATGAC | AGGGTACATGGTGGTGCCGCCAGAC | 587 |
1.2.4 流式细胞仪检测: 制备细胞数量为0.5×106单细胞悬液, 加入1.5 mL Eppendorf管中, 1 g/L Triton破膜1 min, PBS洗涤, 用100 μL含40 mL/L FCS的PBS重新悬浮, 分别加入CK18, Alb抗体各10 μL, 4℃孵育30 min, PBS 冲洗, 沉淀细胞用100 μL 含40 mL/L FCS的PBS重新悬浮, 分别加入藻红蛋白(PE)标记的羊抗鼠二抗和羊抗兔二抗各5 μL, 4℃孵育30 min, PBS冲洗, 流式细胞仪检测. 每组测定3个样本, 取平均值.
统计学处理 数据用mean±SD表示, 双样本等方差t检验进行比较, P<0.01为有显著性差异.
未诱导的对照组第一代BMSCs呈梭形或成纤维样. 诱导组第3天, 细胞变小, 出现多边形细胞; 第7天出现类圆形、多角形, 形成岛状铺路石; 第14天细胞呈典型的铺路卵石状; 第21天, 细胞排列混乱, 局部细胞形态不规则、边界不清(图1).
BMSCs在诱导第7, 14, 21天诱导组细胞Alb染色均为阳性, 第21天, 可见双细胞核和多细胞核现象. 而对照组细胞Alb染色为阴性(图2).
BMSCs诱导7 d Alb, CK18, AFP等mRNA表达阳性; 诱导14, 21 d, Alb, CK18, AFP, TAT, CYP2b9等mRNA表达阳性. 未诱导BMSCs除AFP的mRNA弱阳性外, 其余的均为阴性; 肝组织Alb, CK18, AFP, TAT和CYP2b9等mRNA表达均阳性(图3).
BMSCs诱导组第7, 14, 21天, CK18蛋白表达阳性率分别为71.4%±5.0%, 75.9%±2.2%, 80.6%±2.1%; Alb蛋白表达阳性率分别为75.0%±3.3%, 79.7%±3.0%, 81.1%±3.0%, 对照组第7天, CK18和Alb蛋白表达阳性率分别为2.3%±1.2%, 1.7%±0.9%. 与诱导组相比, 均P<0.001(PCK18 = 1.97×10-5PAlb = 3.08×10-6, t检验), 有非常显著的差异.
在肝脏发育过程中, 需要经过几个阶段, 每个阶段参与的细胞因子不同. 哺乳动物从胚胎发育到5-7体节期开始, 相当于人类胚胎发育的第4周左右. 在邻近的心源中胚层细胞产生的FGF作用下, 前肠内胚层末端腹侧壁上皮增生至14-20体节期形成一个向外突出的肝原基, 并在其他生长因子(如骨形成蛋白)的共同作用下, 完成肝脏的早期发育决定. FGF不仅能促进细胞生长和分裂, 也是形态发生和分化的诱导因子[31-34]. 在肝脏成熟和终末分化阶段, HGF, OSM以及糖皮质激素和血管内皮细胞等都起着重要作用[35-38].
HGF主要由Kupffer细胞和肝窦内皮细胞产生, 是肝细胞最强的促有丝分裂原, 并且在出生后对肝细胞的继续发育成熟发挥作用. 在地塞米松存在情况下, HGF可以促进肝脏葡萄糖6-磷酸酶、酪氨酸氨基转移酶、氨基甲酰磷酸合成酶等表达及糖原合成[39]. OSM是肝干细胞分化成熟的强力诱导因子, 能促使肝细胞表达分化标志物酪氨酸氨基转移酶等, 引起细胞形态学变化, 上调肝细胞的特异功能(如氨清除、脂肪合成、糖原合成和解毒功能), 增强同种细胞之间黏附等[40]. OSM在胎肝中由CD45+造血细胞旁分泌, 通过OSM受体激活信号传导和转录激活因子3途径发挥生物学效应[41]. 糖皮质激素对OSM具有强烈的协同和促进作用. EGF促进上皮细胞增殖和分化, 对肝脏的发育成熟以及再生有明显促进作用[42].
我们选择肝脏细胞发育成熟过程中发挥关键性作用的细胞因子HGF, FGF4, OSM和EGF等作为诱导因素, 结果表明能够有效诱导BMSCs分化为肝样细胞, 合成Alb, 表达肝细胞的相关标志物AFP, CK18, TAT和CYP2b9.
AFP是内胚层分化和早期胚胎肝细胞的标志性蛋白质, 随着肝脏的发育成熟, 其表达逐渐降低. CK18为肝细胞中间丝细胞骨架, 从胚胎肝细胞开始到分化的肝细胞持续表达. 合成Alb则是肝细胞特有的功能. TAT是围产期和出生后肝细胞特异性分化的一个主要的标志酶, CYP2b9在小鼠肝细胞具有相对特异性表达. 两者均为成熟肝细胞的标志. 这些指标能够反映肝细胞的特异性功能和结构成分, 具有良好的代表性[43-45]. 因此, 我们采用联合检测作为判断诱导分化为肝细胞的依据. 在诱导分化过程中, 与体内肝脏发育过程相似. 首先检测到AFP等早期标志物的表达, 14 d后再出现TAT, CYP2b9等代表肝细胞成熟期的标志物. 而未诱导的BMSCs只有AFP mRNA表达呈弱阳性, 与文献[46]报道一致.
诱导前及未诱导组BMSCs细胞形态为长梭形, 类似成纤维细胞[47-48]. 诱导后细胞形态转变为多角形, 生长速度加快, 达到融合时细胞呈典型的铺路石状排列, 并在诱导21 d的时候观察到双细胞核和多细胞核现象, 符合肝细胞在体外培养时的细胞形态变化[25,49]. 关于这些细胞是否由骨髓中所含的极少量内皮细胞增殖而来, 我们认为基本可以排除, 因为体外内皮细胞的生长以及大量扩增需要特定的内皮细胞培养环境, 而且经联合检测肝细胞特异性的结构和功能标志物均为阳性.
通过流式细胞仪检测CK18和Alb蛋白阳性细胞数, 在诱导第21 d阳性细胞分别为80.6%和81.1%, 高于同类实验[50]. 这可能与BMSCs经过淋巴分离液密度梯度离心和差速贴壁法培养得到进一步纯化有关[51-53].
我们采用的诱导方法能够在体外将BMSCs成功地诱导为肝样细胞, 并使诱导率有所提高, 从而为今后进一步开展BMSCs诱导分化为肝细胞以及肝细胞移植奠定了实验基础.
缺乏足量的、具有良好生物学特性的肝细胞是阻碍肝细胞移植治疗在临床中得以实行的关键原因之一. BMSCs采集方便, 容易培养, 能大量扩增, 具有多向分化潜能等特性, 使其可能成为肝细胞移植所需的细胞重要来源途径之一.
研究领域中的热点、重点主要集中在如何有效的诱导BMSCs具有肝脏细胞特性. 亟待研究的问题主要是提高BMSCs的诱导效率、诱导后细胞的纯度, 保证诱导扩增后能提供足够数量的细胞, 同时能保持良好的肝细胞特性.
研究表明BMSCs在HGF、OSM、FGF、EGF等细胞因子的作用下, 可以向肝细胞分化. 但对BMSCs向肝细胞分化效率研究甚少. Shi et al的报道显示BMSCs分化的比例只有69.45%, 分化效率低. 因此, 在BMSCs纯度, 诱导方案等方面还需进一步研究, 以提高诱导效率.
以往相关研究主要以原代的BMSCs为主. 本文利用传代的、经过纯化的BMSCs. 在文献报道HGF, OSM, FGF, EGF联合诱导方案的基础上, 调整了相关诱导因子的用量, 提高了BMSCs向肝细胞分化的诱导效率.
本文通过对BMSCs的纯化, 诱导体系的调整, 提高BMSCs诱导成肝样细胞的诱导效率, 提高细胞的纯度, 能为将来肝细胞移植治疗提供科学基础.
本文表述清晰, 设计合理, 结果可信, 具有一定的可读性.
编辑: 李军亮 电编:马文华
| 1. | Conget PA, Minguell JJ. Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells. J Cell Physiol. 1999;181:67-73. [PubMed] |
| 2. | Pittenger MF, Mackay AM, Beck SC, Jaiswal RK, Douglas R, Mosca JD, Moorman MA, Simonetti DW, Craig S, Marshak DR. Multilineage potential of adult human mesenchymal stem cells. Science. 1999;284:143-147. [PubMed] |
| 3. | Minguell JJ, Erices A, Conget P. Mesenchymal stem cells. Exp Biol Med (Maywood). 2001;226:507-520. [PubMed] |
| 4. | Jiang Y, Jahagirdar BN, Reinhardt RL, Schwartz RE, Keene CD, Ortiz-Gonzalez XR, Reyes M, Lenvik T, Lund T, Blackstad M. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature. 2002;418:41-49. [PubMed] |
| 5. | Bruder SP, Jaiswal N, Haynesworth SE. Growth kinetics, self-renewal, and the osteogenic potential of purified human mesenchymal stem cells during extensive subcultivation and following cryopreservation. J Cell Biochem. 1997;64:278-294. [PubMed] |
| 6. | Horwitz EM, Le Blanc K, Dominici M, Mueller I, Slaper-Cortenbach I, Marini FC, Deans RJ, Krause DS, Keating A. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 2005;7:393-395. [PubMed] |
| 7. | Baksh D, Song L, Tuan RS. Adult mesenchymal stem cells: characterization, differentiation, and application in cell and gene therapy. J Cell Mol Med. 2004;8:301-316. [PubMed] |
| 8. | Kassem M, Kristiansen M, Abdallah BM. Mesenchymal stem cells: cell biology and potential use in therapy. Basic Clin Ph. armacol Toxicol. 2004;95:209-214. [PubMed] |
| 9. | Barry FP, Murphy JM. Mesenchymal stem cells: clinical applications and biological characterization. Int J Biochem Cell Biol. 2004;36:568-584. [PubMed] |
| 10. | Paunescu V, Deak E, Herman D, Siska IR, Tanasie G, Bunu C, Anghel S, Tatu CA, Oprea TI, Henschler R. In vitro differentiation of human mesenchymal stem cells to epithelial lineage. J Cell Mol Med. 2007;11:502-508. [PubMed] |
| 11. | Spees JL, Olson SD, Ylostalo J, Lynch PJ, Smith J, Perry A, Peister A, Wang MY, Prockop DJ. Differentiation, cell fusion, and nuclear fusion during ex vivo repair of epithelium by human adult stem cells from bone marrow stroma. Proc Natl Ac. ad Sci USA. 2003;100:2397-2402. [PubMed] |
| 12. | Ortiz LA, Gambelli F, McBride C, Gaupp D, Baddoo M, Kaminski N, Phinney DG. Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects. Proc Natl Acad Sci USA. 2003;100:8407-8411. [PubMed] |
| 13. | Kotton DN, Ma BY, Cardoso WV, Sanderson EA, Summer RS, Williams MC, Fine A. Bone marrow-derived cells as progenitors of lung alveolar epithelium. Development. 2001;128:5181-5188. [PubMed] |
| 14. | Kataoka K, Medina RJ, Kageyama T, Miyazaki M, Yoshino T, Makino T, Huh NH. Participation of adult mouse bone marrow cells in reconstitution of skin. Am J Pathol. 2003;163:1227-1231. [PubMed] |
| 15. | Poulsom R, Forbes SJ, Hodivala-Dilke K, Ryan E, Wyles S, Navaratnarasah S, Jeffery R, Hunt T, Alison M, Cook T. Bone marrow contributes to renal parenchymal turnover and regeneration. J Pathol. 2001;195:229-235. [PubMed] |
| 18. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] |
| 19. | Alison MR, Poulsom R, Jeffery R, Dhillon AP, Quaglia A, Jacob J, Novelli M, Prentice G, Williamson J, Wright NA. Hepatocytes from non-hepatic adult stem cells. Nature. 2000;406:257. [PubMed] |
| 20. | Shu SN, Wei L, Wang JH, Zhan YT, Chen HS, Wang Y. Hepatic differentiation capability of rat bone marrow-derived mesenchymal stem cells and hematopoietic stem cells. World J Gastroenterol. 2004;10:2818-2822. [PubMed] |
| 21. | Theise ND, Nimmakayalu M, Gardner R, Illei PB, Morgan G, Teperman L, Henegariu O, Krause DS. Liver from bone marrow in humans. Hepatology. 2000;32:11-16. [PubMed] |
| 22. | Li W, Liu SN, Luo DD, Zhao L, Zeng LL, Zhang SL, Li SL. Differentiation of hepatocytoid cell induced from whole-bone-marrow method isolated rat myeloid mesenchymal stem cells. World J Gastroenterol. 2006;12:4866-4869. [PubMed] |
| 23. | Ong SY, Dai H, Leong KW. Hepatic differentiation potential of commercially available human mesenchymal stem cells. Tissue Eng. 2006;12:3477-3485. [PubMed] |
| 24. | Lange C, Bruns H, Kluth D, Zander AR, Fiegel HC. Hepatocytic differentiation of mesenchymal stem cells in cocultures with fetal liver cells. World J Gastroenterol. 2006;12:2394-2397. [PubMed] |
| 25. | Lee KD, Kuo TK, Whang-Peng J, Chung YF, Lin CT, Chou SH, Chen JR, Chen YP, Lee OK. In vitro hepatic differentiation of human mesenchymal stem cells. Hepatology. 2004;40:1275-1284. [PubMed] |
| 26. | Cai YF, Zhen ZJ, Min J, Fang TL, Chu ZH, Chen JS. Selection, proliferation and differentiation of bone marrow-derived liver stem cells with a culture system containing cholestatic serum in vitro. World J Gastroenterol. 2004;10:3308-3312. [PubMed] |
| 27. | Yamazaki S, Miki K, Hasegawa K, Sata M, Takayama T, Makuuchi M. Sera from liver failure patients and a demethylating agent stimulate transdifferentiation of murine bone marrow cells into hepatocytes in coculture with nonparenchymal liver cells. J Hepatol. 2003;39:17-23. [PubMed] |
| 28. | Lange C, Bassler P, Lioznov MV, Bruns H, Kluth D, Zander AR, Fiegel HC. Hepatocytic gene expression in cultured rat mesenchymal stem cells. Transplant Proc. 2005;37:276-279. [PubMed] |
| 29. | Aurich I, Mueller LP, Aurich H, Luetzkendorf J, Tisljar K, Dollinger MM, Schormann W, Walldorf J, Hengstler JG, Fleig WE. Functional integration of hepatocytes derived from human mesenchymal stem cells into mouse livers. Gut. 2007;56:405-415. [PubMed] |
| 30. | Fang B, Shi M, Liao L, Yang S, Liu Y, Zhao RC. Systemic infusion of FLK1(+) mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice. Transplantation. 2004;78:83-88. [PubMed] |
| 32. | Jung J, Zheng M, Goldfarb M, Zaret KS. Initiation of mammalian liver development from endoderm by fibroblast growth factors. Science. 1999;284:1998-2003. [PubMed] |
| 33. | Shin D, Shin CH, Tucker J, Ober EA, Rentzsch F, Poss KD, Hammerschmidt M, Mullins MC, Stainier DY. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development. 2007;134:2041-2050. [PubMed] |
| 34. | Wells JM, Melton DA. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 2000;127:1563-1572. [PubMed] |
| 35. | Kamiya A, Kinoshita T, Ito Y, Matsui T, Morikawa Y, Senba E, Nakashima K, Taga T, Yoshida K, Kishimoto T. Fetal liver development requires a paracrine action of oncostatin M through the gp130 signal transducer. EMBO J. 1999;18:2127-2136. [PubMed] |
| 36. | Taga T, Kishimoto T. Gp130 and the interleukin-6 family of cytokines. Annu Rev Immunol. 1997;15:797-819. [PubMed] |
| 37. | Duncan SA. Mechanisms controlling early development of the liver. Mech Dev. 2003;120:19-33. [PubMed] |
| 38. | Michalopoulos GK, Bowen WC, Mule K, Luo J. HGF-, EGF-, and dexamethasone-induced gene expression patterns during formation of tissue in hepatic organoid cultures. Gene Expr. 2003;11:55-75. [PubMed] |
| 39. | Kamiya A, Kinoshita T, Miyajima A. Oncostatin M and hepatocyte growth factor induce hepatic maturation via distinct signaling pathways. FEBS Lett. 2001;492:90-94. [PubMed] |
| 40. | Miyajima A, Kinoshita T, Tanaka M, Kamiya A, Mukouyama Y, Hara T. Role of Oncostatin M in hematopoiesis and liver development. Cytokine Growth Factor Rev. 2000;11:177-183. [PubMed] |
| 41. | Ito Y, Matsui T, Kamiya A, Kinoshita T, Miyajima A. Retroviral gene transfer of signaling molecules into murine fetal hepatocytes defines distinct roles for the STAT3 and ras pathways during hepatic development. Hepatology. 2000;32:1370-1376. [PubMed] |
| 43. | Jin DK, Vacher J, Feuerman MH. alpha-Fetoprotein gene sequences mediating Afr2 regulation during liver regeneration. Proc Natl Acad Sci USA. 1998;95:8767-8772. [PubMed] |
| 44. | Chou JY. Regulators of fetal liver differentiation in vitro. Arch Biochem Biophys. 1988;263:378-386. [PubMed] |
| 45. | Shelly LL, Tynan W, Schmid W, Schutz G, Yeoh GC. Hepatocyte differentiation in vitro: initiation of tyrosine aminotransferase expression in cultured fetal rat hepatocytes. J Cell Biol. 1989;109:3403-3410. [PubMed] |
| 47. | Castro-Malaspina H, Gay RE, Resnick G, Kapoor N, Meyers P, Chiarieri D, McKenzie S, Broxmeyer HE, Moore MA. Characterization of human bone marrow fibroblast colony-forming cells (CFU-F) and their progeny. Blood. 1980;56:289-301. [PubMed] |
| 48. | Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs. Exp Hematol. 1976;4:267-274. [PubMed] |
| 49. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 50. | Shi XL, Qiu YD, Wu XY, Xie T, Zhu ZH, Chen LL, Li L, Ding YT. In vitro differentiation of mouse bone marrow mononuclear cells into hepatocyte-like cells. Hepatol Res. 2005;31:223-231. [PubMed] |
| 51. | 金 钧, 黄 坚, 吴 思荣, 惠 国桢. 人骨髓间充质干细胞体外优化条件的研究. 苏州大学学报(医学版). 2006;26:182-184. |