修回日期: 2007-11-10
接受日期: 2007-11-28
在线出版日期: 2007-12-08
目的: 观察牛黄酸与维生素C对慢性砷暴露小鼠肝组织DNA损伤的保护作用.
方法: 将小鼠40只随机分为4组, 即: 染砷组(4 ppm As2O3)、牛黄酸保护组(4 ppm As2O3)+150 mg/kg牛黄酸)、维生素C保护组(4 ppm As2O3+45 mg/kg维生素C)以及生理盐水对照组, 用HE染色法进行组织病理学观察, 用免疫组化及图像分析检测肝组织内8-OH-dG的水平.
结果: 染砷组小鼠肝组织出现胞质疏松化和气球样变等病理学改变, 牛黄酸和维生素C保护组肝组织上述病理学变化较轻. 免疫组化结果表明, 染砷组肝组织呈现8-OH-dG的高表达(P<0.01). 两保护组小鼠肝组织8-OH-dG的表达显著低于染砷组(P<0.01), 其中牛黄酸保护组小鼠肝组织8-OH-dG免疫染色总光密度值(0.824±0.1062)显著低于维生素C保护组(246.7±61.81, P = 0.012).
结论: 牛黄酸和维生素C对慢性砷暴露小鼠肝组织DNA损伤具有保护作用, 其中牛黄酸的保护作用更明显.
引文著录: 刘爽, 朴丰源, 曲淑贤, 孙鲜策, 姚晓峰, 叶建新, 李秋娟. 牛黄酸与维生素C对慢性砷暴露小鼠肝组织DNA损伤的保护作用. 世界华人消化杂志 2007; 15(34): 3567-3571
Revised: November 10, 2007
Accepted: November 28, 2007
Published online: December 8, 2007
AIM: To observe the protective effects of taurine and vitamin C on liver DNA damage in mice chronically exposed to arsenic (As).
METHODS: Forty mice were divided into 4 groups: As group (4 ppm As2O3), taurine protective group (4 ppm As2O3 + 150 mg/kg taurine), vitamin C protective group (4 ppm As2O3 + 45 mg/kg vitamin C), and normal saline group as controls. Liver tissues were obtained and HE staining was performed, 8-OH-dG expression was examined by immunohistochemistry.
RESULTS: Liver cells in mice in the As-treated groups showed swelling and ballooning degeneration. 8-OH-dG was strongly expressed in these groups compared with the control group (P < 0.01). The two protective groups showed mild damage with lower 8-OH-dG levels than the As group. The total optical density of 8-OH-dG immunohistochemical staining in the taurine protective group was lower than that in the vitamin C protective group (0.824 ± 0.1062 vs 246.7 ± 61.81, P = 0.012).
CONCLUSION: Mouse livers showed severe tissue injuries and DNA oxidative damage after long-term As exposure. Taurine and vitamin C alleviated this damage significantly, with the taurine group showing better recovery than the vitamin C group.
- Citation: Liu S, Piao FY, Qu SX, Sun XC, Yao XF, Ye JX, Li QJ. Protective effects of taurine and vitamin C on liver DNA damage in mice chronically exposed to arsenic. Shijie Huaren Xiaohua Zazhi 2007; 15(34): 3567-3571
- URL: https://www.wjgnet.com/1009-3079/full/v15/i34/3567.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i34.3567
砷是一种常见的环境毒物和已知的人类致癌物. Lu et al[1]对贵州燃煤型砷中毒患者的肝脏活检中发现, 肝组织有明显退化、变性等病理变化. Santra et al[2]对248例饮水型砷中毒患者调研发现, 190例有肝脏肿大, 91.3%显示有非硬化性汇管区纤维化的改变. 但是, 砷对肝脏的毒性作用机制尚不清楚. 目前认为, 过量砷暴露可使机体产生过量活性氧族(Reactive oxygen species, ROS), 导致组织细胞的DNA损伤很可能是砷的毒作用机制之一. 因此, 通过拮抗剂对砷的毒性作用进行干预, 使机体生物大分子免受损伤是预防砷的毒性作用的研究重点. 本研究以小鼠为研究对象, 以8-羟基脱氧鸟嘌呤(8-OH-dG)作为砷毒性导致DNA损伤标志物, 以牛黄酸和维生素C作为拮抗剂, 通过免疫组化方法, 观察拮抗剂对砷暴露小鼠肝组织DNA损伤的保护作用, 为砷毒性损伤肝脏的预防和治疗提供实验动物依据.
As2O3(Sigma, 美国), 牛黄酸(北京奥博星生物技术责任有限公司), 抗8-OH-dG mAb(Fukuroi, 日本), UltrasensitiveTM S-P超敏试剂盒及DAB显色试剂盒(福州迈新生物技术开发有限公司), 其他试剂均为分析纯. 石蜡切片机(YD-1508B, 浙江省金华市益迪医疗设备厂)、万用光学显微镜(Olympus BX-51, 日本)、数码相机(Kodak DC290, 日本)、图像分析处理系统(Image-pro plus 4.5). 健康昆明种小鼠40只, 雌雄各半, 体质量20±2 g, 由大连医科大学实验动物中心提供. 按体质量将小鼠随机分为4组: 染毒组 (4 ppm As2O3), 牛黄酸保护组(4 ppm As2O3+150 mg/kg牛黄酸), 维生素C保护组(4 ppm As2O3+45 mg/kg维生素C), 生理盐水对照组. 小鼠正常饮食, 室温18-22℃, 通过自然饮用含不同浓度As2O3蒸馏水的方式使小鼠暴露于砷. 保护剂是以灌胃方式投给, 每星期2次. 每天换水, 连续染毒60 d, 断头处死小鼠后立即取肝组织固定.
1.2.1 组织形态学观察: 肝组织经40 g/L甲醛固定后, 常规石蜡包埋, 5 μm连续切片, 在65℃ 温箱中烤片60 min, 苏木素-伊红(HE)染色, 光镜下进行组织形态学观察.
1.2.2 免疫组织化学观察: 按照S-P免疫组化染色法, 将未经HE染色的切片常规二甲苯脱蜡后, 在肝组织切片上滴1:300稀释的鼠抗人8-OH-dG mAb, 在4℃条件下孵育过夜, 然后按UltrasensitiveTM S-P超敏试剂盒的步骤进行, DAB显色, 苏木素复染细胞核, 自来水冲洗返蓝. 常规脱水、透明, 中性树胶封片. 阅片时, 先观察整张切片, 再随机选择不同区域的五个高倍视野, 显微镜下拍照, 并应用图像分析软件对8-OH-dG表达的总光密度值进行定量的分析.
统计学处理 采用SPSS10.0统计软件, 计量资料用mean±SD表示. 用单因素方差分析(ANOVA)比较各实验组与对照组间的统计学差异, 以P<0.05表示差异显著.
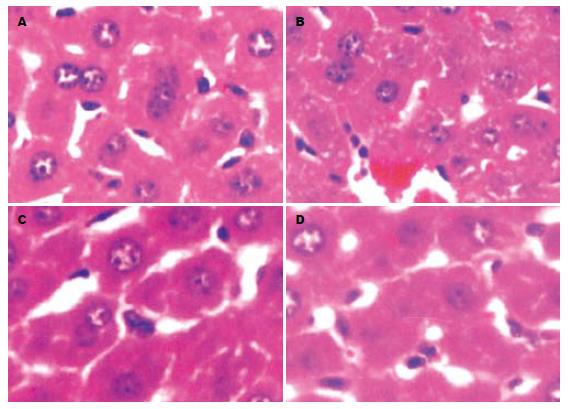
光镜观察的结果显示, 对照组小鼠肝组织病理变化未见异常, 而染砷组小鼠肝组织出现不同程度的肝细胞变性, 可见肝细胞明显肿大, 胞质疏松呈网状、半透明, 肝细胞索排列紊乱、拥挤, 肝窦受压变窄, 偶见细胞核固缩等病理学改变. 牛黄酸和维生素C保护组小鼠肝细胞肿胀较轻, 未见核固缩(图1).
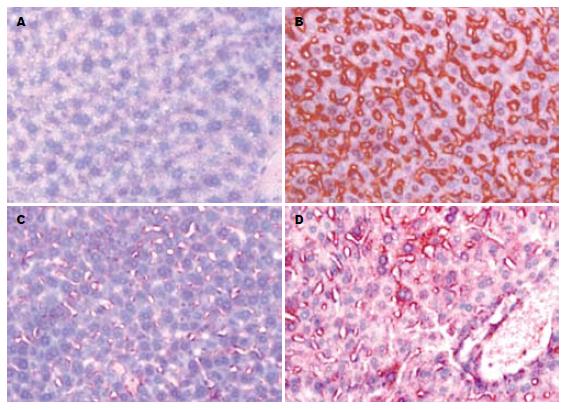
对照组小鼠肝组织细胞中几乎无8-OH-dG的表达, 染砷组细胞核内出现较多的棕褐色抗8-OH-dG阳性颗粒, 表明8-OH-dG呈现明显的高表达(图2). 而两保护组小鼠肝组织8-OH-dG的表达较少. 各组小鼠肝细胞抗8-OH-dG免疫组化染色总光密度检测结果如表1所示. 染砷组抗8-OH-dG免疫组化染色总光密度值明显高于对照组, 具有显著性差异(P<0.01), 而牛黄酸及维生素C保护组的总光密度值明显低于染砷组(P<0.01).其中牛黄酸的保护效果明显好于维生素C(P = 0.012).
慢性砷暴露可造成机体多器官损伤, 而肝脏是砷毒性作用的靶器官之一[3-6]. Guha Mazumder发现, 长期摄入高砷水可引起氧化性损伤, 导致小鼠肝脏脂肪浸润和纤维化[7]. Gupta也报道了小鼠腹膜内砷暴露可引起氧化性指标的升高并伴随多种抗氧化酶水平的降低[8]. 但关于慢性低剂量砷暴露与小鼠肝脏DNA氧化损伤之间的关系还未见报道.
动物细胞在应激条件下可以产生ROS. 当其生成作用大于机体的清除作用时, ROS升高并造成细胞的膜脂质、蛋白质和DNA的氧化损伤[9-10]. 由于DNA的抗氧化能力不如膜脂质和蛋白质, DNA氧化产物的测定对于体内氧化损伤程度的估计是比较敏感的[11]. DNA中的脱氧鸟嘌呤最容易被ROS氧化而生成8-OH-dG, 因此8-OH-dG可作为由ROS诱导的DNA损伤的特异性标记物. 本实验发现慢性砷暴露小鼠肝组织8-OH-dG的水平增高, 提示砷可通过ROS引起肝组织DNA损伤. 而8-OH-dG主要集中在细胞核内, 细胞质内染色很少, 这是因为dG主要在细胞核内表达.
病理学观察可见染砷组小鼠肝组织出现细胞变性, 胞质疏松化和气球样变及核固缩等病理学改变. 使用牛黄酸和维生素C保护组小鼠肝组织的病理变化相对较少, 肝细胞水肿程度较轻、范围较小, 未见核固缩. 结果显示, 染砷组8-OH-dG表达较强, 病理损伤也较重, 提示砷可能通过氧化性损伤造成肝脏的病理损害.
由于我们之前的研究已表明氧化应激参与砷的神经毒性作用[12], 因此抑制或改善氧化应激是一种合理的干预途径. 近期有报道将维生素C加入透析用水可明显降低血液透析患者体内OX-LDL水平, 改善氧化应激状态[13]. 我们用灌胃的方式给小鼠补充维生素C, 观察到小鼠肝细胞8-OH-dG表达较砷暴露组少, 说明维生素C能增强染砷小鼠的抗氧化能力. 维生素C减轻氧化应激的机制可能为, 维生素C作为自由基的清除剂, 可能与超氧阴离子(O2-)、过氧化氢(H2O2)和羟自由基(OH-)反应, 保护机体免受内源性氧自由基的损伤. 在本实验中, 牛黄酸较维生素C对肝组织的保护作用强, 8-OH-dG的表达也显著降低. 牛黄酸是一种含硫的β氨基酸, 有多种生物效应, 如降低小鼠脑组织中脂褐质的含量, 清除脂质过氧化物代谢产物丙二醛(MDA), 提高超氧化物歧化酶(SOD)的活性等[14]. 可能SOD通过清除氧自由基起到对DNA的保护作用. 此外, 在胆汁的合成过程中, 牛黄酸的巯基也可能与组织中的砷发生螯合作用, 促进砷硫化合物在肝脏中的排泄[15].
总之, 使用牛黄酸和维生素C可以缓解砷介导的机体氧化性肝损伤, 并且进一步证实了ROS在肝脏砷毒性中的作用. 所以及早投放保护剂可以减轻或预防慢性低剂量砷暴露所致的机体损伤.
砷是一种常见的环境毒物, 全世界有超过200万人饮用砷超标的水(我国现行饮水卫生标准<0.05 ppm)而造成各种疾病. 因此, 其损伤机制和防治的研究十分重要.
本文以8-羟基脱氧鸟嘌呤作为砷毒性导致DNA损伤的标志物, 观察到氧化损伤是砷肝损伤的机制之一. 牛黄酸和维生素C有较好的保护作用, 为砷损害的防治提供了依据.
本文选题新颖, 设计基本合理, 统计方法正确, 有一定创新. 获得的结果对砷暴露肝损伤的防治提供了一定的理论和实践价值的参考资料, 但文章撰写的严谨性和逻辑性方面稍有欠缺.
编辑: 程剑侠 电编:马文华
| 1. | Lu T, Liu J, LeCluyse EL, Zhou YS, Cheng ML, Waalkes MP. Application of cDNA microarray to the study of arsenic-induced liver diseases in the population of Guizhou, China. Toxicol Sci. 2001;59:185-192. [PubMed] |
| 2. | Santra A, Das Gupta J, De BK, Roy B, Guha Mazumder DN. Hepatic manifestations in chronic arsenic toxicity. Indian J Gastroenterol. 1999;18:152-155. [PubMed] |
| 3. | Centeno JA, Mullick FG, Martinez L, Page NP, Gibb H, Longfellow D, Thompson C, Ladich ER. Pathology related to chronic arsenic exposure. Environ Health Perspect. 2002;110 Suppl 5:883-886. [PubMed] |
| 5. | Waalkes MP, Ward JM, Diwan BA. Induction of tumors of the liver, lung, ovary and adrenal in adult mice after brief maternal gestational exposure to inorganic arsenic: promotional effects of postnatal phorbol ester exposure on hepatic and pulmonary, but not dermal cancers. Carcinogenesis. 2004;25:133-141. [PubMed] |
| 7. | Mazumder DN. Effect of chronic intake of arsenic-contaminated water on liver. Toxicol Appl Pharmacol. 2005;206:169-175. [PubMed] |
| 8. | Gupta R, Dubey DK, Kannan GM, Flora SJ. Concomitant administration of Moringa oleifera seed powder in the remediation of arsenic-induced oxidative stress in mouse. Cell Biol Int. 2007;31:44-56. [PubMed] |
| 9. | Stadtman ER, Berlett BS. Reactive oxygen-mediated protein oxidation in aging and disease. Drug Metab Rev. 1998;30:225-243. [PubMed] |
| 10. | Farinati F, Cardin R, Bortolami M, Guido M, Rugge M. Oxidative damage, pro-inflammatory cytokines, TGF-alpha and c-myc in chronic HCV-related hepatitis and cirrhosis. World J Gastroenterol. 2006;12:2065-2069. [PubMed] |
| 11. | Akagi S, Nagake Y, Kasahara J, Sarai A, Kihara T, Morimoto H, Yano A, Nakao K, Nanba K, Ichikawa H. Significance of 8-hydroxy-2'-deoxyguanosine levels in patients with chronic renal failure. Nephrology (Carlton). 2003;8:192-195. [PubMed] |
| 12. | Piao F, Ma N, Hiraku Y, Murata M, Oikawa S, Cheng F, Zhong L, Yamauchi T, Kawanishi S, Yokoyama K. Oxidative DNA damage in relation to neurotoxicity in the brain of mice exposed to arsenic at environmentally relevant levels. J Occup Health. 2005;47:445-449. [PubMed] |
| 13. | Shi XF, Ding F, Zhu QY, Xue J, Lu FM, Gu Y, Lin ST. Use of ascorbate-rich dialysate to attenuate oxidative stress in maintenance hemodialysis patients. Ren Fail. 2005;27:213-219. [PubMed] |
| 15. | Quig D. Cysteine metabolism and metal toxicity. Altern Med Rev. 1998;3:262-270. [PubMed] |