修回日期: 2007-11-15
接受日期: 2007-11-28
在线出版日期: 2007-11-28
目的: 研观察过氧化物酶体增殖物激活受体γ(PPARγ)表达上调对肝星状细胞增殖及凋亡的影响.
方法: 体外培养HSC-T6细胞, 取对数生长期的细胞, 应用1, 2, 3 μmo/L不同浓度的PPARγ激动剂15d-PGJ2作用24 h. 同时以不加药物只加无血清培养基作为对照组, 24 h后应用RT-PCR的方法观察分析各组间肝星状细胞PPARγ mRNA表达的变化, MTT检测HSC增殖, 流式细胞仪分析HSC-T6细胞凋亡.
结果: 经1, 2, 3 μmo/L 15d-PGJ2处理的HSC-6细胞中PPARγ mRNA表达比例上调(0.513±0.031, 0.697±0.018, 0.674±0.032 vs 0.198±0.021). MTT结果显示不同浓度的15d-PGJ2对HSC-T6细胞的增殖均有抑制作用, 以2 μmol/L
组最为显著(54.6%±11.1%). 流式细胞仪结果显示15d-PGJ2处理组凋亡细胞数明显增多.
结论: PPARγ表达上调能够抑制HSC-T6增殖并诱导其凋亡.
引文著录: 陈瑞, 杨胜兰. PPARγ表达上调体外抑制肝星状细胞的增殖. 世界华人消化杂志 2007; 15(33): 3527-3530
Revised: November 15, 2007
Accepted: November 28, 2007
Published online: November 28, 2007
AIM: To evaluate the effect of up-regulated expression of peroxisome proliferators-activated receptor (PPAR)γ on hepatic stellate cell (HSC) apoptosis and proliferation.
METHODS: The rat hepatic stellate cell line (HSC-T6) was cultured in DMEM, and treated with PPARγ agonist 1, 2, 3 μmol/L 15d-PGJ2 for 24 h. The proliferation rate for HSC-T6 cells was determined in 15d-PGJ2-treated and control groups by the MTT colorimetric assay. The cell cycle and apoptosis ratio were measured by flow cytometry.
RESULTS: The expression of PPARγ mRNA in HSC-T6 cells treated with 1, 2, 3 μmol/L 15d-PGJ2 was increased (0.513 ± 0.031, 0.697 ± 0.018, 0.674 ± 0.032 vs 0.198 ± 0.021), and the proliferation of HSC-T6 cells was significantly inhibited by 15d-PGJ2, especially at a concentration of 2 μmol/L (54.6% ± 11.1%). In addition, flow cytometry suggested that the apoptosis was significantly increased in HSC-T6 cells treated with 15d-PGJ2.
CONCLUSION: Up-regulated expression of PPARγ can inhibit proliferation and induce apoptosis of HSC cells.
- Citation: Chen R, Yang SL. Inhibition of proliferation of hepatic stellate cells by up-regulation of peroxisome proliferator-activated receptor γ. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3527-3530
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3527.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3527
肝纤维化是各种原因引起的慢性肝损伤所共有的病理过程. 肝星状细胞的激活、增殖及细胞外基质的沉积是肝纤维化的重要环节. 近年有学者观察到肝纤维化组织中PPARγ表达明显下调, 与纤维化程度存在某种相关关系[1]. 目前已知PPARγ存在多种配体及激活物, 大致可分为合成型配体和天然型配体两大类. PPARγ的天然配体多为前列腺素代谢产物, 如PGD2, PGJ2, 15-deDxy-D12.14-PGJ2等. 另外, 不饱和脂肪酸、氧化低密度脂蛋白也可以作为PPARγ的天然配体, 发挥他们的生理作用[2]. 我们通过PPARγ的激动剂15d-PGJ2上调PPARγ表达观察其对HSC增殖凋亡的影响, 旨在探讨其对HSC增殖凋亡的调节机制, 为将来指导抗肝纤维化治疗提供实验基础.
大鼠肝星状细胞株HSC-T6购自上海中医药大学肝病研究所. PPARγ的激动剂15d-PGJ2为美国Caymen公司产品, 购自晶美公司,溶于二甲基亚砜, 并充入氮气于-20℃保存. 其余分生试剂均为Promega公司产品. 大鼠肝星状细胞株HSC-T6生长于体积分数为100 mL/L小牛血清及1×105 U/L青霉素、100 mg/L链霉素的DMEM培养液中, 在37℃, 50 mL/L CO2、水饱和蒸汽的条件下进行培养. 分为对照组、15d-PGJ2处理组. 处理组加入浓度分别为1, 2, 3 μmol/L 15d-PGJ2, 以不加药物而加等体积的无血清培养基为对照组.
1.2.1 RT-PCR检测PPARγmRNA的表达: 各取1×106细胞, 按TRIzol试剂盒说明书用一步法提取总RNA, 测定RNA的浓度及纯度. 逆转录反应条件参照试剂盒说明, 将逆转录产物5 μL加入PCR反应液中, PCR反应液如下: 10×buffer 5 μL, 25 mmol/L MgCl2 3 μL ,目的引物各2 μL, 10 mmol/L dNTP 1 μL, 用无菌水补足20 μL体积. PCR反应条件为95℃变性5 min后, 按95℃ 1 min变性, 55℃ 1 min退火, 72℃ 2 min延伸3步组成的32个循环, 最后72℃延伸10 min, 反应物经凝胶电泳检测. PPARγ的引物序列为上游引物: 5'-TGATATCG CCACTGGAACC-3', 下游引物: 5'-GTCCTCTCAGCTGTTCGCCA-3', β-actin 上游引物: 5'-ATCATGTTTGAGACCTTTCAACA-3', 下游引物: 5'-CACCTCTTTGCTCCGAAGTCCAA-3'. PCR反应产物10 μL凝胶电泳显像, 应用美国UVP公司的凝胶成像系统(GDAS-1200)行荧光灰度分析, 用β-actin作内参, 进行半定量分析.
1.2.2 MTT法检测细胞增殖: MTT试剂用PBS配成5 g/L的溶液, 过滤除菌备用. 取对数生长期的HSC-T6细胞, 用0.1 g/L EDTA消化后制成5×108/L的细胞悬液, 以每孔200 μL接种于96孔平底培养板上, 置于37℃、50 mL/L CO2及饱和湿度的培养箱中, 24 h后加入不同浓度的15d-PGJ2. 以不加药物而加等体积的无血清培养基为空白对照组. 每组设3个复孔, 分别于24, 48, 72 h时每孔加入5 g/L的MTT 10 μL, 并于37℃温育4 h后小心吸弃上清, 每孔加入10% DMSO 100 μL充分混匀, 用TRCAN酶标仪(American research公司产品)于570 nm处测吸光度值A值, 以3个复孔的平均A值为相应的A值. 抑制率(%) = (空白孔平均A值-加药组平均A值)/空白孔平均A值×100%.
1.2.3 流式细胞仪检测15d-PGJ2对HSC-T6细胞凋亡的影响: 取对数生长期细胞, 加入不同浓度的15d-PGJ2. 以仅加入等体积的无血清培养基作为对照组. 作用48 h, 分别收集各组细胞. 每组设立3份标本重复, 具体实验步骤如下. 配置PI染液, 浓度为100 mg/L, 加入RNase100 mg/L, 4℃避光保存, 收集各组细胞2×106/L, 500-1000 r/min, 5 min去上清, 磷酸盐缓冲液(PBS)3 mL洗涤1次, 将细胞团缓慢加入700 mL/L乙醇固定4 h, PBS洗去固定液, 400钼筛网过滤, 500-1000 r/min离心5 min去上清, 加入碘化丙锭(PI)染液混匀, 4ºC避光作用30 min, 用FACS400型流式细胞仪进行检测, 观察细胞凋亡情况.
对照组及不同浓度15d-PGJ2作用组细胞中均有PPARγmRNA的表达. 随着15d-PGJ2作用浓度的增加, PPARγmRNA表达增强, A值分别为0.513±0.031, 0.697±0.018, 0.674±0.032. 且同对照组(A值为0.198±0.021)相比, 经方差分析检验, 差异性有显著性意义(图1).
48 h时1, 2, 3 μmol/L 15d-PGJ2对HSC-T6细胞增殖的抑制率分别为24.3%±8.3%, 54.6%±11.1%, 57.2%±16.8%. 2 μmol/L 15d-PGJ2的浓度即出现较明显的抑制作用. 与3 μmol/L 15d-PGJ2相比, 其抑制率并没有显著性差异(P>0.05), 表明剂量加大并不能明显增加抑制作用. 同时观察到抑制率也呈现出一定的时间依赖性, 15d-PGJ2处理组细胞在24 h后增殖速度即开始减缓, 48 h抑制率达高峰(表1).
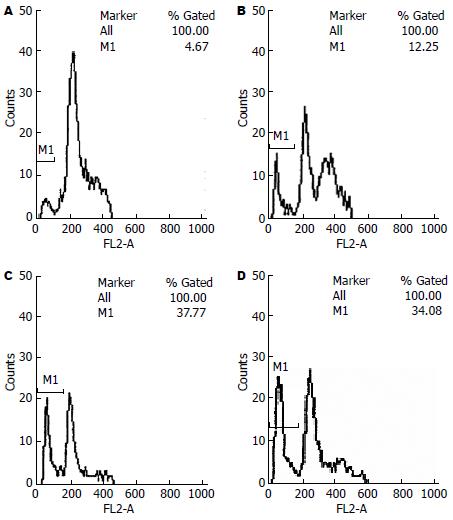
15d-PGJ2处理组细胞在G1峰左侧均有一凋亡峰, 分别有12.32%±1.24%, 30.74%±6.09%, 30.56%±5.44%的细胞凋亡. 而对照组细胞此凋亡峰不明显, 仅有3.36%±1.87%的细胞产生凋亡, 差异有显著性意义(P<0.05, 图2).
细胞凋亡是机体内细胞生理性的调节机制, 通过凋亡清除多余和有害的细胞, 与细胞分裂增殖一起调控组织器官的细胞数目, 保证机体的正常发育. 研究发现, 在肝纤维化进展过程中HSC有丝分裂及凋亡均增加, 但以增殖为主. 而在逆转阶段凋亡占优势, 使HSC失去净增加, HSC凋亡与转化激活状态密切相关. 对这一过程的调控机制尚无一致的定论[3]. 近年来对肝纤维化形成的机制的研究取得了令人鼓舞的进展. 越来越多的临床及实验证据表明, 肝纤维化是可逆转的病变, 这一观点逐渐被广泛接受. 肝星状细胞的激活是肝纤维化形成的中心环节, HSC在肝纤维化逆转过程中的作用亦成为研究的热点. HSC激活后大量增殖, 并可以自分泌的方式维持这种增殖与活化的持续. 那么, 活化的HSC命运如何, 是否从激活状态转变为静止的状态? 是否通过死亡或凋亡的方式减少数量, 从而使肝纤维化逐渐被吸收, 病理过程发生逆转? 这些问题一直是目前研究的关注焦点之一. 有学者认为, 肝纤维化逆转时HSC的减少是由于激活状态的HSC转化为静止状态[3]. 但最新研究表明, 肝纤维化恢复期, 激活状态的HSC主要是通过凋亡机制, 而不是表型的转化[4]. 了解HSC凋亡的机制, 并通过一定方式诱导活化的HSC凋亡, 在肝纤维化发生机制与治疗中具有重要意义.
已知PPARγ在脂肪组织中高表达, 主要参与脂质代谢. 近来发现PPARγ在多种组织中都有表达, 不仅参与炎症过程, 还可调节细胞增殖分化,在肿瘤细胞的凋亡机制中亦发挥一定作用. 我们利用配体激动剂15d-PGJ2上调HSC中PPARγ的表达, 发现随着PPARγ的表达上调, HSC细胞增殖速度减慢, PPARγ对HSC的增殖速度影响有一定的剂量依赖和时间依赖性, 在2 μmol/L 15d-PGJ2浓度下即可发挥最大抑制效应. 抑制作用发挥亦有一定的时间限制性, 在48 h时抑制作用最为显著. 研究表明, 在持续纤维化肝损伤过程中HSC有丝分裂及凋亡均增加, 但增殖占优势, 故而使纤维化程度不断加剧. 而在肝纤维化逆转阶段, HSC凋亡占优势, 活化HSC绝对数量减少, 故而诱导HSC凋亡成为抗肝纤维化治疗的一种新策略[5]. 目前关于HSC凋亡机制尚未完全清楚. TNF-α, 胰岛素样生长因子-1, TGF-β等多种细胞因子都参与此过程[6]. 有学者发现Fas途径可诱导体外培养的HSC凋亡, 也有学者认为, 随着HSC的激活进程P53基因不断增加, 可能参与HSC的凋亡过程[7-8]. 除了上述凋亡调节基因的作用外, TNF-α对激活的HSC可产生凋亡诱导作用, 此作用可被转录因子NFκB所阻断[9]. 我们采用流式细胞仪的方法, 针对PPARγ表达上调后是否诱导HSC凋亡进行了进一步的研究. 结果表明随着PPARγ表达的上调, HSC凋亡率逐渐增加, 表明PPARγ一方面抑制HSC增殖; 另一方面诱导其凋亡, 从而发挥抗纤维化的作用. 这就为我们进一步进行抗纤维化治疗提供了新的切入点.
肝星状细胞的激活、增殖及细胞外基质的沉积是肝纤维化的重要环节. 过氧化物酶体增殖物激活受体γ(PPARγ)属核激素受体超家族成员之一, 是配体依赖性激活的核转录因子. 目前已知PPARγ存在多种配体及激活物,参与细胞增殖以及脂质代谢, 免疫炎症因子激活等生理调控机制.
有报道肝纤维化组织中PPARγ表达明显下调, 与纤维化程度存在某种相关关系. 越来越多证据表明PPARγ在肝脏代谢功能方面发挥重要调节作用, 其功能改变与一些肝脏疾病的发生发展显示有某种相关性.
本文通过PPARγ的激动剂15d-PGJ2上调PPARγ表达观察对HSC增殖凋亡的影响, 旨在探讨对HSC增殖凋亡的调节机制, 为将来指导抗肝纤维化治疗提供实验基础.
本文选题新颖, 观察指标较系统, 结论明确, 具有很强的学术价值和临床研究意义.
编辑: 何燕 电编:李海寅
| 1. | Mann DA, Smart DE. Transcriptional regulation of hepatic stellate cell activation. Gut. 2002;50:891-896. [PubMed] |
| 2. | Spiegelman BM. PPAR-gamma: adipogenic regulator and thiazolidinedione receptor. Diabetes. 1998;47:507-514. [PubMed] |
| 3. | Gong W, Pecci A, Roth S, Lahme B, Beato M, Gressner AM. Transformation-dependent susceptibility of rat hepatic stellate cells to apoptosis induced by soluble Fas ligand. Hepatology. 1998;28:492-502. [PubMed] |
| 4. | Di Sario A, Bendia E, Svegliati Baroni G, Ridolfi F, Casini A, Ceni E, Saccomanno S, Marzioni M, Trozzi L, Sterpetti P. Effect of pirfenidone on rat hepatic stellate cell proliferation and collagen production. J Hepatol. 2002;37:584-591. [PubMed] |
| 5. | Lang A, Schoonhoven R, Tuvia S, Brenner DA, Rippe RA. Nuclear factor kappaB in proliferation, activation, and apoptosis in rat hepatic stellate cells. J Hepatol. 2000;33:49-58. [PubMed] |
| 6. | Lang A, Brenner DA. Gene regulation in hepatic stellate cell. Ital J Gastroenterol Hepatol. 1999;31:173-179. [PubMed] |
| 7. | Gong W, Pecci A, Roth S, Lahme B, Beato M, Gressner AM. Transformation-dependent susceptibility of rat hepatic stellate cells to apoptosis induced by soluble Fas ligand. Hepatology. 1998;28:492-502. [PubMed] |
| 8. | Saile B, Knittel T, Matthes N, Schott P, Ramadori G. CD95/CD95L-mediated apoptosis of the hepatic stellate cell. A mechanism terminating uncontrolled hepatic stellate cell proliferation during hepatic tissue repair. Am J Pathol. 1997;151:1265-1272. [PubMed] |
| 9. | Hellerbrand C, Jobin C, Iimuro Y, Licato L, Sartor RB, Brenner DA. Inhibition of NFkappaB in activated rat hepatic stellate cells by proteasome inhibitors and an IkappaB super-repressor. Hepatology. 1998;27:1285-1295. [PubMed] |