修回日期: 2007-10-25
接受日期: 2007-10-28
在线出版日期: 2007-11-28
IκB激酶家族(IκB kinases, IKKs)是NF-κB信号途径最为重要的成员之一, 已发现其在先天性免疫以及炎症反应的调节中发挥关键作用. 除IKKα/β/γ之外, 作为IKKs的最新成员, IKKε不仅具有与IKKα/β/γ类似的作用, 而且最近的研究数据证实IKKε还能通过凋亡蛋白抑制物(inhibitor of apoptosis proteins, IAPs)调节caspases的活性, 参加caspases的凋亡和非凋亡依赖性信号途径.
引文著录: 曾朋, 邓欢, 刘亮明. IκB激酶家族新成员: IKKε. 世界华人消化杂志 2007; 15(33): 3524-3526
Revised: October 25, 2007
Accepted: October 28, 2007
Published online: November 28, 2007
IκB kinases (IKKs) are vital components of the nuclear factor-κB signaling pathway, which play an important role in innate immune and inflammation responses. The newest member of the IKKs is IKKε, which has similar functions to IKKα/β/γ and can act as a regulator of caspases by interacting with IAPs. Therefore, IKKs are a determinant of IAP level, and establish the threshold of activity required for the execution of non-apoptotic caspase functions.
- Citation: Zeng P, Deng H, Liu LM. New member of the IκB kinases: IKKε. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3524-3526
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3524.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3524
IκB激酶家族(IκB kinases, IKKs)作为NF-κB信号途径的关键成员, 在先天性免疫以及炎症反应中发挥重要的作用. 之前发现的IKK家族成员能相互作用形成IKKα/β/γ复合物. IKKα/β/γ复合物能磷酸化IκB上的特定位点, 从而使IκBα泛素化并最终被蛋白酶体降解, 解除IκB对NF-κB的抑制. 游离的NF-κB从胞质转移入细胞核, 激活干扰素(IFN)的转录, 并出现后续的先天性免疫以及炎症反应. 但是随着IKK家族新成员IKKε的发现及其生物功能研究的不断深入, 对IKK家族作用的认识不再局限于NF-κB信号途径.
Peters et al[1]发现利用佛波酯(phorbol esters, PMA)处理的细胞内, 除IKKα/β/γ复合物以外, 还存在另外一种IκB激酶复合物. 这种复合物包含一种全新的IκB激酶: IKKε.
Peterset通过对氨基酸序列的分析发现, IKKε与IKKα/β/γ之间有非常高的同源性, 他们在N末端的相似位置都包含一个特殊的激酶功能结构域, 而在C末端则是一个螺旋-螺旋模体(motif). 研究同时还发现IKKε高表达于胸腺、脾、外周血白细胞以及富含活化T细胞的细胞群中. 这些研究结果都表明IKKε可能与IKKα/β/γ具有类似的作用, 在细胞先天性免疫和炎症反应中都起重要的作用. 在之后的实验中得到进一步证实, 功能结构域失活的突变型IKKε对于TNFα以及IL-1途径诱导的NF-κB活化影响甚小, 却能以浓度依赖的方式阻断PMA诱导的T细胞受体(T cell receptor, TCR)途径的T细胞活化[1]. IKKα/β/γ可以磷酸化IκBα上的第32位丝氨酸(Serine 32, S32)和第36位丝氨酸(Serine 36, S36), 从而使IκBα泛素化. 重组的IKKε在体外实验中只能磷酸化S32, 而在利用PMA处理的Jurkat T细胞中却可以观察到S32/S36与IKKε抗体产生免疫共沉淀[2]. 但其具体机制还不清楚, 可能是因为内源性的IKKε还能通过蛋白-蛋白方式直接或间接作用于IκBα S36.
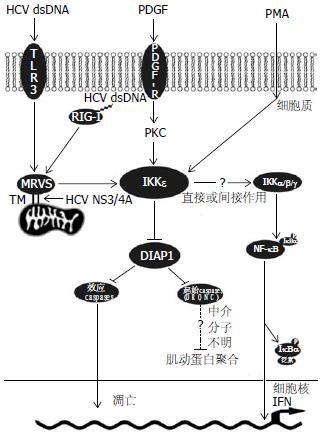
目前对IKKε的功能了解较少, 特别是与他相互作用的上游信号分子. 最近, 4个独立的研究小组同时发现一种全新的细胞内信号蛋白: 线粒体抗病毒信号(mitochondrial antiviral signaling, MAVS)蛋白[3]. MAVS通过C末端一个保守的疏水跨膜(transmembrane, TM)结构域定位于线粒体外膜, 这也是迄今发现的第一个参与细胞先天性免疫和炎症反应的线粒体蛋白. 进一步的研究发现IKKε可与MAVS一起定位于线粒体[4], 表明MAVS与IKKε可能处于同一信号途径, 并且IKKε就是MAVS直接的下游效应物之一. 乙型肝炎病毒(HCV)的非结构(nonstructral, NS)蛋白NS3/4A也能与MAVS共同定位于线粒体外膜, 并利用自身蛋白激酶活性裂解TM结构域内的第508位半胱氨酸(Cys-508), 从而破坏MAVS的生物学功能以及MAVS与IKKε之间的相互作用, 最终入侵机体免疫系统[5]. IKKε是HCV逃避细胞免疫的重要靶物之一, 也反映出IKKε在先天性免疫和炎症反应中的重要作用.
Kravchenko et al[6]的实验结果还表明, IKKε可能是连接NF-κB信号途径与另外一条经典的先天免疫和炎症反应信号途径: C/EBP途径的关键枢纽. 在利用LPS处理的IKKε -/-细胞中, C/EBPΔ的活化以及C/EBP的转录都显著降低. 同时, C/EBPβ/Δ还能直接与IKKε的启动子结合, 两者间存在精确的负反馈调节机制. 而在此前一直未发现NF-κB途径与C/EBP途径相关联的直接证据. IKKε的出现为先天免疫和炎症反应的研究指明了新的方向.
caspases是凋亡信号途径中最重要的蛋白之一, 为凋亡的最终执行者. caspases利用自身酶活性造成凋亡细胞功能和形态上的改变. 凋亡蛋白抑制物(inhibitor of apoptosis proteins, IAPs)能通过BIR模序以及最新发现的RING模序与caspases结合, 同时利用RING模序结合E2泛素连接酶的特性, 直接使caspases泛素化, 并被蛋白酶体降解从而抑制细胞凋亡的发生, 调节细胞存亡的平衡[7]. 最近, Kuranaga et al[8]证实果蝇IKKε(Drosophila IKKε, DmIKKε)能够直接与果蝇IAP1(Drosophila IAP1, DIAP1)结合并使之磷酸化, 磷酸化的DIAP1失去了抑制caspases的能力, 促进了细胞凋亡. 这一发现的重要意义在于IKKε可能将成为细胞命运的另一个决策者. 但是, 只有当DmIKKε过表达的量达到一定的程度时才会出现促进凋亡的表型, 正常范围附近的波动不足以引起细胞活性明显的改变, 表明DmIKKε与DIAP1和caspases相关联的主要目的可能不是影响凋亡进程. 最新的研究发现, IAPs和caspases的功能并不仅仅局限于凋亡信号途径, 他们还具有调控细胞增殖、分化、形态发生等非凋亡依赖作用[9-10]. 而Oshima et al[11]发现DmIKKε可以通过抑制DIAP1来活化一种启始caspase(apical caspase): 含有补充结构域的果蝇caspase(recruitment domain-containing Drosophila caspase, DRONC). 一方面, DRONC可以通过活化Shaggy激酶的一个特定亚型, 参与果蝇感觉器官前体的分化; 另一方面, DRONC还能以间接的方式调节F肌动蛋白(F-actin)的装配, 从而发挥对细胞形态发生的影响. 实验观察到, 在DmIKKε过表达的果蝇细胞中, 气道系统结构出现明显紊乱; 而在表达功能结构域失活的突变型DmIKKε的细胞中, 肌动蛋白细胞骨架(actin cytoskeleton)的稳定性则明显增强. 这也进一步说明了虽然过度表达的DmIKKε可以通过抑制DIAP1从而增强效应caspases(effector caspases)的活性, 但其主要的正常生物学功能却是间接作用于类似DRONC的启始caspases, 来影响细胞正常形态的发生以及其他生理进程. 此外, 由于DIAP1非常不稳定, 体内的半衰期大约只有30 min, 因此DmIKKε可以通过控制DIAP1的数量来掌控caspases的活性水平和平衡caspases参与的非凋亡进程(图1).
IKKε的发现对于研究IAPs和caspases在非凋亡依赖的正常细胞事件中有重要的作用, 同时他也是机体先天性免疫和炎症反应的重要组成环节. 虽然如此, 在IKKε的研究过程中仍然有许多难题没有解决. 是什么激活了IKKε? 这是目前最大的疑问. Tojima et al[12]在HEK293细胞中发现, 血小板衍生生长因子(platelet-derived growth factor, PDGF)可以通过蛋白激酶C(protein kinase C, PKC)激活IKKε. 但除了MAVS与PKC外, 目前尚不清楚是否还有其他的活化途径. 其次, 在caspases调控的非凋亡功能信号途径中, DRONC的直接下游靶物是什么? 目前只观察到DRONC可以间接作用于肌动蛋白, 但是与二者直接相互作用的中介信号分子仍不确定. 随着研究的不断深入, IKKε的重要作用必将进一步显现, 这也为研究细胞先天性免疫和炎症反应机制以及caspases的功能开辟了全新的领域[13].
IκB激酶家族是NF-κB信号途径最为重要的成员之一, IKKs是其最新成员. 最近证实IKKε还能通过亡蛋白抑制物调节caspases的活性, 加入caspases的凋亡和非凋亡依赖性信号途径.
目前对于IKKε的研究还处于起步阶段, 但IKKε被证实能与MAVS直接发生作用, 而MAVS是已发现的唯一能将线粒体与先天性免疫联系在一起的核心蛋白质. 目前最大的疑问在于哪些信号分子直接作用于IKKε的上游.
本文较为深入的总结并探讨了目前对于IκB激酶家族及其新成员IKKε的研究进展以及所存在的问题, 对于细胞凋亡和细胞先天性免疫的相关研究有较大的参考价值.
本文结构合理, 叙述流畅, 有一定的学术参考价值, 是一篇较好的综述类文章.
编辑: 程剑侠 电编:何基才
| 1. | Peters RT, Liao SM, Maniatis T. IKKepsilon is part of a novel PMA-inducible IkappaB kinase complex. Mol Cell. 2000;5:513-522. [PubMed] |
| 2. | Fitzgerald KA, McWhirter SM, Faia KL, Rowe DC, Latz E, Golenbock DT, Coyle AJ, Liao SM, Maniatis T. IKKepsilon and TBK1 are essential components of the IRF3 signaling pathway. Nat. Immunol. 2003;4:491-496. [PubMed] |
| 3. | Seth RB, Sun L, Ea CK, Chen ZJ. Identification and characterization of MAVS, a mitochondrial antiviral signaling protein that activates NF-kappaB and IRF 3. Cell. 2005;122:669-682. [PubMed] |
| 4. | Lin R, Lacoste J, Nakhaei P, Sun Q, Yang L, Paz S, Wilkinson P, Julkunen I, Vitour D, Meurs E. Dissociation of a MAVS/IPS-1/VISA/Cardif-IKKepsilon molecular complex from the mitochondrial outer membrane by hepatitis C virus NS3- 4A proteolytic cleavage. J Virol. 2006;80:6072-6083. [PubMed] |
| 5. | Li XD, Sun L, Seth RB, Pineda G, Chen ZJ. Hepatitis C virus protease NS3/4A cleaves mitochondrial antiviral signaling protein off the mitochondria to evade innate immunity. Proc Natl Acad Sci U S A. 2005;102:17717-17722. [PubMed] |
| 6. | Kravchenko VV, Mathison JC, Schwamborn K, Mercurio F, Ulevitch RJ. IKKi/IKKepsilon plays a key role in integrating signals induced by pro-inflammatory stimuli. J Biol Chem. 2003;278:26612-26619. [PubMed] |
| 7. | Vaux DL, Silke J. IAPs, RINGs and ubiquitylation. Nat Rev Mol Cell Biol. 2005;6:287-297. [PubMed] |
| 8. | Kuranaga E, Kanuka H, Tonoki A, Takemoto K, Tomioka T, Kobayashi M, Hayashi S, Miura M. Drosophila IKK-related kinase regulates nonapoptotic function of caspases via degradation of IAPs. Cell. 2006;126:583-596. [PubMed] |
| 9. | Fernando P, Brunette S, Megeney LA. Neural stem cell differentiation is dependent upon endogenous caspase 3 activity. FASEB J. 2005;19:1671-1673. [PubMed] |
| 10. | Schwerk C, Schulze-Osthoff K. Non-apoptotic functions of caspases in cellular proliferation and differentiation. Biochem Pharmacol. 2003;66:1453-1458. [PubMed] |
| 11. | Oshima K, Takeda M, Kuranaga E, Ueda R, Aigaki T, Miura M, Hayashi S. IKK epsilon regulates F actin assembly and interacts with Drosophila IAP1 in cellular morphogenesis. Curr Biol. 2006;16:1531-1537. [PubMed] |