修回日期: 2007-09-25
接受日期: 2007-09-28
在线出版日期: 2007-11-28
目的: 分析胰蛋白酶原基因(cationic tryp-sinogen, PRSS1)在遗传性胰腺炎(hereditary pancreatitis, HP)患者中突变的性质.
方法: 用基因产物直接测序法对1个遗传性胰腺炎家系中的胰腺炎患者(共有2例成员)的PRSS1基因5个外显子进行测序, 并分析其临床特征.
结果: 在2例胰腺炎患者中均出现了PRSS1基因3号外显子纯合子突变(c.415 T>A), 表达的氨基酸从胱氨酸(Cys)→丝氨酸(Ser), 平均发病年龄为16岁, 家系中胰腺炎患者的血清肿瘤标志物均正常.
结论: PRSS1基因3号外显子c.415 T>A突变与遗传性胰腺炎有关.
引文著录: 刘奇才, 郜峰, 许幼仕, 王凤清, 潘云振, 欧启水. 遗传性胰腺炎胰蛋白酶原基因突变分析. 世界华人消化杂志 2007; 15(33): 3514-3517
Revised: September 25, 2007
Accepted: September 28, 2007
Published online: November 28, 2007
AIM: To identify the mutation character of cationic trypsin gene (PRSS1) in the patients of hereditary pancreatitis (HP).
METHODS: Two Patients with hereditary pancreatitis, five exons of PRSS1 gene were amplified by PCR and it's products were analyzed by sequencing, related clinical data were also collected.
RESULTS: Two patients of the HP families were found c.415 T > A mutation. It's members showed symptom about 16 years old.
CONCLUSION: PRSS1 gene c.415 T >A mutation may be an factor associated with hereditary pancreatitis.
- Citation: Liu QC, Gao F, Xu YS, Wang FQ, Pan YZ, Ou QS. Mutations of the cationic trypsinogen gene in patients with hereditary pancreatitis. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3514-3517
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3514.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3514
遗传性胰腺炎(hereditary pancreatitis, HP)是一种罕见的疾病, 约占胰腺炎总数的1%, 于1952年由Comfort和Stein-berg发现并确立的一种独立的疾病[1-3]. HP是常染色体显性遗传疾病, 有80%的表型外显率, 见于不同人种, 男女发病几率相等. 目前没有证据表明其和特殊的HLA系耦联. HP患者有45%的机会可发展为胰腺癌. 两个独立的大型流行病学研究(国际遗传性胰腺炎研究小组和欧洲胰腺癌和遗传性胰腺炎登记处)发现HP发生胰腺癌的危险性增加了将近50-70倍[4-8]. 近年来有关HP的相关研究已深入开展, 至今已经在60%-70%的家族中发现了胰蛋白酶原基因(cationic trypsinogen gene, PRSS1)两个不同的突变即R122H和N29I[1]. 为了明确PRSS1基因在中国HP家系中的突变情况, 本研究对一个HP家系的胰腺炎患者进行PRSS1基因的5个外显子全长测序如下.
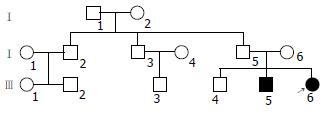
家系2: 含3代14个成员(图1). 胰腺炎2例, 分别为Ⅲ5、Ⅲ6. 先证者(Ⅲ6), 女, 28岁, 14岁时胰腺炎第1次发病, 先后6次住院均确诊为胰腺炎.
经同意后, 取家系中胰腺炎患者的外周血2 mL, EDTA抗凝, 用Wizard®Genomic DNA Purification Kit(promega公司)提取DNA, 按使用说明书操作. 应用Primer Express软件自行设计引物, 上游引物: 5'-ggtcctgggtctcatacctt-3'; 下游引物: 5'-gggtaggaggcttcacactt-3'(由上海生工生物技术公司合成), 该引物扩增产物长度为818 bp. PCR反应体积为50 μL, 含50 ng样品DNA, 0.06 mol/L引物, 0.2 mmol/L dNTP, 10×PCR缓冲液2.5 μL, 2.0 mmol/L Mg2+, 1 U Taq酶(Promega公司). 在PE9700热循环仪上94ºC 60 s→55℃ 60 s→72℃ 60 s, 循环35次, 72℃延长7 min. 琼脂糖凝胶电泳, 观察结果. PCR产物使用Tiangen公司胶回收试剂盒, 按使用说明操作, 回收产物. PCR产物直接测序由上海生工生物技术公司完成. 另收集记录家系成员的其他临床一般资料(年龄、性别、发病年龄、病程、家族史、并发症以及治疗情况).
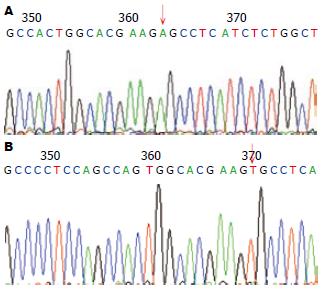
胰腺炎患者Ⅲ5, Ⅲ6的PRSS1基因测序图与NCBI公布的标准序列比对可见3号外显子第415位碱基发生T→A突变(图2)
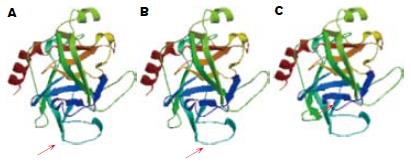
家系中患者PRSS1基因突变后的胰蛋白酶原空间三维结构与国际上报道的R122H相似(图3).
遗传性胰腺炎患者PRSS1基因突变将引起的氨基酸序列改变如下: MNPLLILTFVAAALAAPFDDDDKIVGGYNCEENSVVPYQVSLNSGYHFCGGSLINEQWVVSAGHCYKSRIQVRL GEHNIEVLEGNEQFINAAKIIRHPQYDRKTLNNDIMLIKLSSRAVINARVSTISLPTAPPATGTK C/S LISGWGNTASSGADYPDELQCLDAPVLSQAKCEASYPGKITSNMFCVGFLEGGKDSCQGDSGGPVVCNGQLQGV VSWGDGCAQKNKPGVYTKVYNYVKWIKNTIAANS. 遗传性胰腺炎患者的血液生化改变情况见表1.
| 病例 | 空腹血糖 (mmol/L) | GHb (%) | 乳酸 (mmol/) | 胱抑制素 C(mmol/L) | CA19-9 (mmol/L) |
| Ⅲ5 | 5.32 | 3.69 | 3.22 | 1.06 | 15.3 |
| Ⅲ6 | 4.98 | 4.23 | 2.26 | 1.15 | 22.1 |
| 参考范围 | 3.89-6.11 | 3.8-5.8 | 1.0-2.1 | 0.34-1.70 | 0-27 |
1996年Whitcomb et al[9-13]在遗传性胰腺炎(hereditary pancreatitis, HP)患者中发现, 与之相关联的第7号染色体长臂(7q35)上的胰蛋白酶原基因(cationic trypsinogen, PRSS1)发生突变与HP发病相关(阳离子胰蛋白酶原所起的作用是水解食物中含有赖-精氨酸残基的蛋白质, 同时他在激活/灭活其他消化酶的过程中起关键的作用), 对PRSS1基因的深入研究可为HP的分子病理学解析提供新线索. 据报道HP发生胰腺癌的机率比正常人高53倍[14-16]. 至今已经在60%-70%的家族中发现了阳离子胰蛋白酶原基因常见的2种突变即R122H(密码子122, 外显子3, 精氨酸→组氨酸)和N29I(密码子29, 外显子2, 精氨酸→组氨酸)[17-19]. 其中, 以R122H最为常见. R122H突变可使蛋白质对胰蛋白酶的裂解呈抗性, 结果是蛋白质自我激活, 伴有蛋白水解酶胰蛋白酶在细胞内的不恰当积聚, 导致胰腺组织本身的消化[6,20-23].
我们通过分析遗传性胰腺炎家系发现他们具有以下特征: (1)呈常染色体显性遗传, 家系中均存在男女患者; (2)患者的肿瘤标志物水平不增高; (3)不表现出糖尿病症状. 进一步分析家系的PRSS1基因突变情况发现家系胰蛋白酶原基因3号外显子415位碱基存在T→A纯合子突变, 表达的氨基酸从胱氨酸(Cys)→丝氨酸(Ser), 与国际上报道的R122H突变在同一外显子[3,8]. 三维构像与R122H相似, 突变改变识别位点, 不改变胰蛋白酶原的三级结构, 也不改变其催化活性; 在三维立体构像中的精氨酸位于胰蛋白酶催化活性部位及其抑制物结合位点的背面, 本家系发病年龄与参考文献[24-29]相当. 另外, 本家系目前未发现糖尿病和胰腺癌患者, 可能与基因突变引起的临床表型不同有关, 我们将做进一步分析.
HP患者的PRSS1基因存在多种形式的突变, 且与临床表型相关, 对PRSS1基因的深入研究可为探讨胰腺炎的发病机制提供新的线索.
遗传性胰腺炎占胰腺炎的1%左右, 是常染色体显性遗传疾病, 有80%的表型外显率, 主要由胰蛋白酶原基因突变引起, 患者罹患胰腺癌的风险较正常人群高50多倍, 多伴有糖尿病.
1996年Whitcomb et al发现遗传性胰腺炎患者中, 与之相关联的第7号染色体长臂(7q35)上的胰蛋白酶原基因发生突变与其发病相关(阳离子胰蛋白酶原所起的作用是水解食物中含有赖-精氨酸残基的蛋白质, 同时他在激活/灭活其他消化酶的过程中起着关键的作用), 对胰腺炎发病的分子病理学解析提供了新线索, 据报道HP发生胰腺癌的几率比正常人高出53倍. 至今已经在60%-70%的家族中发现了阳离子胰蛋白酶原基因常见的2种突变即R122H(密码子122, 外显子3, 精氨酸→组氨酸)和N29I(密码子29, 外显子2, 精氨酸 →组氨酸), 其中以R122H最为常见.
在国内首次用分子生物学技术对胰蛋白酶原基因在中国遗传性胰腺炎家系中突变情况做详细的分析.
由于胰蛋白酶原基因突变在本文研究中主要表现为纯合突变, 患者的症状不如文献报道的典型, 无糖尿病、胰腺癌倾向, 新发现的突变形式将对药物开发提供新的线索.
本文选题紧密结合临床, 方法先进, 结果可信, 图文并茂, 文笔流畅, 讨论客观. 对于丰富遗传性胰腺炎发病机制的认识, 具有重要的指导价值.
编辑: 何燕 电编:郭海丽
| 1. | Applebaum-Shapiro SE, Finch R, Pfutzer RH, Hepp LA, Gates L, Amann S, Martin S, Ulrich CD 2nd, Whitcomb DC. Hereditary pancreatitis in North America: the Pittsburgh-Midwest Multi-Center Pancreatic Study Group Study. Pancreatology. 2001;1:439-443. [PubMed] |
| 2. | Pandya A, Blanton SH, Landa B, Javaheri R, Melvin E, Nance WE, Markello T. Linkage studies in a large kindred with hereditary pancreatitis confirms mapping of the gene to a 16-cM region on 7q. Genomics. 1996;38:227-230. [PubMed] |
| 3. | Whitcomb DC, Gorry MC, Preston RA, Furey W, Sossenheimer MJ, Ulrich CD, Martin SP, Gates LK Jr, Amann ST, Toskes PP, Liddle R, McGrath K, Uomo G, Post JC, Ehrlich GD. Hereditary pancreatitis is caused by a mutation in the cationic trypsinogen gene. Nat Genet. 1996;14:141-145. [PubMed] |
| 4. | Creighton JE, Lyall R, Wilson DI, Curtis A, Charnley RM. Mutations of the cationic trypsinogen gene in patients with hereditary pancreatitis. Br J Surg. 2000;87:170-175. [PubMed] |
| 5. | Yamamoto K, Mine T, Katagiri K, Suzuki N, Kawaoka T, Ueno T, Matsueda S, Yamada A, Itoh K, Yamana H. Immunological evaluation of personalized peptide vaccination for patients with pancreatic cancer. Oncol Rep. 2005;13:874-883. [PubMed] |
| 6. | Schneider A, Lamb J, Barmada MM, Cuneo A, Money ME, Whitcomb DC. Keratin 8 mutations are not associated with familial, sporadic and alcoholic pancreatitis in a population from the United States. Pancreatology. 2006;6:103-108. [PubMed] |
| 7. | Howes N, Greenhalf W, Neoptolemos J. Screening for early pancreatic ductal adenocarcinoma in hereditary pancreatitis. Med Clin North Am. 2000;84:719-738. [PubMed] |
| 8. | Ockenga J, Stuhrmann M, Ballmann M, Teich N, Keim V, Dork T, Manns MP. Mutations of the cystic fibrosis gene, but not cationic trypsinogen gene, are associated with recurrent or chronic idiopathic pancreatitis. Am J Gastroenterol. 2000;95:2061-2067. [PubMed] |
| 9. | Zhou GX, Huang JF, Zhang H, Chen JP. Diagnosis of pancreatic cancer by cytology and telomerase activity in exfoliated cells obtained by pancreatic duct brushing during endoscopy. Hepatobiliary Pancreat Dis Int. 2007;6:308-311. [PubMed] |
| 10. | Liu QC, Cheng ZJ, Yang Y, Ou QS. A novel mutation of PRSS1 gene in a Chinese hereditary pancreatitis family. Yi Chuan. 2007;29:1067-1070. [PubMed] |
| 11. | Whitcomb DC. Hereditary pancreatitis: new insights into acute and chronic pancreatitis. Gut. 1999;45:317-322. [PubMed] |
| 12. | Sahin-Toth M, Toth M. Gain-of-function mutations associated with hereditary pancreatitis enhance autoactivation of human cationic trypsinogen. Biochem Biophys Res Commun. 2000;278:286-289. [PubMed] |
| 13. | Le Bodic L, Schnee M, Georgelin T, Soulard F, Ferec C, Bignon JD, Sagniez M. An exceptional genealogy for hereditary chronic pancreatitis. Dig Dis Sci. 1996;41:1504-1510. [PubMed] |
| 14. | Lowenfels AB, Maisonneuve P, DiMagno EP, Elitsur Y, Gates LK Jr, Perrault J, Whitcomb DC. Hereditary pancreatitis and the risk of pancreatic cancer. International Hereditary Pancreatitis Study Group. J Natl Cancer Inst. 1997;89:442-446. [PubMed] |
| 15. | Applebaum-Shapiro SE, Peters JA, O'Connell JA, Aston CE, Whitcomb DC. Motivations and concerns of patients with access to genetic testing for hereditary pancreatitis. Am J Gastroenterol. 2001;96:1610-1617. [PubMed] |
| 16. | Lee TY, Oh HC, Kim MH, Kwon S, Lee SS, Seo DW, Lee SK. Three cases of hereditary pancreatitis in two households in the same family associated with R122H mutation in cationic trypsinogen gene. Korean J Gastroenterol. 2007;49:395-399. [PubMed] |
| 17. | Klein AP, de Andrade M, Hruban RH, Bondy M, Schwartz AG, Gallinger S, Lynch HT, Syngal S, Rabe KG, Goggins MG. Linkage analysis of chromosome 4 in families with familial pancreatic cancer. Cancer Biol Ther. 2007;6:320-323. [PubMed] |
| 18. | Archer H, Jura N, Keller J, Jacobson M, Bar-Sagi D. A mouse model of hereditary pancreatitis generated by transgenic expression of R122H trypsinogen. Gastroenterology. 2006;131:1844-1855. [PubMed] |
| 19. | Le Marechal C, Masson E, Chen JM, Morel F, Ruszniewski P, Levy P, Ferec C. Hereditary pan-creatitis caused by triplication of the trypsinogen locus. Nat Genet. 2006;38:1372-1374. [PubMed] |
| 20. | Sahin-Toth M. Biochemical models of hereditary pancreatitis. Endocrinol Metab Clin North Am. 2006;35:303-12. [PubMed] |
| 21. | Vitone LJ, Greenhalf W, Howes NR, Neoptolemos JP. Hereditary pancreatitis and secondary screening for early pancreatic cancer. Rocz Akad Med Bialymst. 2005;50:73-84. [PubMed] |
| 22. | Khalid A, Finkelstein S, Thompson B, Kelly L, Hanck C, Godfrey TE, Whitcomb DC. A 93 year old man with the PRSS1 R122H mutation, low SPINK1 expression, and no pancreatitis: insights into phenotypic non-penetrance. Gut. 2006;55:728-731. [PubMed] |
| 23. | Keim V. Genetics of pancreatitis. Scand J Surg. 2005;94:103-107. [PubMed] |
| 24. | Pho-Iam T, Thongnoppakhun W, Yenchitsomanus PT, Limwongse C. A Thai family with hereditary pancreatitis and increased cancer risk due to a mutation in PRSS1 gene. World J Gastroenterol. 2005;11:1634-1638. [PubMed] |
| 25. | Kenesi E, Katona G, Szilagyi L. Structural and evolutionary consequences of unpaired cysteines in trypsinogen. Biochem Biophys Res Commun. 2003;309:749-754. [PubMed] |
| 26. | Cheng ZJ, Yang B, Liu QC, Jiang L, Xie HH, Ou QS. Study on a new point mutation of nt7444 G-->A in the mitochondrial DNA in a type 2 diabetes mellitus family. Yi Chuan. 2007;29:433-437. [PubMed] |
| 27. | Keim V. Identification of patients with genetic risk factors of pancreatitis: impact on treatment and cancer prevention. Dig Dis. 2003;21:346-350. [PubMed] |
| 28. | Uygur-Bayramicli O, Dabak R, Orbay E, Dola-pcioglu C, Sargin M, Kilicoglu G, Guleryuzlu Y, Mayadagli A. Type 2 diabetes mellitus and CA 19-9 levels. World J Gastroenterol. 2007;13:5357-5359. [PubMed] |
| 29. | Lee SE, Yang SH, Jang JY, Kim SW. Pancreatic fistula after pancreaticoduodenectomy: A comparison between the two pancreaticojejunostomy methods for approximating the pancreatic parenchyma to the jejunal seromuscular layer: Interrupted vs continuous stitches. World J Gastroenterol. 2007;13:5351-5356. [PubMed] |