修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-28
目的: 研究胃癌组织中基质金属蛋白酶-10(MMP-10)、血管内皮生长因子(VEGF)和微血管密度(MVD)表达变化及其与肿瘤临床病理特征之间的关系.
方法: 以CD31作为MVD指标, 应用免疫组化法检测60例胃癌组织和60例距病灶5 cm以上的正常组织中的MMP-10、VEGF和CD31的表达并对结果进行分析.
结果: 60例胃癌组织中的MMP-10、VEGF的表达阳性率分别为81.7%、76.7%, 明显高于正常组织的表达阳性率11.7%、8.3%, 两者差异有统计学意义(P<0.05). MMP-10、VEGF的表达与MVD、与肿瘤的分化程度、TNM分型、淋巴结的转移、浸润程度有关.
结论: MMP-10、VEGF胃癌组织中高表达与胃癌侵袭转移、血管生成密切相关, 可作为判断胃癌侵袭转移及预后的重要指标.
引文著录: 赵向阳, 施瑞华. 胃癌组织MMP-10和VEGF表达与血管生成的关系. 世界华人消化杂志 2007; 15(33): 3495-3499
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 28, 2007
AIM: To investigate the expression of matrix metalloproteinase-10 (MMP-10) and vascular endothelial growth factor (VEGF) and microvascular density (MVD) in gastric carcinoma and its relationship with the clinical characteristics of tumors.
METHODS: CD31 was used as the standard of MVD. 60 examples of gastric carcinoma tissue by immunohistochemistry for MMP-10, VEGF and CD31 were investigated, and were compared the results with those in 60 normal tissues.
RESULTS: The expression positive rates for MMP-10 and VEGF in the 60 gastric carcinoma tissues were 81.7% and 76.7%, respectively. They were much higher than those in normal tissue samples (11.7% and 8.3%, respectively). The differences were statistically significant (P < 0.05). The expression of MMP-10 and VEGF was related with MVD, and tumor grade, TNM classification, lymphatic metastasis, and degree of invasion.
CONCLUSION: The high expression of MMP-10 and VEGF in gastric carcinoma is closely related to metastasis of gastric carcinoma and angiogenesis. It can be used as an important factor in judging the metastasis prognosis of gastric carcinoma.
- Citation: Zhao XY, Shi RH. Expression of matrix metalloproteinase-10 and vascular endothelial growth factor in gastric carcinoma and its relationship with angiogenesis. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3495-3499
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3495.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3495
胃癌是我国最常见的消化道恶性肿瘤之一, 其发病率、死亡率居所有恶性肿瘤之首, 因此探讨胃癌生长及转移机制具有重要意义. 基质金属蛋白酶是机体内一大类重要的基质分解酶类, 在生长发育、外伤修复、血管生成等生理过程中发挥重要作用, 同时他们也参与组织纤维化、肿瘤生长、转移等病理过程, 其中对MMP-2、MMP-7、MMP-9的研究较深入[1-3]. 他们在胃癌的发生、发展和转移过程中发挥重要作用[4-5]. 而近期研究表明, MMP-10在降解细胞外基质(ECM)、维持肿瘤微环境和促进肿瘤生长起重要作用并与肿瘤侵袭转移密切相关[6-7]. VEGF是促进血管生成的重要因子, 他可以通过调节金属蛋白酶的形成, 使MMP-10表达升高, 与恶性肿瘤的发生、侵袭转移和预后等恶性生物学行为密切相关[8-10]. 我们应用免疫组化法检测了60例胃癌组织中MMP-10, VEGF和MVD表达变化, 旨在探讨MMP-10和VEGF在胃癌发生、发展和血管生成中的作用及其与胃癌临床病理特征之间的关系.
2005-01/2006-11我院手术切除并经病理证实的胃癌组织标本60例, 男47例, 女13例, 年龄33-78(平均年龄56)岁. 60岁以下22例, 60岁及以上38例, 高中分化腺癌42例, 低分化腺癌18例, 贲门胃底部17例, 胃体胃窦43例, 肿块大于5.0 cm者26例, 肿块小于5 cm者34例, 未浸及浆膜层25例, 浸及浆膜下35例, 有淋巴结转移36例, 无淋巴结转移24例. TNM分期, T1期9例, T2期17例, T3期24例, T4期8例. 正常组织60例取自距肿瘤边缘5 cm以上, 并经病理检查排除肿瘤可能的组织标本.
标本经40 g/L中性甲醛固定, 石蜡包埋, 4 μm厚连续切片, HE染色作病理学检查证实. 免疫组化所用试剂均为mAb. MMP-10浓缩液(1: 100)购自NeoMarkers, mAb CD31和VEGF(即用型)及免疫组化试剂盒均购自福建迈新生物技术开发有限公司.
石蜡切片脱蜡水化后, 用pH7.4的0.01 mol/L的PBS洗涤3次, 每次5 min. 电炉煮沸20 min, 以修复组织抗原, 自然冷却至室温, PBS洗涤3次, 每次5 min. 每片滴加30 mL/L的过氧化氢溶液1滴, 室温下孵育15 min, PBS洗涤3次, 每次5 min. 每片滴加MMP-10(1:100稀释)及VEGF一抗, 37℃恒温箱孵育1 h, PBS洗涤3次, 每次5 min. 每片滴加生物素标记的二抗, 室温30 min, PBS洗涤3次, 每次5 min. 每片滴加新鲜配制的3, 3'-二氨基联苯胺(DAB)溶液, 显微镜下观察3-10 min. 自来水冲洗, 苏木素复染, 1 mL/L盐酸分化. 经梯度酒精脱水干燥, 中性树脂封固, 光学显微镜下观察、计数. 本实验以PBS液代替一抗作为阴性对照, 以已证实MMP-10和VEGF染色阳性的食管标本作阳性对照. 结果判断标准根据Zhong et al[11]报道. 细胞核、胞质或胞膜出现棕黄色颗粒视为阳性染色, 每张切片在高倍镜下(×200)随机选择5个视野, 计数200个细胞/视野, 共计1000个. 阳性细胞数<1%为阴性(-), 阳性细胞数1%-10%为弱阳性(+); 11%-50%为中度阳性(++); >50%为强阳性(+++), +~+++均视为阳性表达. 先在低倍镜(×40)下找出肿瘤组织中微血管最密集的部位, 然后在高倍镜(×200)下进行观察. 任何被抗CD31抗体染成棕黄色的内皮细胞或内皮细胞簇, 无论有或无管腔, 只要与邻近的微血管及其他结缔组织成分有明显区别, 均作为一个微血管计数. 管腔直径大于50 μm及带有较厚肌层及硬化区的血管不在计数范畴, 每个标本计数5个高倍视野下的血管数目, 每组MVD值以mean±SD表示.
统计学处理 应用SPSS10.0统计软件包进行统计分析, 胃癌组织和正常组织中MMP-10和VEGF的表达差异分析采用χ2检验, MMP-10和VEGF相关表达分析采用Spearman秩和分析, MMP-10和VEGF表达与各组胃癌临床病理特征之间的关系采用χ2检验. P<0.05时差异有统计学意义.
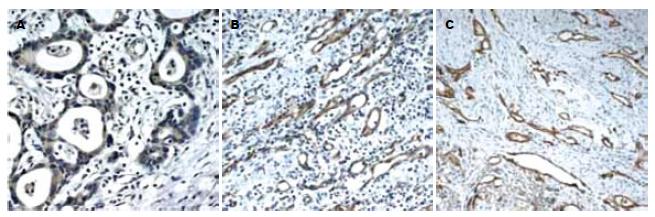
MMP-10主要在肿瘤细胞胞质阳性表达, 阳性率为81.7%, 与正常组织的表达阳性率11.7%相比, 差异有统计学意义(P<0.05, 表1, 图1A). 胃癌组织中MMP-10的表达与肿瘤的分化程度、TNM分期、淋巴结的转移、浸润深度相关(表2). VEGF主要在肿瘤细胞胞质阳性表达. 阳性率为76.7%, 与正常组织的表达阳性率8.3%相比, 差异有统计学意义(P<0.05, 表1, 图1B). 胃癌组织中MMP-10的表达与肿瘤的分化程度、TNM分期、淋巴结的转移、浸润深度相关(表2). MMP-10和VEGF在胃癌组织中的表达之间有显著性相关(r = 0.71, P<0.05). 与MVD(图1C)值之间也呈正相关(r = 0.57, P<0.05).
| 病理特性 | n | MMP-10(%) | VEGF(%) | MVD |
| 病灶大小 | ||||
| <5 cm | 34 | 27(79.4) | 26(76.5) | 30.9±5.4 |
| >5 cm | 26 | 22(84.6) | 20(76.9) | 33.2±6.4 |
| 分化程度 | ||||
| 中高分化 | 42 | 31(73.5b) | 29(69.1a) | 30.2±7.1 |
| 低分化 | 18 | 18(100) | 17(94.4) | 33.0±5.4 |
| TNM分期 | ||||
| T1-T2 | 28 | 21(75.0a) | 17(60.8a) | 25.8±6.1a |
| T3-T4 | 32 | 30(93.8) | 29(90.6) | 36.7±5.9 |
| 浸润程度 | ||||
| 未及浆膜 | 25 | 15(60.0b) | 15(60.0b) | 27.6±5.5 |
| 侵及浆膜 | 35 | 33(93.8) | 32(91.4) | 34.3±4.5 |
| 淋巴结转移 | ||||
| 无 | 34 | 21(61.8a) | 29(85.3) | 27.9±5.9a |
| 有 | 26 | 22(84.6) | 17(65.4) | 35.8±7.4 |
肿瘤的浸润和转移首先降解肿瘤细胞外基质, 破坏基底膜的完整性, 而且必须穿过上皮基底膜浸润周围间质, 进入血管或淋巴管, 最后导出血管和淋巴管, 在新的位置形成转移灶[12]. 既往研究认为, 基质金属蛋白酶中MMP-2、MMP-7和MMP-9是参与肿瘤转移的重要酶类[13-14], 在肿瘤进展过程中不但活性明显增强, 与癌细胞的移动、定植密切相关, 而且应用相关抑制剂后可显著减少肿瘤转移的发生[15-16]. MMP-10是基质金属蛋白酶中的一个成员, 属于间质溶解素类. 他可以降解一些蛋白质如胶原质Ⅲ, Ⅳ, Ⅴ, 白明胶, 巢蛋白, 层粘连蛋白-1, 蛋白多糖和弹性蛋白, 从而降解和破坏肿瘤\细胞外基质及基底膜. MMP-10还可参与P53介导的肿瘤细胞凋亡过程[17]. 近年来研究发现, 肿瘤组织中MMP-10的表达明显高于相应的正常组织及良性腺瘤[18-19]. Bodey et al[20]应用一种间接的碱性磷酸盐抗原抗体免疫反应技术, 发现在人的结肠、直肠癌中均有MMP-10的强烈表达, 特别是在接近细胞外基质处, 在肾癌和头颈部鳞癌组织中也发现MMP-10表达增强[21-22]. 鳞癌细胞株在紫外线照射下可出现MMP-10表达变化[23]. Kren和Zhang et al发现在肺癌中MMP-10表达明显增加, 与肿瘤病理学特征密切相关[24-25]. 也有学者认为MMP-10可能成为治疗肺癌的其潜在靶点[26]. 胃癌基因表达谱的研究发现MMP-10基因在胃癌组织中呈高表达[27]. 因此我们研究了MMP-10在胃癌组织标本中的蛋白表达. 结果表明, 胃癌组织标本中MMP-10蛋白呈高表达, 显著高于癌旁组织.
肿瘤组织周围微血管生成的进程、微血管性质和微血管密度直接关系到肿瘤的生长、侵袭、转移的能力和预后, 故血管生成是肿瘤生长和转移的必要条件, 也是影响患者预后的重要因素. VEGF是一种高度特异的内皮细胞丝裂原, 他通过诱导内皮细胞增殖、移行, 在调控血管生成中发挥中心作用. 研究表明, 在乳腺癌、神经系统肿瘤、胃肠道肿瘤、肾癌、卵巢癌等肿瘤组织及血清中的VEGF表达水平都有不同程度的升高. 其表达失控会促进肿瘤血管生成, 并进一步促进肿瘤生长和转移. 我们研究了VEGF在胃癌组织标本中的表达, 结果表明胃癌组织中VEGF的高表达, 与正常组织相比, 差异有统计学意义(P<0.05). 肿瘤的侵袭转移是一个多因素、多阶段的复杂过程. 在这一过程中, 许多小分子可单独或相互作用共同参与肿瘤的侵袭转移. 有资料显示, VEGF和MMP-10与恶性肿瘤的发生、侵袭转移和预后等恶性生物学行为密切相关. 我们也发现, 胃癌组织中两者表达呈高度正相关, 提示两者共同促进了肿瘤细胞的伸展、迁移和趋化, 并可作为潜在的临床治疗靶点, 为今后肿瘤药物的研制开发和肿瘤基因治疗提供新的思路.
为了探讨MMP-10和VEGF在胃癌的发生、发展和血管生成过程中的作用, 我们进一步研究了MMP-10和VEGF表达和MVD值与胃癌临床病理特征之间的关系. 结果显示, MMP-10和VEGF表达增加与MVD变化相一致, 表明MMP-10和VEGF介导的新血管生成密切相关, 提示MMP-10和VEGF在肿瘤的发生、发展和血管生成过程中起重要作用. 但MMP-10和VEGF与胃癌发生、发展和血管生成关系的确切机制, 尚有待进一步研究.
胃癌是我国最常见的恶性肿瘤, 极易转移. 基质金属蛋白酶是人体重要的蛋白分解酶类, 在恶性肿瘤的发展与转移中发挥重要作用, MMP-10是重要的基质金属蛋白酶. 最近研究发现他参与肿瘤的病理过程, 并与血管内皮生长因子存在相互作用. 本研究通过免疫组化方法检测了胃癌组织和正常组织中MMP-10和VEGF的表达, 发现MMP-10和VEGF在胃癌中表达明显增加, 并与胃癌的病理学特征密切相关, 提示这两者在胃癌发展和转移中发挥重要作用.
本文采用方法成熟, 设计合理, 内容科学, 有一定的可读性和参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Lou G, Gao Y, Ning XM, Zhang QF. Expression and correlation of CD44v6, vascular endothelial growth factor, matrix metalloproteinase-2, and matrix metalloproteinase-9 in Krukenberg tumor. World J Gastroenterol. 2005;11:5032-5036. [PubMed] |
| 2. | Li BH, Zhao P, Liu SZ, Yu YM, Han M, Wen JK. Matrix metalloproteinase-2 and tissue inhibitor of metallo-proteinase-2 in colorectal carcinoma invasion and metastasis. World J Gastroenterol. 2005;11:3046-3050. [PubMed] |
| 3. | Li YJ, Wei ZM, Meng YX, Ji XR. Beta-catenin up-regulates the expression of cyclinD1, c-myc and MMP-7 in human pancreatic cancer: relationships with carcinogenesis and metastasis. World J Gastroenterol. 2005;11:2117-2123. [PubMed] |
| 6. | Fernandez-Figueras MT, Puig L, Musulen E, Gilaberte M, Lerma E, Serrano S, Ferrandiz C, Ariza A. Expression profiles associated with aggressive behavior in Merkel cell carcinoma. Mod Pathol. 2007;20:90-101. [PubMed] |
| 7. | Savaraj N, Wei Y, Unate H, Liu PM, Wu CJ, Wangpaichitr M, Xia D, Xu HJ, Hu SX, Tien Kuo M. Redox regulation of matrix metalloproteinase gene family in small cell lung cancer cells. Free Radic Res. 2005;39:373-381. [PubMed] |
| 8. | 贾 瑞鹏, 马 庆铮, 刘 军, 程 继义, 许 纯孝, 王 万忠, 杜 德利, 姜 玉菲. 肾癌组织中微血管密度、DNA含量检测的临床意义. 南京医科大学学报(自然科学版). 2003;23:261-263. |
| 10. | Garzetti GG, Ciavattini A, Lucarini G, Pugnaloni A, De Nictolis M, Amati S, Romanini C, Biagini G. Expression of vascular endothelial growth factor related to 72-kilodalton metalloproteinase immunostaining in patients with serous ovarian tumors. Cancer. 1999;85:2219-2225. [PubMed] |
| 11. | Zhong H, De Marzo AM, Laughner E, Lim M, Hilton DA, Zagzag D, Buechler P, Isaacs WB, Semenza GL, Simons JW. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 1999;59:5830-5835. [PubMed] |
| 12. | Johansson N, Ahonen M, Kahari VM. Matrix metalloproteinases in tumor invasion. Cell Mol Life Sci. 2000;57:5-15. [PubMed] |
| 13. | Yamazaki K, Tajima Y, Makino R, Nishino N, Aoki S, Kato M, Sakamoto M, Morohara K, Kaetsu T, Kusano M. Tumor differentiation phenotype in gastric differentiated-type tumors and its relation to tumor invasion and genetic alterations. World J Gastroenterol. 2006;12:3803-3809. [PubMed] |
| 14. | Zhao ZS, Zhou JL, Yao GY, Ru GQ, Ma J, Ruan J. Correlative studies on bFGF mRNA and MMP-9 mRNA expressions with microvascular density, progression, and prognosis of gastric carcinomas. World J Gastroenterol. 2005;11:3227-3233. [PubMed] |
| 15. | Kumar M, Liu ZR, Thapa L, Chang Q, Wang DY, Qin RY. Antiangiogenic effect of somatostatin receptor subtype 2 on pancreatic cancer cell line: Inhibition of vascular endothelial growth factor and matrix metalloproteinase-2 expression in vitro. World J Gastroenterol. 2004;10:393-399. [PubMed] |
| 16. | Liu JR, Yang BF, Chen BQ, Yang YM, Dong HW, Song YQ. Inhibition of beta-ionone on SGC-7901 cell proliferation and upregulation of metalloproteinases-1 and -2 expression. World J Gastroenterol. 2004;10:167-171. [PubMed] |
| 17. | Meyer E, Vollmer JY, Bovey R, Stamenkovic I. Matrix metalloproteinases 9 and 10 inhibit protein kinase C-potentiated, p53- mediated apoptosis. Cancer Res. 2005;65:4261-4272. [PubMed] |
| 18. | Chandler S, Miller KM, Clements JM, Lury J, Corkill D, Anthony DC, Adams SE, Gearing AJ. Matrix metalloproteinases, tumor necrosis factor and multiple sclerosis: an overview. J Neuroimmunol. 1997;72:155-161. [PubMed] |
| 19. | Bodey B, Bodey B Jr, Siegel SE, Kaiser HE. Prognostic significance of matrix metalloproteinase expression in colorectal carcinomas. In Vivo. 2000;14:659-666. [PubMed] |
| 20. | Bodey B, Bodey B Jr, Siegel SE, Kaiser HE. Immunocytochemical detection of MMP-3 and -10 expression in hepatocellular carcinomas. Anticancer Res. 2000;20:4585-4590. [PubMed] |
| 21. | Miyata Y, Iwata T, Maruta S, Kanda S, Nishikido M, Koga S, Kanetake H. Expression of matrix metalloproteinase-10 in renal cell carcinoma and its prognostic role. Eur Urol. 2007;52:791-797. [PubMed] |
| 22. | Gorogh T, Beier UH, Baumken J, Meyer JE, Hoffmann M, Gottschlich S, Maune S. Metallo-proteinases and their inhibitors: influence on tumor invasiveness and metastasis formation in head and neck squamous cell carcinomas. Head Neck. 2006;28:31-39. [PubMed] |
| 23. | Ramos MC, Steinbrenner H, Stuhlmann D, Sies H, Brenneisen P. Induction of MMP-10 and MMP-1 in a squamous cell carcinoma cell line by ultraviolet radiation. Biol Chem. 2004;385:75-86. [PubMed] |
| 24. | Kren L, Goncharuk VN, Krenova Z, Stratil D, Hermanova M, Skrickova J, Sheehan CE, Ross JS. Expression of matrix metalloproteinases 3, 10 and 11 (stromelysins 1, 2 and 3) and matrix metalloproteinase 7 (matrilysin) by cancer cells in non-small cell lung neoplasms. Clinicopathologic studies. Cesk Patol. 2006;42:16-19. [PubMed] |
| 25. | Zhang X, Zhu S, Luo G, Zheng L, Wei J, Zhu J, Mu Q, Xu N. Expression of MMP-10 in lung cancer. Anticancer Res. 2007;27:2791-2795. [PubMed] |
| 26. | Gill JH, Kirwan IG, Seargent JM, Martin SW, Tijani S, Anikin VA, Mearns AJ, Bibby MC, Anthoney A, Loadman PM. MMP-10 is overexpressed, proteolytically active, and a potential target for therapeutic intervention in human lung carcinomas. Neoplasia. 2004;6:777-785. [PubMed] |
| 27. | Liu LX, Liu ZH, Jiang HC, Qu X, Zhang WH, Wu LF, Zhu AL, Wang XQ, Wu M. Profiling of differentially expressed genes in human gastric carcinoma by cDNA expression array. World J Gastroenterol. 2002;8:580-585. [PubMed] |