修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-28
目的: 探讨中国辽宁地区人群H. pylori致病基因的疾病相关性, 为揭示H. pylori的致病机制及监测H. pylori相关性胃疾病的高危人群提供线索.
方法: 选取胃黏膜活检标本491例, 分组浅表性胃炎(GS)、萎缩性胃炎(GA)、溃疡(GU)、胃癌(GC), 在微需氧的条件下, 培养出H. pylori 222例, 并用标准的酚-氯仿方法提取菌种DNA后经聚合酶链反应及琼脂糖凝胶电泳对cagA, vacA, iceA基因亚型进行检测. 同时取胃窦、体、角黏膜各1块, 经石蜡切片, HE染色, 行组织病理学诊断.
结果: GA组感染m2(43.1%)亚型菌株构成比最高, 与GU(18.2%)和GC(17.9%)组相比差异有统计学意义(P = 0.015, P = 0.020), 与GS(30.00%)组相比差异没有统计学意义(P = 0.084). 在GA组中,感染s1m2亚型菌株有22例(44.9%), 与本组病例中其他基因亚型相比差别均有统计学意义, 与GU、GC组感染s1m2亚型菌株相比差别有统计学意义(P = 0.039), 与GS组相比差别没有统计学意义(P = 0.067).
结论: 中国辽宁地区人群感染s1m2型菌株与萎缩性胃炎发生有关.
引文著录: 宫月华, 柳云恩, 孙丽萍, 董楠楠, 袁媛. 中国辽宁地区人群幽门螺杆菌感染菌株与相关性胃疾病的关系. 世界华人消化杂志 2007; 15(33): 3462-3467
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 28, 2007
AIM: To explore the relationship between Helicobacter pylori infection and associated gastric diseases.
METHODS: Gastric biopsies were taken from 491 subjects, which were divided into supreficial gastritis (GS), atrophic gastritis (GA), gastric ulcer (GU) and gastric cancer (GC) groups, and 222 H. pylori strains isolated from these patients were studied by PCR for differences in their genotypes cagA, vacA, and iceA. Three biopsies were taken for pathological diagnosis, from the gastric antrum, corpus and angularis, respectively.
RESULTS: The H. pylori m2 infection rate in GA, GU and GC groups was 43.1%, 18.2% and 17.9%, respectively, and there was a statistical difference (P = 0.015 and P = 0.020). Twenty-two s1m2 subtype strains (44.9%) were found in GA group and there was a statistical difference compared with GU and GC groups (P = 0.039) but not with GS group (P = 0.067).
CONCLUSION: There is a positive relationship between infection with H. pylori s1m2 strain and GA.
- Citation: Gong YH, Liu YE, Sun LP, Dong NN, Yuan Y. Relationship between Helicobacter pylori infection and associated gastric diseases in Liaoning Province of China. Shijie Huaren Xiaohua Zazhi 2007; 15(33): 3462-3467
- URL: https://www.wjgnet.com/1009-3079/full/v15/i33/3462.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i33.3462
幽门螺杆菌(H. pylori)在人的胃内定植, 是引起慢性胃炎的主要原因, 并与消化性溃疡、胃癌、B淋巴细胞相关性淋巴瘤的发生密切相关[1]. 研究表明, 通常H pylori感染者发生浅表性胃炎很普遍, 但只有少数感染者会出现严重的临床结局, 如消化性溃疡、萎缩性胃炎、胃癌等. 这与环境因素, 宿主特性及H. pylori致病因子的存在密切相关. DNA指纹图和限制性片段长度多态等方法研究表明, 在H. pylori不同分离株间存在巨大的遗传变异, 其遗传异质性大于多种细菌[2-3]. 有证据表明, 这些遗传学的差别影响毒力因子的功能和抗原性, 对于产生不同的临床结局具有重要作用[4]. 特别是H. pylori致病相关基因: 如cagA, vacA和iceA等的差异, 与感染的临床结局密切相关[5-6]. H. pylori cag毒力基因岛(cagPAI)大约由30几个基因构成, 毒素相关基因A(cytotoxin-associated gene A, cagA)位于致病岛的5'端, 编码分子质量为120-140 kDa蛋白质. 空泡毒素基因(valculating toxin gene A, vacA)编码产物为空泡毒素, 是H. pylori诱导体外胃上皮细胞产生空泡的主要毒素, 其基因包括信号区(s区)和中间区(m区). vacA基因的s区编码信号肽, 具有s1和s2两个不同的等位基因. s1又分为s1a, s1b, s1c. vacA基因的m区具有两个不同的等位基因, 分别为m1和m2, 其中前者又包括m1a, m1b, m1c; 后者包括m2a, m2b. 在西方国家的研究表明, vacA和cagA的出现与消化性溃疡密切相关, 然而在亚洲国家却未发现二者有相关性. 这种东西方之间的差异可能是由于不同地区感染的H. pylori菌株基因结构的差异造成的. 感染cagA+菌株的患者更容易发生消化性溃疡, 萎缩性胃炎及胃癌等[7-10]. 在欧美一些地区, 特殊的vacA s1m1基因型菌株是致病性的标志, 这样的菌株在体外产毒活性高, 在体内可以引起严重的上皮细胞损伤[11]. vacA和cagA基因全球分布的这种差异可能反应了不同地区报道的vacA和cagA基因型与临床结局关系的差别. 与上皮细胞接触而产生的基因(induced by contact with epithelium, iceA)有两个主要的等位基因变异, iceA1和iceA2[12]. 这些变异的功能目前尚不清楚, 但iceA1基因与编码限制性内切酶的nlaⅢ具有同源性[13]. 当细菌与胃上皮细胞接触时iceA1表达上调, 与消化性溃疡的发生有关[12]. iceA2基因的功能目前尚不清楚.中国辽宁地区H. pylori cagA和vacA、iceA基因亚型菌株感染与胃疾病的关系如何至今尚无报道. 本研究拟通过了解中国辽宁地区H. pylori致病基因型的分布, 探讨该地区细菌致病基因的疾病相关性, 为揭示H. pylori的致病机制及监测H. pylori相关性胃疾病的高危人群提供线索.
选取1999-2004年在庄河地区接受胃镜普查患者活检标本355例, 男174例, 女181例, 年龄21-79(平均年龄49.33)岁. 沈阳临床胃镜活检标本136例, 男69例, 女67例, 年龄25-78(平均48.61)岁. 取新鲜胃黏膜4块, 其中3块(胃窦、体、角各1块)进行病理组织学检查, 另1块(胃窦)进行H. pylori培养. 采用脑心浸液琼脂培养基(BHI agar, 美国Difco公司)培养, 其中包含70 g/L的脱纤维羊血, 4 g/L的添加剂(美国BD公司), 8 mg/L两性酶素B(美国Sigma公司), 5 mg/L磺胺增效剂(美国Sigma公司), 6 mg/L万古酶素(美国礼来公司).
1.2.1 H. pylori培养及阳性菌落的判定: 采用脑心浸液琼脂培养基培养, 放入37℃, 含50 mL/L O2, 100 mL/L CO2, 850 mL/L N2, 相对湿度95%的培养箱中, 培养3-6 d后观察结果. 阳性菌落的判定通过培养基上生长的典型菌落, 革兰染色, H. pylori通用型引物ureB检测出现阳性条带. 将收集到的菌落, 放入新鲜胃黏膜保存液中500 μL(胰蛋白酶消化的酱油肉汤粉末7.5 g+甘油50 mL+ddH2O 200 mL), 吹打混匀, -70℃保存.
1.2.2 DNA的提取: 菌种离心, 10 000 g, 5 min, 弃上清, 加入318 μL TE缓冲液, 吹打均匀, 加入10% SDS 80 μL, 20 g/L的蛋白酶K 2 μL, 混匀. 55-60℃, 水浴过夜, 加入等体积的酚:氯仿:异戊醇(25:24:1), 混匀, 离心10 000 g, 10 min. 吸取上层水相, 再加入等体积的氯仿: 异戊醇(24:1), 重复以上两步一次. 吸上层水相, 加1/10体积3 mol乙酸钠轻摇. 加入2.5倍体积的预冷无水乙醇, -30℃放置30 min或-20℃ 2 h; 10 000 g 15 min, 倒去上清, 或用无菌细玻璃棒搅缠出DNA, 700 mL/L乙醇洗2次. 待乙醇蒸干后重新溶于50-100 μL TE缓冲液中.
1.2.3 cagA、vacA、iceA的聚合酶链反应:H. pylori完整的DNA经琼脂糖凝胶电泳分析, 溴化乙锭染色观察. 聚合酶链反应体系为20 μL. 其中包括10 pmol的引物, 0.5 μL的基因组DNA, 4种dNTP各2.5 mmol/L, 2.5 U Taq聚合酶(大连宝生物公司). 表1列出了PCR反应的引物序列及其预期片段大小. 其反应条件如下: cagA: 94℃ 1 min, 50℃ 1 min, 72℃ 1 min, 72℃ 5 min; vacA: 94℃ 1 min, 52℃ 1 min, 72℃ 1 min, 72℃ 5 min; iceA: 94℃ 1 min, 55℃ 1 min, 72℃ 1 min, 72℃ 5 min. 扩增产物经20 g/L琼脂糖凝胶电泳分析, 紫外凝胶成像系统观察, 照相.
| 扩增的基因序列 | 引物 | 引物序列(5'-3') | PCR产物的长度(bp) |
| cagA | CAGAF | GGCAATGGTGGTCCTGGAGCTAGGC | 324 |
| CAGAR | GGAAATCTTTAATCTCAGTTCGG | ||
| vacA s1和s2 | VA1-F | ATGGAAATACAACAAACACAC | 259/286 |
| VA1-R | CTGCTTGAATGCGCCAAAC | ||
| m1a | VA3-F | GGTCAAAATGCGGTCATGG | 290 |
| VA3-R | CCATTGGTACCTGTAGAAAC | ||
| m1b | VAm-F3 | GGCCCCAATGCAGTCATGGAT | 291 |
| VAm-R3 | GCTGTTAGTGCCTAAAGAAGCAT | ||
| m2 | VA4-F | GGAGCCCCAGGAAACATTG | 352 |
| VA4-R | CATAACTAGCGCCTTGCAC | ||
| iceA1 | IceA1F | GTGTTTTTAACCAAAGTATC | 247 |
| IceA1R | CTATAGCCASTYTCTTTGCA | ||
| iceA2 | IceA2F | GTTGGGTATATCACAATTTAT | 229/334 |
| IceA2R | TTRCCCTATTTTCTAGTAGGT |
统计学处理 采用SPSS软件包进行c2或Fisher精确检验, P<0.05差异有统计学意义.
491例胃黏膜共培养出H. pylori 222例, 其中, 来自浅表性胃炎(GS)患者110例, 萎缩性胃炎(GA)51例, 溃疡(GU)33例, 胃癌(GC)28例.
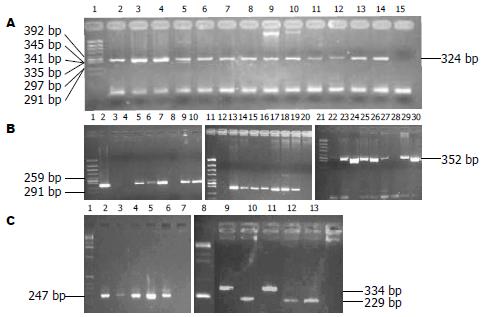
利用cagA 5'端保守区域PCR引物(表1)对cagA基因进行检测(图1A). 在GS, GA, GU, GC中, cagA+菌株分别有103例(93.6%), 50例(98.0%), 33例(100%), 28例(100%). 在各类疾病组中都占有优势, 与同种疾病间cagA-菌株相比差异有统计学意义(P<0.05).cagA+菌株在各疾病组间分布差异没有统计学意义(P>0.05)(表2).
| 基因型 | GS | GA | GU | GC | Total |
| cagA+ | 103(93.6) | 50(98.0) | 33(100) | 28(100) | 214(96.4) |
| - | 7(6.4) | 1(2.0) | 0(0) | 0(0) | 8(3.6) |
| vacAs1 | 101(91.8) | 49(96.1) | 28(84.8) | 28(100) | 206(92.8) |
| s2 | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) |
| m1b | 23(20.9) | 6(11.8) | 4(12.1) | 2(7.1) | 35(15.8) |
| m2 | 33(30.0) | 22(43.1)a | 6(18.2)a | 5(17.9)a | 66(29.7) |
| m1bm2 | 50(45.4) | 16(31.4) | 17(51.5) | 17(60.7) | 100(45.0) |
| m- | 4(3.6) | 7(13.7) | 6(18.2) | 4(14.3) | 21(9.4) |
| s1m1b | 19(18.8) | 6(12.2) | 2(7.1) | 3(10.7) | 30(14.6) |
| s1m2 | 30(29.7) | 22(44.9)a | 6(21.4) | 6(21.4) | 64(31.1) |
| s1m1bm2 | 48(47.5)a | 14(28.6) | 14(50.0)a | 17(60.7)a | 93(45.2) |
| s1m- | 4(4.0) | 7(14.3) | 6(21.4) | 2(7.2) | 19(9.2) |
| iceA | |||||
| A1 | 14(12.7) | 9(17.6) | 2(6.1) | 2(7.1) | 27(12.2) |
| A2 | 11(10.0) | 2(3.9) | 1(3.0) | 4(14.3) | 18(8.1) |
| A1A2 | 83(75.4) | 40(78.4) | 30(90.9) | 21(75.0) | 174(78.4) |
| A- | 2(1.8) | 0(0) | 0(0) | 1(3.6) | 3(1.4) |
利用特异性PCR引物对vacA基因s区进行检测(图1B), 在GS, GA, GU, GC中, vacA s1菌株分别有101(91.8%), 49(96.1%), 28(84.85%), 28(100%)例, 在各类胃疾病中均占优势, 未检出有vacA s2菌株(表2). vacA s1菌株在各疾病组间分布差异没有统计学意义(P>0.05). 本组病例检出的vacA m等位基因亚型有m1, m2, m1m2混合型及m-. GA组感染m2(43.1%)亚型菌株构成比最高, 与GU(18.2%)和GC(17.9 %)组相比差异有统计学意义(P = 0.015, P = 0.020), 与GS(30.0%)组相比差异没有统计学意义(P = 0.084). 根据对vacA s区和m区的分析, 共检测到vacA s1m1b, vacA s1m2, vacA s1m1bm2, vacA s1m-等几种基因型组合. 在GS, GU, GC组中均以感染vacA s1m1bm2亚型组合菌株为最高, 其中GS 48例(47.5%)、GU14例(50.0%)、GC17例(60.7%), 与同种疾病中其他基因型组合相比差别有统计学意义(P<0.05), 与GA组中vacA s1m1bm2亚型组合相比差别有统计学意义. 在GA组中感染s1m2亚型菌株有22例(44.9%), 与本组病例中其他基因亚型相比差别均有统计学意义(P<0.05), 与GU、GC组感染s1m2亚型菌株相比差别有统计学意义(P = 0.039), 与GS组相比差别没有统计学意义(P = 0.067).
利用特异性引物对iceA1, iceA2等位基因进行检测(图1C). 在222例菌株中iceA基因亚型在同一疾病组以及同一基因亚型在不同疾病组中分布差异均没有统计学意义(P>0.05).
H. pylori感染的普遍性高, 且容易作为一个重要的致病因子引发消化系统的疾病. 感染H. pylori的个体是否发病, 一方面与宿主基因易感性和环境因素有关[14-15], 另一方面与所感染H. pylori菌株的型别(即存在不同毒力的H. pylori菌株)有关. 在感染了H. pylori的人群中大约只有15%的人发病[15], 因而对H. pylori的检测特别是菌株型别的检测就尤为重要. 依据cagA和vacA基因存在与否[16], 分为Ⅰ型和Ⅱ型. Ⅰ型可以产生cagA和vacA毒素, 而Ⅱ型不产生任何毒素. 在本研究中, cagA和vacA基因的检出率分别为96.4%, 92.8%, 因此本地区感染的菌株多数为具有产毒能力的Ⅰ型. 研究发现, 产毒素H. pylori在体内可以诱导更多的炎症细胞浸润, 在体外可以引起更强烈的自由基爆发, 而且活性氧代谢产物与萎缩及DNA突变的发生有关[17]. 如果H. pylori在胃内长期定植, cagA+/vacAs1型菌株与cagA-/vacAs2型菌株相比将更易引起多中心萎缩、肠化, 甚至DNA损伤. 而多中心萎缩以及肠化都是肠型胃癌发生过程中重要的胃黏膜改变[17]. 推测有可能这一型菌株能够提高胃上皮中活性氧对DNA的损伤作用或提高了胃上皮细胞的增殖而与胃癌变过程相关[18].
本研究中, 未发现cagA, iceA在不同疾病组中存在差别, 可能是由于不同地区感染的H. pylori菌株基因结构的差异造成的[19]. 而在GA中感染vacAs1m2型菌株构成比为44.9%, 与其他疾病组相比差别有统计学意义, 与GA中感染其他类型构成比相比差别有统计学意义. vacA基因编码的蛋白质, 是H. pylori的一种重要致病因子, 也是H. pylori毒力分型的标志, 与H. pylori感染者的临床发病有着密切的关系. vacA基因编码空泡毒素(vacA)可以诱导真核细胞发生空泡变性[15]. 在体外, s1m1型H. pylori菌株产生的毒性水平最高, s1m2型产生低于中等程度的毒性, s2m2型无毒性, 而基因型为s2m1的菌株尚未发现[11]. 完整的毒素活性部分与s1信号肽出现有关, 但据报道s1信号肽与m2中间区组合后对Hela少有或几乎没有毒素活性. Pagliaccia et al[20]利用vacA基因敲除菌株95-54的粗提取物和高纯化s1m2型蛋白作用于Hela细胞均未见有毒素活性. 然而在Hela细胞内表达此种毒素蛋白或是在细胞外作用于其他细胞系时可见毒素活性, 在原代培养的胃上皮细胞中也可以检测到毒素活性, 由此可见m2型毒素在体内是有活性的. 产生这种差别最可能的原因是在靶细胞表面存在与不同中间区结合的特异性受体. Yahiro et al[21]曾经指出m1和m2可以与细胞表面不同的受体结合. Fox et al[22]则认为s1m2型与十二指肠溃疡的发生有关. 土耳其Caner et al[23]研究发现vacA s1m2主要存在于慢性胃炎和十二指肠溃疡患者中. 台湾Chang et al研究发现, 与感染cagA(-)vacA(-)基因型菌株相比, 感染cagA vacA s1/m2型菌株与胃、十二指肠疾病的发生有关[24]. 也有学者报道空泡毒素的产生与萎缩性胃炎的发展有关. Cover et al[25]研究表明, 在没有其他H. pylori因子存在的情况下, 纯化的vacA毒素就可以诱导胃上皮细胞发生凋亡. Phadnis et al[26]发现VacA片段能够插入线粒体膜诱导细胞色素C的释放, 激活由caspase-3介导的细胞凋亡. 由细菌诱导的凋亡可以导致胃腺体的大量萎缩, 继而发生肠化、不典型增生、胃癌[27]. Karita et al[28]研究发现细胞内vacA蛋白的表达是预测H. pylori相关性GA是否发展为GC的有利指标. GA通常伴有胃壁细胞减少和发生GC的风险提高. Oh et al[29]利用缺少壁细胞的转基因小鼠研究发现, 壁细胞的缺失有利于来自GA患者H. pylori在胃干细胞的黏附、进入和定植, 并且在GA的发展过程中, H. pylori相关的金属摄取利用途径、外膜蛋白、毒力因子等结构都可能会发生改变. 在GA中感染s1m2型菌株与上述改变有何关系尚待进一步研究. 我们推测, 在GA的发展过程中, 胃上皮细胞可能发生了某些结构改变, 具有了更多与m2型毒素结合的位点, 或者对与疾病发生有关的菌株进行了适应性选择, 更有利于毒素与细胞间的相互作用, 感染s1m2型菌株与萎缩性胃炎发生有关. 有关感染不同型别的vacA毒素诱导胃上皮细胞凋亡、促进腺体萎缩有无差别目前尚不明确. 本研究中观察到的s1m2型与GA关系的确切机制尚有待进一步研究.
有证据表明, H. pylori不同分离株间存在巨大的遗传变异, 这些遗传学的差别影响毒力因子的功能和抗原性, 对于产生不同的临床结局具有重要作用. 因此研究H. pylori的毒力相关基因对于揭示其致病机制具有非常重要的意义.
已有研究发现, 不同地区人群感染的H. pylori菌株存在差异, 而H. pylori致病相关基因如cagA, vacA和iceA等的差异, 与感染的临床结局密切相关. 本文探讨了中国辽宁地区H. pylori cagA、vacA和iceA基因亚型菌株感染与胃疾病的关系, 为进一步揭示H. pylori的致病机制及地域性特征提供线索和帮助.
西方国家的研究表明, vacA和cagA的出现与消化性溃疡密切相关, 然而在亚洲国家却未发现二者有相关性. 这种东西方之间的差异可能是由于不同地区感染的H. pylori菌株基因结构的差异造成的. vacA和cagA基因全球分布的这种差异可能反应了不同地区报道的vacA和cagA基因型与临床结局关系的差别.
西方本文结果发现, 在GA组中感染vacA s1m2亚型菌株有22例(44.9%), 与本组病例中其他基因亚型相比差别均有统计学意义, 与GU、GC组感染s1m2亚型菌株相比差别有统计学意义(P = 0.039), 与GS组相比差别没有统计学意义. 结果提示中国辽宁地区人群感染vacA s1m2型菌株与萎缩性胃炎发生有关.
本研究通过了解中国辽宁地区H. pylori致病基因型的分布, 探讨该地区细菌致病基因的疾病相关性, 为揭示H. pylori的致病机制及监测H. pylori相关性胃疾病的高危人群提供线索.
本文设计合理, 数据可信, 具有很强的学术价值.
编辑: 程剑侠 电编:李军亮
| 1. | Dunn BE, Cohen H, Blaser MJ. Helicobacter pylori. Clin Microbiol Rev. 1997;10:720-741. [PubMed] |
| 2. | Akopyants NS, Jiang Q, Taylor DE, Berg DE. Corrected identity of isolates of Helicobacter pylori reference strain NCTC11637. Helicobacter. 1997;2:48-52. [PubMed] |
| 3. | Marshall DG, Coleman DC, Sullivan DJ, Xia H, O'Morain CA, Smyth CJ. Genomic DNA fingerprinting of clinical isolates of Helicobacter pylori using short oligonucleotide probes containing repetitive sequences. J Appl Bacteriol. 1996;81:509-517. [PubMed] |
| 4. | Wu CC, Chou PY, Hu CT, Liu ZC, Lin CY, Tseng YH, Lin NT. Clinical Relevance of the vacA, iceA, cagA, and flaA genes of Helicobacter pylori strains isolated in Eastern Taiwan. J Clin Microbiol. 2005;43:2913-2915. [PubMed] |
| 5. | Yamaoka Y, Kodama T, Gutierrez O, Kim JG, Kashima K, Graham DY. Relationship between Helicobacter pylori iceA, cagA, and vacA status and clinical outcome: studies in four different countries. J Clin Microbiol. 1999;37:2274-2279. [PubMed] |
| 6. | Linpisarn S, Suwan W, Lertprasertsuk N, Koosirirat C, Steger HF, Prommuangyong K, Phornphutkul K. Helicobacter pylori cagA, vacA and iceA genotypes in northern Thai patients with gastric disease. Southeast Asian J Trop Med Public Health. 2007;38:356-362. [PubMed] |
| 7. | Mattar R, Marques SB, Monteiro Mdo S, Dos Santos AF, Iriya K, Carrilho FJ. Helicobacter pylori cag pathogenicity island genes: clinical relevance for peptic ulcer disease development in Brazil. J Med Microbiol. 2007;56:9-14. [PubMed] |
| 8. | Handa O, Naito Y, Yoshikawa T. CagA protein of Helicobacter pylori: a hijacker of gastric epithelial cell signaling. Biochem Pharmacol. 2007;73:1697-1702 PubMed. |
| 9. | Schneller J, Gupta R, Mustafa J, Villanueva R, Straus EW, Raffaniello RD. Helicobacter pylori infection is associated with a high incidence of intestinal metaplasia in the gastric mucosa of patients at inner-city hospitals in New York. Dig Dis Sci. 2006;51:1801-1809. [PubMed] |
| 11. | van Doorn LJ, Figueiredo C, Rossau R, Jannes G, van Asbroek M, Sousa JC, Carneiro F, Quint WG. Typing of Helicobacter pylori vacA gene and detection of cagA gene by PCR and reverse hybridization. J Clin Microbiol. 1998;36:1271-1276. [PubMed] |
| 12. | Peek RM Jr, Thompson SA, Donahue JP, Tham KT, Atherton JC, Blaser MJ, Miller GG. Adherence to gastric epithelial cells induces expression of a Helicobacter pylori gene, iceA, that is associated with clinical outcome. Proc Assoc Am Physicians. 1998;110:531-544. [PubMed] |
| 13. | Gong YH, Wang Y, Yuan Y. Distribution of Helicobacter pylori in north China. World J Gastroenterol. 2005;11:3523-3527. [PubMed] |
| 14. | Ruggiero P, Rossi G, Tombola F, Pancotto L, Lauretti L, Del Giudice G, Zoratti M. Red wine and green tea reduce H. pylori- or VacA-induced gastritis in a mouse model. World J Gastroenterol. 2007;13:349-354. [PubMed] |
| 15. | Cover TL, Blaser MJ. Purification and characterization of the vacuolating toxin from Helicobacter pylori. J Biol Chem. 1992;267:10570-10575. [PubMed] |
| 16. | Xiang Z, Censini S, Bayeli PF, Telford JL, Figura N, Rappuoli R, Covacci A. Analysis of expression of CagA and VacA virulence factors in 43 strains of Helicobacter pylori reveals that clinical isolates can be divided into two major types and that CagA is not necessary for expression of the vacuolating cytotoxin. Infect Immun. 1995;63:94-98. [PubMed] |
| 17. | Blaser MJ. Intrastrain differences in Helicobacter pylori: a key question in mucosal damage? Ann Med. 1995;27:559-563. [PubMed] |
| 18. | Yang KC, Chu A, Liao CS, Lin YM, Wang GM. Evaluation of the role of H. pylori infection in pathogenesis of gastric cancer by immunoblot assay. World J Gastroenterol. 2006;12:7029-7032. [PubMed] |
| 19. | Ito S, Azuma T, Murakita H, Hirai M, Miyaji H, Ito Y, Ohtaki Y, Yamazaki Y, Kuriyama M, Keida Y. Profile of Helicobacter pylori cytotoxin derived from two areas of Japan with different prevalence of atrophic gastritis. Gut. 1996;39:800-806. [PubMed] |
| 20. | Pagliaccia C, de Bernard M, Lupetti P, Ji X, Burroni D, Cover TL, Papini E, Rappuoli R, Telford JL, Reyrat JM. The m2 form of the Helicobacter pylori cytotoxin has cell type-specific vacuolating activity. Proc Natl Acad Sci U S A. 1998;95:10212-10217. [PubMed] |
| 21. | Yahiro K, Niidome T, Hatakeyama T, Aoyagi H, Kurazono H, Padilla PI, Wada A, Hirayama T. Helicobacter pylori vacuolating cytotoxin binds to the 140-kDa protein in human gastric cancer cell lines, AZ-521 and AGS. Biochem Biophys Res Commun. 1997;238:629-632. [PubMed] |
| 22. | Fox JG, Correa P, Taylor NS, Thompson N, Fontham E, Janney F, Sobhan M, Ruiz B, Hunter F. High prevalence and persistence of cytotoxin-positive Helicobacter pylori strains in a population with high prevalence of atrophic gastritis. Am J Gastroenterol. 1992;87:1554-1560. [PubMed] |
| 23. | Caner V, Yilmaz M, Yonetci N, Zencir S, Karagenc N, Kaleli I, Bagci H. H. pylori iceA alleles are disease-specific virulence factors. World J Gastroenterol. 2007;13:2581-2585. [PubMed] |
| 24. | Aknin J, Seguin P, Ouchchane M, Lucht F, Brunon J, Barral X. Takayasu's disease and post-traumatic scalp necrosis. Rev Stomatol Chir Maxillofac. 1991;92:101-104. [PubMed] |
| 25. | Cover TL, Krishna US, Israel DA, Peek RM Jr. Induction of gastric epithelial cell apoptosis by Helicobacter pylori vacuolating cytotoxin. Cancer Res. 2003;63:951-957. [PubMed] |
| 26. | Phadnis SH, Ilver D, Janzon L, Normark S, Westblom TU. Pathological significance and molecular characterization of the vacuolating toxin gene of Helicobacter pylori. Infect Immun. 1994;62:1557-1565. [PubMed] |
| 27. | Correa P, Miller MJ. Carcinogenesis, apoptosis and cell proliferation. Br Med Bull. 1998;54:151-162. [PubMed] |
| 28. | Karita M, Teramukai S, Matsumoto S, Shibuta H. Intracellular VacA is a valuable marker to predict whether Helicobacter pylori induces progressive atrophic gastritis that is associated with the development of gastric cancer. Dig Dis Sci. 2005;50:56-64. [PubMed] |
| 29. | Oh JD, Kling-Backhed H, Giannakis M, Xu J, Fulton RS, Fulton LA, Cordum HS, Wang C, Elliott G, Edwards J. The complete genome sequence of a chronic atrophic gastritis Helicobacter pylori strain: evolution during disease progression. Proc Natl Acad Sci U S A. 2006;103:9999-10004. [PubMed] |