修回日期: 2007-10-29
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 探讨组织解剖剥离小鼠空肠起博细胞的培养和亚甲蓝选择性标记鉴定方法, 为区分Cajal间质细胞亚型及其功能研究提供条件.
方法: 取CD1新生小鼠的空肠组织, 采用精细快速剥离, 取含有肌间丛及肌间丛Cajal间质细胞的纵行肌组织块进行培养. 新生发的细胞在成活状态下用亚甲蓝和c-kit特异性抗体标记, 证实细胞类型.
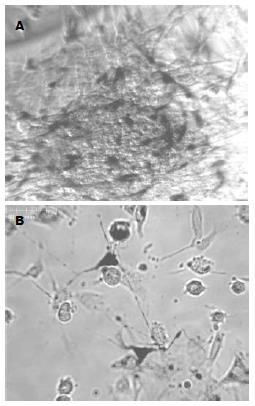
结果: 剥离组织所含Cajal间质细胞主要为肌间丛Cajal间质细胞(ICC-AP), 即起博细胞, 并具有其固有特征, 着色亚甲蓝细胞被c-kit抗体荧光染色证实为Cajal间质细胞, 而神经细胞、平滑肌细胞及其他亚型Cajal间质细胞在成活状态下均不被亚甲蓝着色.
结论: 组织解剖剥离能选择性获取空肠肌间丛起博细胞, 活染亚甲蓝标记能特异性区分出肌间丛起博细胞并可用于进一步的功能研究.
引文著录: 祝炼, 余保平, 吴志轩, 夏虹. 小鼠空肠Cajal间质细胞的分离、培养和亚甲蓝活染选择性标记. 世界华人消化杂志 2007; 15(32): 3439-3442
Revised: October 29, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To obtain intestinal pacemaker cells through dissection of the myenteric plexus of mouse jejunum, and to identify interstitial cells of Cajal (ICC) AP through selective staining with methylene blue for further electrophysiological study.
METHODS: Jejunum was removed from newborn CD-1 mice. The longitudinal muscle layer containing the myenteric plexus was cut into small pieces for culture. Live cells were stained with methylene blue and c-kit antibody.
RESULTS: Cells grown from explant culture and characterized by phenotypic features were identified as pacemaker cells, i.e. ICC-AP. Cells stained with methylene blue were also positive for c-kit antibody, whereas live neurons, smooth muscle cells and other types of ICC were not stained with methylene blue.
CONCLUSION: Pacemaker cells, i.e. ICC-AP, can be obtained through selective dissection. Methylene blue can be used for live staining identification of ICC-AP and, therefore, provides a model for further functional study.
- Citation: Zhu L, Yu BP, Wu ZX, Xia H. Culture of interstitial cells of Cajal from neonatal mouse jejunum and selective live staining with methylene blue. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3439-3442
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3439.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3439
消化道Cajal间质细胞(interstitial cells of Cajal,ICC)因分布于管壁的不同层面而被相应命名[1-2]. 不同区域的Cajal间质细胞有不同的结构和功能. 位于空肠肌间丛的Cajal间质细胞有起搏功能, 能产生节律性慢波而直接决定胃肠的蠕动及频律, 同时还参与神经肌肉间的信号传递和调节, 与多种消化道动力障碍性疾病密切相关[3]. 目前国内外学者虽可以成功的进行胃肠Cajal间质细胞的分离和培养, 但所采用的酶解法破坏了该细胞表面的kit蛋白, 并且不能区分Cajal间质细胞的亚型. 我们尝试新生小鼠空肠肌间丛Cajal间质细胞(ICC-AP)的分离、培养, 并采用亚甲蓝选择性标记及c-kit特异性染色, 为进一步开展消化道动力障碍性疾病研究积累了重要经验.
CD-1小鼠(2-6 d), 购自北京维通利华实验动物技术有限公司, 雌雄不拘. PSS的成分(mmol/L): NaCl 134.8, KCl 4.5, HEPES 10, CaCl2 2, MgCl2 1, Glucose 10, 以NaOH调节pH值至7.35. M-199培养基、胎牛血清购自Gibco公司, Alexa488标记的大鼠抗小鼠c-kit抗体购自Santa cruz公司, 亚甲蓝购自Sigma公司.
1.2.1 细胞分离和培养: 取新生鼠近端空肠约1.5 cm, 固定两端, 于横径两侧经浆膜各剪一小切口, 用镊子沿管壁将口端边缘轻轻提起牵拉, 呈脱套式剥离. 被剥离的肌块随即放置于M-199培养基中, 快速切成约0.5 mm2小块, 然后分别移至含有盖玻片的12孔培养板中, 在37℃含氧950 mL/L、二氧化碳50 mL/L的温箱内孵育. 培养基中含有100 mL/L胎牛血清, 100 kU/L青、链霉素和2 mmol/L谷氨酸胺.
1.2.2 亚甲蓝和c-kit抗体活染: 经过3-4 d的孵育, 种植肌块新生细胞向四周生发. 置换培养液体为含亚甲蓝(Methylene blue, 0.1 mmol/L)的PSS, 室温下连续充氧1 h后于倒置显微镜下观察. 然后加入荧光Alexa488标记的鼠c-kit mAb以证实亚甲蓝活染着色的特异性. 其主要方法如下, 50 mL/L的羊血清孵育30 min, PSS冲洗5 min×3 次, 加荧光标记的c-kit抗体室温下孵化1 h, PSS冲洗5 min×3次, 然后在荧光显微镜下观察.
培养3 d后的组织块形成细胞界限清楚、层次明显的细胞团. 新生发的细胞沿细胞团向周边蔓延而形成单层或多层, 其中Cajal间质细胞与平滑肌细胞伴行. 经亚甲蓝活染, 细胞团中的Cajal间质细胞着色, 呈现出特有的网状结构(图1A), 而外周Cajal间质细胞则易于聚焦, 表现出胞体呈三角形, 核大、胞质少、胞体多突起、细胞之间相互连接形成网络, 与平滑肌细胞伴行. 在亚甲蓝活染中呈均匀粉红或黑蓝色, 依时间长短而异, 着色部位在突起、胞体和胞核, 相邻着色的细胞经突起连接呈网络状, 镜下可见收缩运动. 少数坏死细胞的胞核可见亚甲蓝不均匀着色且胞膜缺损, 易于鉴别. 其他细胞如神经细胞、平滑肌细胞在成活状态下均不着色(图1B).
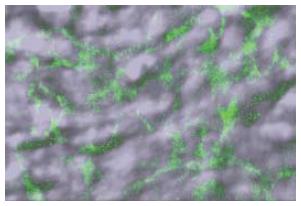
直接免疫荧光染色后, 在荧光显微镜下可见Cajal间质细胞呈c-kit阳性, 其同时也着色亚甲蓝(图2). 为进一步应证亚甲蓝活染Cajal间质细胞的特异性和敏感性, 我们急性分离成年小鼠肌条组织, 并采用亚甲蓝活染. 结果显示在肌间丛神经节干支之间及其四周富含Cajal间质起搏细胞的区域, 亚甲蓝着色阳性, 而其他细胞不着色(图3).
Cajal间质细胞的分离和培养不仅是研究和了解起搏细胞功能和特性的基础, 也是研究Cajal间质细胞发生发育过程的基本模型. 因此, 正确掌握Cajal间质细胞的培养和标记方法, 认清不同方法中的优势和弊端, 方能扬长避短. 酶解法可以获得业已生长之后的Cajal间质细胞, 如在培养液中加入干细胞因子可以帮助一定数量的Cajal间质细胞再生[4]. 但这种方法因多次反复的机械牵拉, 极易损伤Cajal间质细胞. 多种消化酶和诸多培养因子的作用, 会改变分离出和再生出Cajal间质细胞所固有的某些功能和特性[5-6]. Zhu et al[7]和Park et al[8]先后摸索出新生鼠和胎鼠在无酶消化条件下培养消化道Cajal间质细胞的方法. 近来也有学者采用原位法解决此问题[9-10], 即在组织上将肌间丛和肌间丛Cajal间质细胞进行暴露并用膜片钳进行功能试验. 我们采用组织解剖剥离法, 成功分离、培养出肌间丛Cajal间质细胞. 该方法极大程度上避免了牵拉, 新生鼠又含有大量自己所固有的生长因子, 避免了外加的化学反应, 使培养所得的Cajal间质细胞基本为原位, 富有原本生理特征. 因此他是目前研究Cajal间质细胞功能特性和发育过程比较理想的模型.
鉴定Cajal间质细胞特异的染色方法, 即c-kit(CD117和CD34)抗体的免疫组化检测已广泛用于Cajal间质细胞的分布、定性定量、Cajal间质细胞之间和Cajal间质细胞与其他类型细胞之间的相互关系[11-12]. 但是, 正如人们所知, 酪氨酸激酶的细胞表面跨膜受体c-kit不仅仅只在Cajal间质细胞中表达. 而且不同部位和不同功能特性的Cajal间质细胞也不能以c-kit抗体而进行区分. 免疫电镜也提示部分Cajal间质细胞c-kit(CD117)抗体反应呈阴性[13]. 而且, 在酶解法条件培养下, Cajal间质细胞还会在短期内衍生为平滑肌细胞或转化为介入Cajal间质细胞与平滑肌细胞两种特性皆有的c-kit阳性细胞[14]. 因此, c-kit阳性细胞并不一定就是Cajal间质细胞, 更不代表一定就是起博细胞. 在CD117抗体出现之前, 亚甲蓝是用于鉴定酵氏间质细胞的主要方法之一, 但因其应用的浓度、温度、时间、pH和溶液而使得着色细胞类型发生变化. Cajal本人, 作为发现和命名Cajal间质细胞者, 正是用亚甲蓝鉴定出Cajal间质细胞. Thuneberg首先发现Cajal间质细胞具有慢波起搏功能及在肌肉神经间具有传递信息作用, 也正是在亚甲蓝的鉴定中才认识并向人们推荐Cajal间质细胞[1], 并使之成为当今的一个热门研究领域. 我们采用亚甲蓝活染培养的Cajal间质细胞, 发现其能显现该细胞典型的形态学特征及网络状结构. 而神经细胞、平滑肌细胞在成活状态下均不着色, 从而能简单的将Cajal间质细胞与其他细胞鉴别. 免疫荧光染色显示c-kit阳性细胞同时也着色亚甲蓝, 进一步证实了该方法具有很高的特异性和敏感性. Zhu et al[7]的研究表明, 组织解剖剥离法所获得Cajal间质细胞为ICC-AP. 结合组织结构定位和特异性抗体标记, 我们认为亚甲蓝是鉴定ICC-AP的特异性标记物. 亚甲蓝活染培养的ICC-AP能更好的应用于随后的电生理功能研究.
我们在研究中发现, 亚甲蓝仅仅只着色于Cajal间质细胞中的起搏细胞. 据文献报导[9,15], 亚甲蓝着色ICC-AP可能是其染料在内质网不可逆沉积所至. 但在电镜研究中, 由于固定剂处理组织或细胞后, 会导致亚甲蓝大量脱色, 从而无法进行结构定位. 有关亚甲蓝着色的机制和可能存在的功能影响亟待进一步深入研究.
胃肠道Cajal间质细胞(ICC)的原代培养是进行发育和电生理功能研究的基础. 传统的酶解法, 破坏了细胞表面的kit蛋白, 且不能区分ICC的亚型.
原代培养ICC后, 研究神经递质等对ICC生长发育和电生理功能的调节是当前的研究热点. 但如何研究某一特定类型ICC是亟需解决的问题.
亚甲蓝活染能特异性研究肌间丛ICC的发育和电生理功能调节. 亚甲蓝活染标记ICC特异性强, 较荧光抗体染色简便易行, 为进一步的功能研究提供基础.
本文设计合理, 方法可靠, 结果准确, 结论有一定的参考价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Thuneberg L. One hundred years of interstitial cells of Cajal. Microsc Res Tech. 1999;47:223-238. [PubMed] |
| 2. | 吴 志轩, 余 保平, 夏 虹, 徐 龙. 小鼠空肠cajal间质细胞的分离与培养. 胃肠病学和肝病学杂志. 2005;14:455-457. |
| 3. | Vanderwinden JM, Rumessen JJ. Interstitial cells of Cajal in human gut and gastrointestinal disease. Microsc Res Tech. 1999;47:344-360. [PubMed] |
| 4. | Li CX, Liu BH, Tong WD, Zhang LY, Jiang YP. Dissociation, culture and morphologic changes of interstitial cells of Cajal in vitro. World J Gastroenterol. 2005;11:2838-2840. [PubMed] |
| 5. | Choi KM, Gibbons SJ, Roeder JL, Lurken MS, Zhu J, Wouters MM, Miller SM, Szurszewski JH, Farrugia G. Regulation of interstitial cells of Cajal in the mouse gastric body by neuronal nitric oxide. Neurogastroenterol Motil. 2007;19:585-995. [PubMed] |
| 6. | Ye J, Zhu Y, Khan WI, Van Snick J, Huizinga JD. IL-9 enhances growth of ICC, maintains network structure and strengthens rhythmicity of contraction in culture. J Cell Mol Med. 2006;10:687-694. [PubMed] |
| 7. | Zhu Y, Golden CM, Ye J, Wang XY, Akbarali HI, Huizinga JD. ERG K+ currents regulate pacemaker activity in ICC. Am J Physiol Gastrointest Liver Physiol. 2003;285:G1249-1258. [PubMed] |
| 8. | Park SJ, Mckay CM, Zhu Y, Huizinga JD. Volume-activated chloride currents in interstitial cells of Cajal. Am J Physiol Gastrointest Liver Physiol. 2005;289:G791-797. [PubMed] |
| 9. | Zhu Y, Ye J, Huizinga JD. Clotrimazole-sensitive K+ currents regulate pacemaker activity in interstitial cells of Cajal. Am J Physiol Gastrointest Liver Physiol. 2007;292:G1715-1725. [PubMed] |
| 10. | Hou X, Yin J, Liu J, Pasricha PJ, Chen JD. In vivo gastric and intestinal slow waves in W/WV mice. Dig Dis Sci. 2005;50:1335-1341. [PubMed] |
| 13. | Wang XY, Berezin I, Mikkelsen HB, Der T, Bercik P, Collins SM, Huizinga JD. Pathology of interstitial cells of Cajal in relation to inflammation revealed by ultrastructure but not immunohistochemistry. Am J Pathol. 2002;160:1529-1540. [PubMed] |
| 14. | Epperson A, Hatton WJ, Callaghan B, Doherty P, Walker RL, Sanders KM, Ward SM, Horowitz B. Molecular markers expressed in cultured and freshly isolated interstitial cells of Cajal. Am J Physiol Cell Physiol. 2000;279:C529-539. [PubMed] |
| 15. | Liu LW, Thuneberg L, Daniel EE, Huizinga JD. Selective accumulation of methylene blue by interstitial cells of Cajal in canine colon. Am J Physiol. 1993;264:G64-73. [PubMed] |