修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 观察重组人粒细胞集落刺激因子(rhG-CSF)对CCl4所致小鼠肝损伤的保护和治疗作用以及探讨rhG-CSF动员的外周血干细胞在受损肝组织内定植的能力.
方法: 清洁级BALB/c小鼠, ip 400 mL/L CCl4, 2 mL/kg, 每周2次, 诱导肝损伤, sc rhG-CSF 200 µg/kg进行预防和治疗. 观察各实验组小鼠的生存率、肝组织病理变化、肝功能等指标. 分别用免疫组化及流式细胞术观察肝组织中Thy-1和CD34阳性细胞变化, 用Y染色体原位杂交法观察rhG-CSF动员的♂小鼠外周血干细胞在肝受损伤的♀小鼠肝脏内的定居能力.
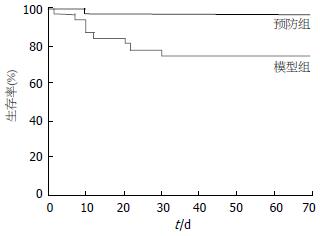
结果: rhG-CSF预防组小鼠的生存率、肝组织病理改变、肝功能的酶学指标均好于模型组(P<0.05). 治疗后30 d, rhG-CSF治疗组小鼠血清中肝功能酶学指标ALT和AST与对照组相比分别有显著性意义(1033.5±350.1 nkat/L vs 1983.7±616.8 nkat/L, P<0.01; 1817.0±483.4 nkat/L vs 3017.3±811.2 nkat/L, P<0.05). 治疗后8 d、15 d rhG-CSF组肝脏组织中Thy-1+和CD34+细胞明显多于对照组(P<0.05). 接受♂小鼠外周血干细胞移植的♀小鼠肝组织可见Y染色体阳性的细胞, 主要位于汇管区与中央静脉周围, 少数位于脾脏.
结论: rhG-CSF预防和治疗均能促进CCl4所致的小鼠肝损伤修复, 提高生存率.
引文著录: 王君平, 孙殿兴, 李兵顺, 李敏然, 郭争荣, 亢继文, 李伟勇. 粒细胞集落刺激因子防治小鼠CCl4所致肝损伤的作用. 世界华人消化杂志 2007; 15(32): 3395-3402
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To observe the effect of recombinant human granulocyte colony stimulating factor (rhG-CSF) on repair of CCl4-induced liver injury in mice, and to investigate the homing ability of peripheral blood stem cells mobilized by rhG-CSF to localize in the injured liver.
METHODS: Liver injury was induced by 400 mL/L CCl4 2 mL/kg in clean BALB/c mice twice a week and then treated. Then, with rhG-CSF 200 µg/kg sc. The mortality rate and liver pathology changes and liver functions and other factors were analyzed. Detection of CD34+ and Thy-1+ cells were performed with flow-cytometry and immunohistochemical staining respectively. The situ hybridization for Y chromosome in liver was tested to determine the homing ability of the peripheral blood stem cells of male mice mobilized by rhG-CSF to the injured liver of female mice.
RESULTS: Compared with the liver injury group, the mortality rate and changes in liver histology and function in the rhG-CSF prevention group were significantly lower (P < 0.05). Alanine aminotransferase and aspartate aminotransferase were significantly lower in the rhG-CSF treatment group at 30 days after CCl4 discontinuation than in the control group (1033.5 ± 350.1 nkat/L vs 1983.7 ± 616.8 nkat/L, P < 0.01; 1817.0 ± 483.4 nkat/L 3017.3 ± 811.2 nkat/L, P < 0.05). Compared with the control group, Thy-1+ and CD34+ cells in the liver of the rhG-CSF treatment group were increased on days 8 and 15 (P < 0.05). In situ hybridization in the liver of female mice transplanted with peripheral stem cells from male mice revealed that Y-chromosome- positive cells were found in the injured liver, which were mainly seen around the duct area and central vein, and a few in the spleen.
CONCLUSION: rhG-CSF prevention and treatment significantly promote recovery and improve survival after CCl4-induced liver injury.
- Citation: Wang JP, Sun DX, Li BS, Li MR, Guo ZR, Kang JW, Li WY. Effect of granulocyte colony stimulating factor on repair of CCl4-induced liver injury in mice. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3395-3402
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3395.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3395
在我国重型肝炎、肝硬化是常见病, 其病情危重, 而目前又缺乏有效的药物治疗, 最终的解决需行肝移植. 但由于肝移植来源因难, 免疫排斥反应及经费高, 在众多的患者中也只有少数人得以治疗, 所以目前病死率仍很高. 我们设计由CCl4诱导小鼠肝损伤, 通过血清学、肝组织病理等指标变化及异性干细胞移植原位杂交实验来分析干细胞动员剂-重组人粒细胞集落刺激因子(rhG-CSF)对肝损伤的修复作用及机制.
BALB/c小鼠113只, ♂101只、♀12只, 购自河北医科大学实验动物中心. rhG-CSF由华北制药金坦生物技术股份有限公司馈赠, CCl4由北京化工厂生产, 橄榄油为欧蕾特纯冷榨橄榄油, 大鼠抗小鼠CD34抗体、兔抗小鼠Thy-1抗体购自Santa Cruz公司, FITC-羊抗大鼠IgG抗体、羊抗兔IgG抗体购自中杉生物技术有限公司, Ficoll细胞分离液、小鼠Y染色体荧光探针染色试剂盒购自天津灏洋生物制品公司.
模型组52只, 400 mL/L CCl4 2 mL/kg, ip, 每周2次, 持续70 d制备动物模型, 然后随机分为治疗组和对照组, 各16只. 治疗组每日给予rhG-CSF 200 µg/kg, sc, 连续7 d. 对照组应用等量生理盐水, 分别于肝硬化模型制备终止8 d、15 d、30 d分批处死小鼠. 另rhG-CSF预防组25只, 在应用CCl4前先每日给予rhG-CSF 200 µg/kg, sc, 连续7 d. 应用CCl4过程中, 每隔20 d连续应用rhG-CSF 5 d. 模型组应用等剂量的生理盐水, 正常组6只.
1.2.1 外周血干细胞定居于受损伤肝脏的能力: 取♂小鼠18只, 每日用rhG-CSF 200 µg/kg, sc, 连续5 d, 每次3只. 然后处死♂小鼠并取外周血, 分离单个核细胞, 每周2次(星期二、五), 经尾静脉注射给经400 mL/L CCl4 2 mL/kg, ip, 每周2次(星期一、四)肝损伤的♀小鼠10只. 上述♀小鼠应用400 mL/L CCl4每周2次共3 wk, 接受♂小鼠外周血单个核细胞尾静脉注射也是每周2次共3 wk. 另外2只♀小鼠为对照, 400 mL/L CCl4应用剂量、次数同上述10只♀小鼠, 但尾静脉注射同剂量的生理盐水. 自最后一次移植30 d后处死♀小鼠.
1.2.2 观察指标: 小鼠肝功能由白求恩国际和平医院检验科自动生化分析仪检测. 透明质酸(HA)和层粘连蛋白(LN)用固相放射免疫法, 由白求恩国际和平医院同位素科专业人员检测. 肝组织病理标本用40 g/L甲醛固定, 应用常规HE染色. 肝纤维化程度分期诊断标准按2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订《病毒性肝炎防治方案》[1]. Y染色体原位杂交、Thy-1免疫组化(应用冰冻切片)及CD34流式细胞分析均按有关试剂盒说明或常规方法进行. Thy-1免疫组化结果分析: 每张片子随机观察5个高倍视野, 每个视野计100个细胞中的阳性细胞数, 取均值, 以百分数表示.
统计学处理 使用SAS8.0统计软件处理实验数据, 有关资料的指标采用mean±SD表示. 两样本均数的比较采用t检验, 等级资料、非参数检验采用秩和检验, 生存率或死亡率的比较采用对数秩和检验. P<0.05, 为差异有显著性.
rhG-CSF预防组25只, 死亡1只, 死亡率为4%. 模型组52只, 死亡12只, 死亡率为23%. 两组小鼠的生存率有显著性差异(P<0.05, 图1). 预防组与模型组肝功能相比, ALT(2908.9±86.9 nkat/L vs 4764.3±46.7 nkat/L, P<0.001)以及AST(3464.0±80.0 nkat/L vs 5789.5±140.0 nkat/L, P<0.001), ALB(22.0±0.8 g/L vs 20.3±1.0 g/L, P<0.01)均有显著性差异, 但TBIL(34.5±0.7 μmol/L vs 37.5±0.4 μmol/L, P>0.05)两组相比无差异性. 预防组HA和LN均低于模型组, HA(927.5±72.0 µg/L vs 1155.5±163.2 µg/L, P<0.05), LN(250.5±54.6 µg/L vs 475.6±90.3 µg/L, P<0.001)均有显著性差异. 肝损伤在rhG-CSF治疗后30 d时, 治疗组与对照组肝功能相比, ALT(1033.5±350.1 nkat/L vs 1983.7±616.8 nkat/L, P<0.01)以及AST(1817.0±483.4 nkat/L vs 3017.3±811.2 nkat/L, P<0.05)有显著性差异, 但ALB和TBIL两组相比无差异性.
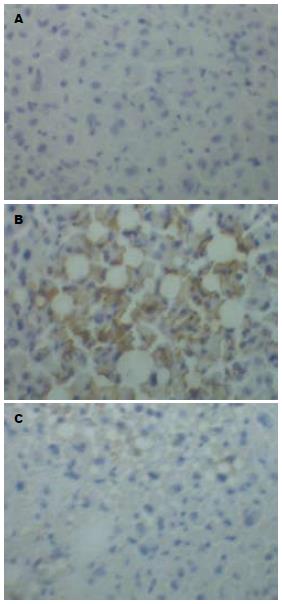
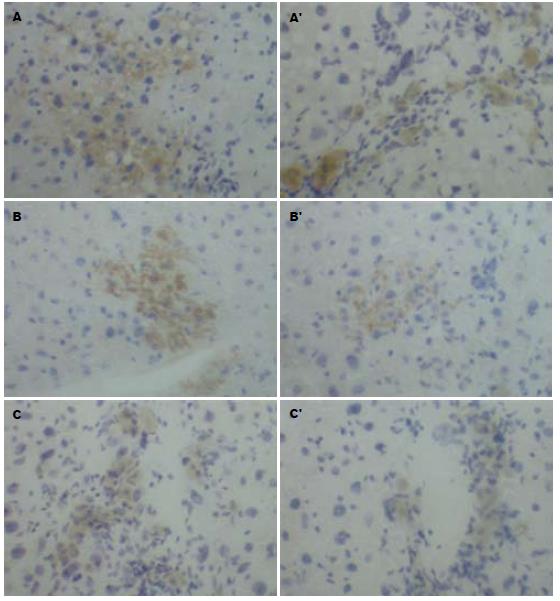
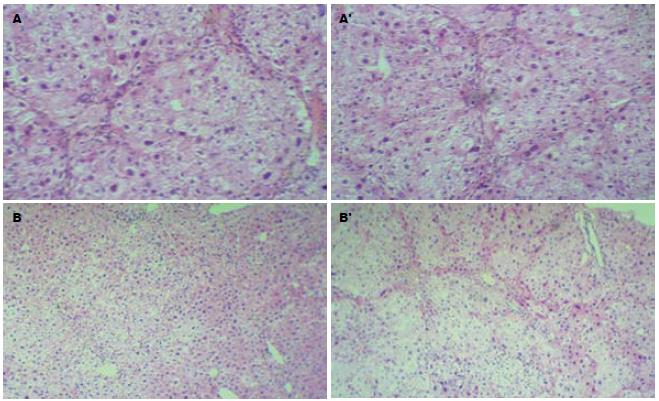
Thy-1阳性细胞着色定位于细胞膜与细胞质, 呈棕黄色均匀弥漫. 正常肝脏组织未发现Thy-1阳性细胞. 在肝硬化模型制备终止时, rhG-CSF预防组肝脏组织可见较多Thy-1阳性细胞, 主要在汇管区, 中央静脉周围, 肝脏组织内Thy-1阳性细胞, 相对含量为8.3%±1.2%. 模型组在汇管区发现少量的Thy-1阳性细胞, 相对含量为2.8%±0.6%, 两组相比有显著差异(P<0.01, 图2, 表1). 预防组小鼠肝组织和模型组小鼠肝组织的CD34+细胞数与正常组相比, 均有显著性差异(P<0.01), 预防组与模型组小鼠肝组织中CD34+细胞数相比也有显著性差异(P<0.05, 表1). 治疗后8 d和15 d, 治疗组与对照组小鼠肝组织中Thy-1阳细胞数分别为5.1%±1.3% vs 3.3%±0.8%和7.5%±1.4% vs 3.4%±0.9%, 均有显著性差异(P<0.05), 30 d时两组小鼠肝组织中Thy-1阳细胞数均下降但无明显差异(3.2%±0.6% vs 2.3%±0.6%, P>0.05, 图3). 治疗组小鼠肝组织CD34+细胞数高于对照组, 且8 d、15 d时治疗组与对照组小鼠肝组织中的CD34+细胞数相比均有显著性差异(P<0.05). 但30 d时两组小鼠肝组织中的CD34+细胞数均有所下降, 且无明显性差异(P>0.05, 表1).
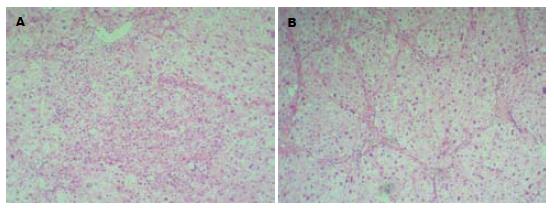
模型组中可见典型的假小叶形成, 预防组与模型组相比肝脏纤维化程度明显较轻(P<0.05, 图4). 治疗组与对照组相比, 于8 d、15 d时, 两组的纤维化程度比较无显著性差异. 但于30 d时, 对照组肝脏纤维增生仍明显, 仍有纤维隔, 部分肝组织小叶结核紊乱. 而治疗组明显改善, 治疗组肝脏恢复明显好于对照组(P<0.05, 图5).
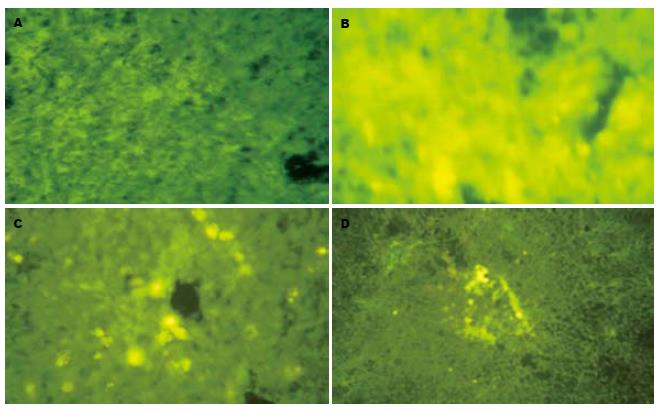
未接受♂小鼠外周血干细胞移植的♀小鼠肝组织为阴性对照, 未见Y染色体阳性细胞. 设♂小鼠肝组织为阳性对照, Y染色体原位杂交阳性细胞为黄绿色荧光. 在正常♂小鼠肝组织Y染色体荧光着色明显增强、增多, 在接受移植的受体♀小鼠肝组织内发现Y染色体阳性的肝细胞, 主要位于汇管区与中央静脉周围. 同时做心、肺、肾、脾Y染色体原位杂交, 心脏、肺脏、肾脏组织内未发现Y染色体阳性细胞, 脾脏可见数个Y染色体阳性细胞(图6).
肝脏是一个结构与功能相对复杂、再生能力极强的器官. 成体肝脏损伤后, 肝实质的维持和再生主要有3个细胞来源: 成熟的肝细胞、肝脏内的干细胞和肝外来源的干细胞(血液循环或骨髓来源的细胞)[2-3]. 以上这3种细胞处于动态平衡中. 当肝损伤严重时, 成熟肝细胞增生会受到限制, 骨髓干细胞及肝脏内的干细胞才会被活化、增殖, 然后迁移到受损伤的肝脏实质, 并进一步分化为肝细胞和胆管细胞, 修复和重建肝脏[4-6]. 骨髓干细胞(bone marrow stem cells , BMSCs)主要有两类干细胞群体: 造血干细胞和间充质干细胞, 而他们都具有多种分化潜能, 具有分化为肝细胞的能力. 王韫芳 et al[7]用丙烯醇致肝损伤微环境, 经门静脉输入标记好的骨髓干细胞, 移植3 d后, 在肝组织切片汇管区周围发现大量标记的阳性细胞, 7-10 d出现环状分布的外源性细胞, 至14-21 d进一步增多, 这些外源性的细胞大量高表达白蛋白. 而把骨髓干细胞移植于正常肝脏的大鼠体内, 则几乎未见阳性细胞表达. Sakaida et al[8]建立小鼠CCl4肝损伤模型, 尾静脉注射标记了绿色荧光蛋白的骨髓干细胞, 5-8 wk后发现所有细胞均到达肝脏, 并进一步论证了骨髓来源的干细胞有助于减轻CCl4诱导的小鼠肝纤维化. 史明霞 et al[9]也用CCl4制备肝纤维化模型, 经尾静脉注射分离的FIKI+间充质干细胞, 5 wk后, 注射FIKI+间充质干细胞组的小鼠肝纤维程度明显减轻, 认为可能是由于FIKI+间充质干细胞启动的肝细胞内源性修复程序而起作用, 这都说明骨髓干细胞具有向肝损伤部位迁移, 并在受损伤的肝脏定居、转化, 减轻肝损伤的作用.
rhG-CSF动员自体骨髓干细胞治疗急性心肌梗死和脑中风的有效性、安全性、可行性已被许多基础研究所证实[10-13]. 目前在临床上已应用G-CSF治疗急性心肌梗死、急性缺血性脑卒中患者在国内外均有报道, 并取得满意疗效[14-16]. 在本实验中, 我们研究rhG-CSF动员自体骨髓干细胞对肝损伤的作用, 发现rhG-CSF预防组小鼠死亡率明显低于模型组小鼠, 肝组织病理损伤程度及肝功能指标均好于模型组小鼠, 说明rhG-CSF可降低CCl4所致肝损伤小鼠死亡率, 减轻肝损伤, 对肝损伤具有保护作用, 这与文献报道结果一致[17-19]. rhG-CSF直接动员骨髓干细胞到外周血可提高实验性小/大鼠的生存率、保护肝功能、明显改善肝损伤, 并认为这种作用与rhG-CSF启动肝再生的内源性程序、改善肝再生有关. 具体机制尚不清楚.
HA是由间质细胞合成分泌的, 其代谢大部分由肝脏内皮细胞完成. 慢性肝病时由于肝脏代谢能力下降, 肝窦内皮细胞清除减少, HA释放入血. 肝硬化时因肝功能损害累及内皮细胞功能, 摄入和分解HA的能力下降, 均使血清HA水平增高. LN是构成基底膜的主要成分, 在细胞黏附、分化和基因表达起重要作用, 其血清含量与肝组织汇管区和小叶内炎症相关, 与肝纤维化程度平行. 血清中的HA、LN的含量能较好地反映肝脏的状况及慢性肝病的严重程度, 且随着肝纤维化程度的加重而升高. 在本实验中, rhG-CSF预防组小鼠血清中HA和LN均低于模型组小鼠, 反映了rhG-CSF预防组小鼠肝损伤程度轻, 说明rhG-CSF可以减轻CCl4所致小鼠肝损伤的肝纤维化程度, 从另一方面也说明了rhG-CSF对肝损伤具有保护作用. rhG-CSF作为骨髓干细胞动员剂, 具有同时动员骨髓造血干细胞及间充质干细胞的能力[20]. 间充质干细胞可以抑制肝星状细胞的增殖和活化, 而肝星状细胞的增殖与活化是肝纤维化形的关键因素[21-23], 这也从一个方面解释了rhG-CSF预防组的肝纤维化程度轻的原因.
Huling et al[24]证明, 把G-CSF动员后的外周血干细胞经门静脉注入肝切除70%的F344大鼠体内, 可以提高肝再生的细胞数, 并促进肝脏功能的恢复. 在本实验中, 治疗组小鼠的肝组织病理变化、肝功能与对照组相比, 治疗后8 d、15 d时两组无明显变化, 但在30 d时治疗组肝功能、肝组织病理变化等有关指标明显好于对照组, 说明rhG-CSF可以加速CCl4所致小鼠肝损伤的修复. CD34+细胞在正常肝组织中的小血管内皮细胞表达, Thy-1+在正常成年肝脏中并不表达, 但他们两者均在活化的肝卵圆细胞(肝的干细胞)和骨髓造血干细胞表达[25-26]. 在肝损伤实验中, 预防组的CD34+细胞数及Thy-1+细胞数都显著高于模型组, 这是因为rhG-CSF动员干细胞的作用. rhG-CSF治疗组与对照组CD34+和Thy-1+细胞数变化趋势, 一方面说明CCl4所致的小鼠慢性肝损伤本身也具有动员骨髓造血干细胞和/或肝的干细胞参与肝损伤的修复, 但是这种自发的作用是很小的, 而rhG-CSF动员后这种作用明显增加. 另一方面也说明rhG-CSF动员后, 较多骨髓造血干细胞进入损伤的肝组织和/或较多的肝干细胞被活化参与肝细胞再生. 随着时间的推移, 骨髓造血干细胞和/或肝的干细胞渐向成熟的肝细胞分化, 肝组织内CD34+和Thy-1+细胞数表达渐减少, 从而改善肝功能、促进肝损伤修复. 刘峰 et al[27]研究发现, G-CSF动员自体骨髓干细胞可以促进部分肝移植物的再生, 在移植后第3-14 d动员组汇管区可见较多的CD34+细胞, 且动员组的受体生存率明显提高, 移植肝再生明显, 肝损伤轻, 考虑可能与造血干细胞参与肝再生有关.
已证实骨髓干细胞可在受损伤的肝脏内定植、转化为肝细胞参与肝损伤的修复. 在本实验中, 我们把经rhG-CSF动员的♂小鼠的外周血干细胞经尾静脉移植给肝受损伤的♀小鼠, 然后通过原位杂交, 在接受移植的受体♀小鼠肝组织内发现Y染色体阳性的肝细胞, 主要位于汇管区与中央静脉周围, 同时做心、肺、肾、脾Y染色体原位杂交, 心、肺、肾组织未发现Y染色体阳性细胞, 脾组织内可见数个Y染色体阳性细胞, 证明外周血干细胞具有向肝损伤部位迁移、归巢并在损伤部位定居的特性. 同时也对我们前面实验的结果即rhG-CSF具有对肝损伤的保护作用以及促进肝损伤恢复作用的有效性提供了有力的依据. 而直接用rhG-CSF动员自体干细胞更简便, 且不存在伦理问题与组织配型和免疫排斥问题, 具有操作方便、无损伤、成本低、便于临床应用的等优点.
rhG-CSF对肝损伤具有保护作用以及加速肝损伤的恢复, 减轻肝纤维化程度, 可能与下列因素有关. 除了前面提到的rhG-CS动员间充质干细胞从而抑制肝星状细胞增殖与活化外, 间充质干细胞还可减少肝组织胶原沉积, 减少平滑肌动蛋白和转化生因子β受体表达[28]. rhG-CSF动员骨髓干细胞, 而骨髓干细胞在肝纤维化形成环境中向肝细胞定向分化, 不向肌成纤维样细胞分化. 这样, 通过骨髓干细胞分化可能有助于补充肝纤维化形成环境中丧失的肝细胞, 而不会使肝纤维化形成的关键细胞-肌成纤样细胞大量增加, 从而减轻肝纤维化[29]. 骨髓干细胞在肝损伤、肝纤维化环境中存活、增殖并向肝细胞分化, 表达肝脏特异的角蛋白CK-18. 同时骨髓细胞通过分泌细胞因子刺激受体肝细胞再生, 间接影响某些胶原降解因子表达, 如uPA(激酶样纤溶酶原活化物), 促进胶原和ECM的降解, 逆转肝纤维化, 促进肝小叶结构的恢复[30]. rhG-CSF作用于机体后, 启动内源性肝干细胞再生, 保护肝功能、加速损伤的恢复. rhG-CSF通过激活其受体和细胞内的一些信号传导途径如Akt(蛋白激酶B)等而直接作用于受损伤的组织[31-32], 而发挥其保护作用和促进肝细胞的再生.
rhG-CSF动员使损伤的肝脏加速恢复, 这既有骨髓干细胞参于肝损伤修复的作用, 也可能有肝内源性肝再生参于损伤修复所起的作用, 其详细机制尚需要进一步研究. 但rhG-CSF可减轻CCl4所致的小鼠肝损伤, 并可改善肝功能、加速肝损伤修复的作用, 将为临床上治疗重症肝炎及难治性肝硬化患者提供了一个更方便、经济、有效的新方法.
肝硬化在我国是常见病, 但由于其病情危重, 而目前又缺乏有效的药物治疗, 最终的解决需要做肝移植. 但由于肝移植来源因难, 免疫排斥反应及经费高, 在众多的患者中也只有少数人得以治疗, 所以目前病死率仍很高. 骨髓干细胞的研究为之提供了新希望. 通过rhG-CSF动员骨髓干细胞, 并验证动员到外周血的干细胞在肝内沉积、转化对肝组织损伤的修复作用, 寻求一种在重型肝炎、肝硬化治疗上方便、可行、有效的新方法.
肝干细胞及骨髓干细胞移植治疗肝病是近来研究的热点. 但干细胞分离方法复杂, 移植途径的多样, 移植后血栓形成等有关问题, 阻碍了干细胞移植的临床应用. 本实验用rhG-CSF动员自体骨髓干细胞对肝损伤的保护及修复作用, 不存在上述问题, 是一种治疗肝病更方便、可行的新方法.
国外有研究粒细胞集落刺激因子直接动员造血干细胞到外周血对肝损伤可起到明显的改善作用的个别报道, 但国内未见类似动物实验研究报道.
本文阐述重组人粒细胞集落刺激因子直接动员造血干细胞到外周血, 利用干细胞具有向肝脏定向迁移的特性, 并在损伤部位沉积、转化为肝细胞, 并促进肝损伤的修复, 且具有操作方便、无副作用、无排斥反应、成本低、便于临床应用的优点.
通过验证重组人粒细胞集落刺激因子直接动员造血干细胞到外周血, 并具有预防肝损伤和促进肝损伤的修复作用, 为临床治疗重型肝炎、肝硬化等终末期肝脏疾病提供更方便、经济和更有效的新方法, 有较好临床应用前景.
骨髓干细胞: 是重要的成体干细胞. 研究表明成体干细胞具有多向分化潜能, 可以演变成为与其组织发育或与其再生来源无关的多种组织的细胞. 骨髓干细胞在特定的环境下可分化为多种组织细胞, 如心肌细胞、神经细胞、肝细胞等.
本文课题设计严谨、内容新颖, 创新性强. 本研究拟探索一条治疗肝硬化的新方法, 有较好的临床应用前景.
编辑: 何燕 电编:李军亮
| 3. | Fausto N. Liver regeneration and repair: hepatocytes, progenitor cells, and stem cells. Hepatology. 2004;39:1477-1487. [PubMed] |
| 4. | Eglitis MA, Mezey E. Hematopoietic cells differentiate into both microglia and macroglia in the brains of adult mice. Proc Natl Acad Sci U S A. 1997;94:4080-4085. [PubMed] |
| 5. | Ferrari G, Cusella-De Angelis G, Coletta M, Paolucci E, Stornaiuolo A, Cossu G, Mavilio F. Muscle regeneration by bone marrow-derived myogenic progenitors. Science. 1998;279:1528-1530. [PubMed] |
| 6. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] |
| 7. | 王 韫芳, 南 雪, 尉 承泽, 李 艳华, 张 锐, 管 立东, 岳 文, 裴 雪涛. 丙烯醇致肝损伤微环境定向诱导骨髓干细胞向肝细胞分化. 中华肝脏病杂志. 2005;13:274-277. |
| 8. | Sakaida I, Terai S, Yamamoto N, Aoyama K, Ishikawa T, Nishina H, Okita K. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice. Hepatology. 2004;40:1304-1311. [PubMed] |
| 10. | 徐 新, 马 绍椿, 罗 东云, 唐 良秋, 林 拓, 张 昌瑞. 应用G-CSF动员骨髓干细胞治疗急性心肌梗塞的研究. 中国分子心脏病学杂志. 2003;3:223-225. |
| 11. | Fukuhara S, Tomita S, Nakatani T, Ohtsu Y, Ishida M, Yutani C, Kitamura S. G-CSF promotes bone marrow cells to migrate into infarcted mice heart, and differentiate into cardiomyocytes. Cell Transplant. 2004;13:741-748. [PubMed] |
| 12. | Fukuhara S, Tomita S, Nakatani T, Yutani C, Kitamura S. Endogenous bone-marrow-derived stem cells contribute only a small proportion of regenerated myocardium in the acute infarction model. J Heart Lung Transplant. 2005;24:67-72. [PubMed] |
| 13. | Shyu WC, Lin SZ, Yang HI, Tzeng YS, Pang CY, Yen PS, Li H. Functional recovery of stroke rats induced by granulocyte colony-stimulating factor-stimulated stem cells. Circulation. 2004;110:1847-1854. [PubMed] |
| 14. | Park HK, Chu K, Lee ST, Jung KH, Kim EH, Lee KB, Song YM, Jeong SW, Kim M, Roh JK. Granulocyte colony-stimulating factor induces sensorimotor recovery in intracerebral hemorrhage. Brain Res. 2005;1041:125-131. [PubMed] |
| 16. | Kuethe F, Figulla HR, Herzau M, Voth M, Fritzenwanger M, Opfermann T, Pachmann K, Krack A, Sayer HG, Gottschild D. Treatment with granulocyte colony-stimulating factor for mobilization of bone marrow cells in patients with acute myocardial infarction. Am Heart J. 2005;150:115. [PubMed] |
| 17. | Liatsos GD, Mykoniatis MG, Margeli A, Liakos AA, Theocharis SE. Effect of acute ethanol exposure on hepatic stimulator substance (HSS) levels during liver regeneration: protective function of HSS. Dig Dis Sci. 2003;48:1929-1938. [PubMed] |
| 18. | Szumilas P, Barcew K, Baskiewicz-Masiuk M, Wiszniewska B, Ratajczak MZ, Machalinski B. Effect of stem cell mobilization with cyclophosphamide plus granulocyte colony-stimulating factor on morphology of haematopoietic organs in mice. Cell Prolif. 2005;38:47-61. [PubMed] |
| 19. | Yannaki E, Athanasiou E, Xagorari A, Constantinou V, Batsis I, Kaloyannidis P, Proya E, Anagnostopoulos A, Fassas A. G-CSF-primed hematopoietic stem cells or G-CSF per se accelerate recovery and improve survival after liver injury, predominantly by promoting endogenous repair programs. Exp Hematol. 2005;33:108-119. [PubMed] |
| 20. | Kocher AA, Schuster MD, Szabolcs MJ, Takuma S, Burkhoff D, Wang J, Homma S, Edwards NM, Itescu S. Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function. Nat Med. 2001;7:430-436. [PubMed] |
| 21. | 赵 东长, 陈 蕊, 余 伟华, 雷 俊霞, 彭 延文, 刘 宁, 张 秀明, 李 树浓, 项 鹏. 骨髓间质干细胞抑制肝星状细胞增殖与活化的肝外研究. 中国病理生理杂志. 2005;21:1139-1142. |
| 22. | Li Y, Chen J, Chen XG, Wang L, Gautam SC, Xu YX, Katakowski M, Zhang LJ, Lu M, Janakiraman N. Human marrow stromal cell therapy for stroke in rat: neurotrophins and functional recovery. Neurology. 2002;59:514-523. [PubMed] |
| 23. | Matsuda-Hashii Y, Takai K, Ohta H, Fujisaki H, Tokimasa S, Osugi Y, Ozono K, Matsumoto K, Nakamura T, Hara J. Hepatocyte growth factor plays roles in the induction and autocrine maintenance of bone marrow stromal cell IL-11, SDF-1 alpha, and stem cell factor. Exp Hematol. 2004;32:955-961. [PubMed] |
| 24. | Huiling X, Inagaki M, Arikura J, Ozaki A, Onodera K, Ogawa K, Kasai S. Hepatocytes derived from peripheral blood stem cells of granulocyte-colony stimulating factor treated F344 rats in analbuminemic rat livers. J Surg Res. 2004;122:75-82. [PubMed] |
| 26. | 朱 英, 刘 平, 龙 爱华, 吴 云林, 肖 家诚. 二甲基亚硝胺所致大鼠肝硬化形成与逆转过程中Thy1.1与OV6阳性染色细胞比较. 世界华人消化杂志. 2005;13:953-957. [DOI] |
| 27. | 刘 峰, 潘 孝本, 陈 国栋, 蒋 栋, 丛 旭, 费 然, 魏 来. 粒细胞集落刺激因子动员自体骨髓干细胞促进大鼠部分肝移植物的肝再生. 中华医学杂志. 2005;85:3342-3345. |
| 28. | Fang B, Shi M, Liao L, Yang S, Liu Y, Zhao RC. Systemic infusion of FLK1(+) mesenchymal stem cells ameliorate carbon tetrachloride-induced liver fibrosis in mice. Transplantation. 2004;78:83-88. [PubMed] |
| 30. | Wu LM, Li LD, Liu H, Ning KY, Li YK. Effects of Guiyuanfang and autologous transplantation of bone marrow stem cells on rats with liver fibrosis. World J Gastroenterol. 2005;11:1155-1160. [PubMed] |
| 31. | Li Y, Takemura G, Okada H, Miyata S, Esaki M, Maruyama R, Kanamori H, Li L, Ogino A, Misao Y. Treatment with granulocyte colony-stimulating factor ameliorates chronic heart failure. Lab Invest. 2006;86:32-44. [PubMed] |