修回日期: 2007-10-24
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 研究黄芩甙对人肝癌BEL-7402细胞系黏附、细胞凋亡及细胞周期的影响, 探讨三者之间的关系.
方法: 应用细胞培养技术培养BEL-7402细胞, 不同浓度黄芩甙处理肝癌细胞, 通过Boyden小室模型测定其黏附力, 同时观察细胞形态, 流式细胞术测定肝癌细胞integrinβ1、E-cd表达的改变及细胞凋亡率.
结果: 5, 10, 20 mg/L黄芩甙处理组细胞黏附力与对照组相比均有显著降低(52.38±3.83, 35.63±2.32, 26.58±1.13 vs 84.32±6.74, P<0.05). 对照组表现出纤维母细胞样形态, 伸出形态各异的伪足. 而黄芩甙组细胞形态较圆, 伪足数目相对较少, 电镜下显示细胞微绒毛明显减少, 甚至消失. 5, 10, 20 mg/L黄芩甙组细胞integrinβ1表达较对照组降低(354.07±18.17, 319.44±15.21, 291.49±12.88 vs 407.54±20.58; P<0.05), E-cd的表达则增加(335.5±20.18, 376.4±22.36, 393.8±25.68 vs 251.72±12.34, P<0.05). 黄芩甙作用后, 随黄芩甙浓度增加肝癌细胞G0/G1期比例逐步增高, S期细胞减少, 同时细胞凋亡率增加.
结论: 黄芩甙对肝癌BEL-7402细胞发挥抗黏附作用, 其机制可能与抑制黏附分子E-cd的表达, 促进integrinβ1表达有关. 在抗黏附的同时细胞周期发生改变, 细胞凋亡增多.
引文著录: 郭昱, 郭霞, 姚金锋, 崔东来, 姚树坤. 黄芩甙对肝癌细胞BEL-7402抗黏附作用中细胞凋亡和细胞周期的改变. 世界华人消化杂志 2007; 15(32): 3390-3394
Revised: October 24, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To investigate the effect of baicalin on adhesion, apoptosis and cell cycle of hepatocellular carcinoma (HCC) cell line BEL-7402, and to discuss the relationship between them.
METHODS: HCC cell line BEL-7402 adhesion assay was conducted in a Boyden chamber. Expression of integrin β1 and E-cd proteins of cell line BEL-7402 was determined by flow cytometry (FCM). The effects of baicalin on cell cycle and apoptosis were also observed by FCM. Changes in morphology and ultrastructure were observed by inverted microscopy and electron microscopy.
RESULTS: The adhesion capacity was 52.38 ± 3.83, 35.63 ± 2.32 and 26.58 ± 1.13 at 5, 10 and 20 mg/L baicalin, respectively, and was lower than that in the control group (84.32 ± 6.74; P < 0.05). In the treated group, the HCC cells became smaller and remained round with relatively fewer pseudopods, and microvilli were fewer and shorter. After treatment with 5, 10 and 20 mg/L baicalin, expression of integrin β1 was decreased (354.07 ± 18.17, 319.44 ± 15.21 and 291.49 ± 12.88 vs 407.54 ± 20.58; P < 0.05), and expression of E-cd was increased significantly (335.5 ± 20.18, 376.4 ± 22.36 and 393.8 ± 25.68 vs 251.72 ± 12.34, P < 0.05). G0/G1 phase cells were significantly increased as baicalin concentration increased, and S phase cells were decreased. Baicalin induced BEL-7402 cell apoptosis, in a concentration-dependent manner.
CONCLUSION: Baicalin inhibits cell adhesion, accompanied by increased apoptosis and major changes in the cell cycle of HCC cell line BEL-7402.
- Citation: Guo Y, Guo X, Yao JF, Cui DL, Yao SK. Effect of baicalin on adhesion, apoptosis and cell cycle of hepatocellular carcinoma cell line BEL-7402. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3390-3394
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3390.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3390
肿瘤细胞的侵袭与转移是恶性肿瘤的基本特征, 肿瘤的侵袭转移是涉及多步骤、多环节的极复杂过程. Liotta et al从分子水平将这一过程分为黏附、降解、运动三步. 恶性肿瘤细胞在侵袭和转移过程中, 与宿主组织成分发生多次黏附, 抗黏附治疗与其他包括化疗在内的治疗联合应用, 不但可以产生协同作用, 降低用药剂量, 而且可以在多个环节上阻断肿瘤的侵袭和转移, 弥补彼此之间的不足.
黄芩甙是从唇形科植物黄芩中提取、分离出来的一种黄酮类化合物, 是黄芩的主要有效成分之一, 具有解热、降压、利胆、保肝、镇静、抗菌等药理作用. 近年来随着国际上对黄芩甙研究的持续升温以及认识的逐步深入, 发现黄芩甙具有抗肿瘤作用, 表现为抑制癌细胞增殖, 促进癌细胞凋亡[1-2]. 我们在体外观察了黄芩甙对肝癌细胞BEL-7402黏附、细胞凋亡及细胞周期的影响, 探讨三者之间的关系.
人肝癌BEL-7402细胞株由河北医科大学细胞室冻存, 黄芩甙购自四川世坤植化有限公司, Matrigel基质为美国Becton Dickinson公司产品, Boyden小室为Coster公司产品, 兔多抗和羊抗鼠FITC-IgG为北京中山生物技术有限公司产品, 上皮钙黏附素(E-cd)单抗和抗β1-整合素(integrinβ1)为Santa公司产品.
1.2.1 细胞培养及分组: 人肝癌BEL-7402细胞株常规培养于含10 g/L小牛血清、100 U/L青霉素、100 μg/L链霉素的RPMI 1640培养液中, 在37℃、50 mL/L CO2培养箱内培养. 实验分为4组: 黄芩甙5 mg/L组, 黄芩甙10 mg/L组, 黄芩甙20 mg/L组, 对照组(只加培养基). 药物作用48 h, 收集细胞, 做以下检查. 每组设3个复孔.
1.2.2 黏附测定: 本研究引入Matrigel基质胶, 模拟体外黏附模型中细胞外基质(ECM)的作用, 观察黄芩甙对肝癌细胞黏附力的影响. 96孔培养板覆以Matrigel 100 μg/孔, 胶干后, 加入预处理的细胞悬液50 μL(5×105/孔), 37℃摇床100 r/min, 作用30 min. 每孔加无血清RPMI 1640培养液150 μL及MTT(1 g/L)50 μL, 37℃继续作用4 h. 弃上清, 每孔加入100 μL DMSO原液, 10 min后上酶标仪, 在490 nm单波长下测定A值. 细胞黏附率 = (试验组A值/对照组A值)×100%. 将对照组与处理组细胞置于倒置显微镜下观察. 生长在盖玻片上的细胞, 10 mg/L黄芩甙处理组及空白对照组, 作用48 h, 取出盖玻片, 用PBS洗3遍, 25 g/L戊二醛4℃前固定2 h, 10 g/L锇酸后固定, 系列乙醇脱水, 扫描电镜下观察.
1.2.3 Integrinβ1、E-cd的测定: 取单细胞悬液1×109/L, 加入鼠抗人mAb工作液0.1 mL, 室温孵育30 min, 加入PBS 10 mL洗涤一次. 弃上清, 加入羊抗鼠FITC-IgG二抗工作液100 µL, 避光室温孵育30 min. 加入PBS 10 mL, 500 r/min离心2 min. 弃上清以除去未结合的荧光二抗. 上机检测前加入PBS 0.1 mL经500目铜网过滤后, 采用美国Beckman Coulter公司生产的Epics-XLⅡ流式细胞仪测定integrin and E-cd的含量, 激发光源为15 mW氩离子激光器, 激发波长为488 nm. 应用Expo 32 ADC进行免疫荧光数据分析, 以均道值表示蛋白含量.
1.2.4 细胞周期测定: 将细胞进行同步化处理24 h后, 换含小牛血清的新鲜培养液, 待细胞长至80%融合时, 收获细胞, PBS洗2次, 700 mL/L乙醇固定, 然后用碘化丙啶染色, 流式细胞仪进行检测. 空白对照组和1.25 mg/L、2.5 mg/L、5 mg/L、10 mg/L、20 mg/L、40 mg/L黄芩甙处理组分别作用48 h后, 制备各细胞悬液, PI染色流式细胞计数测定凋亡率.
统计学处理 全部数据用SPSS10.0软件包进行统计处理. 计量资料用mean±SD表示. 各组及组间比较用t检验.
黄芩甙组肝癌细胞黏附力明显下降, 黄芩甙显示出显著的抗黏附作用, 该作用呈剂量效应关系. 黄芩甙组细胞integrinβ1表达较对照组降低, E-cd的表达则增加. 黄芩甙5 mg/L组即呈现上述显著变化(P<0.05), 10 mg/L组、20 mg/L组与5 mg/L黄芩甙组相比integrinβ1、E-cd的表达呈量效关系(表1).
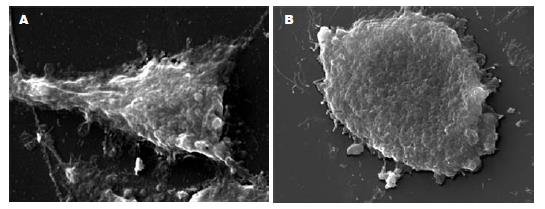
倒置显微镜下见, 对照组细胞表现出纤维母细胞样形态, 伸出形态各异的伪足; 而黄芩甙组细胞形态较圆, 伪足数目相对较少. 扫描电镜下见对照组细胞形态不规则, 有多个细长的突起, 微绒毛较多, 体积较大; 黄芩甙处理组细胞变小, 突起减少, 形态变圆, 微绒毛减少甚至消失, 有的细胞表面有凹陷, 胞质可见有穿孔或空洞, 可见凋亡小体(图1).
黄芩甙作用后, 随黄芩甙浓度的增加肝癌细胞G1/G0期比例逐步降低, S期细胞减少, 说明黄芩甙将肝癌细胞阻滞在G1期(表2). 1.25 mg/L、2.5 mg/L、5 mg/L、10 mg/L、20 mg/L、40 mg/L黄芩甙分别作用肝癌细胞48 h后, 凋亡百分率分别为2.32%±0.72%, 2.42%±0.68%, 9.86%±1.98%, 17.59%±3.26%, 17.59%±3.26%, 17.59%±3.26%, 17.59%±3.26%, 22.27%±3.89%, 24.34%±3.79%, 与对照组(2.18%±0.66%)相比有显著性意义(P<0.01), 呈量效关系.
| 黄芩甙(mg/L) | G0/G1 | S | G2/M |
| 0 | 57.4 | 29.8 | 12.8 |
| 2.5 | 58.6 | 28.1 | 13.3 |
| 5 | 63.3 | 21.2 | 15.5 |
| 10 | 67.4 | 18.7 | 13.9 |
| 20 | 69.7 | 16.5 | 13.8 |
肿瘤转移是肿瘤治疗的主要障碍, 控制转移是决定肿瘤患者预后的关键因素. 研究发现肿瘤细胞的高转移性与其高黏附特性有关, 抗黏附治疗可阻断肿瘤转移. 恶性肿瘤细胞在侵袭和转移过程中, 与宿主组织成分发生多次黏附. 新近资料表明, 这一现象与细胞黏附分子的作用有密切关系[3]. 其中引人注目的是钙黏附素、整合素家族成员[4]. 钙黏附素主要介导正常和肿瘤组织中细胞与细胞间的黏附. E-cd属钙黏附素超家族经典Ⅱ族成员, 依赖细胞外Ca2+介导同种亲和性的细胞与细胞间的黏附, 在相邻细胞间形成钙黏附拉链, 参与建立和维持细胞间连接, 在同种细胞间起相互联系、相互制约的作用. 他的表达程度及功能活性直接影响细胞的脱离和再附着. 多数学者认为, 如果E-cd介导的黏附功能受损或表达减少, 肿瘤细胞连接松散, 易脱落. 许多癌组织中均出现E-cd的表达缺失或基因突变[5]. 某些恶性肿瘤导入E-cd基因后, 能明显降低肿瘤细胞侵袭和转移的能力. Kuefer et al[6]首先报道了在进展期和伴有转移的前列腺癌患者血清中E-cd明显升高, 其可作为预测肿瘤进展和转移的指标. integrinβ1是由α、β亚单位通过二硫键形成的二聚体跨膜蛋白, 可以同时与细胞基质成分及细胞骨架结合而形成配体-integrinβ1-细胞骨架跨膜信息系统, 介导肿瘤细胞的黏附和转移. Fujita et al研究了包括肝癌在内的27种癌细胞系, 结果表明全部细胞均不同程度的表达integrinβ1. Strobel et al[7]的实验研究表明, 阻断卵巢癌integrinβ1可以有效抑制肿瘤的腹膜播散. 褚忠华 et al[8]研究表明, 肝癌多种黏附分子基因mRNA表达量与肿瘤大小、有无转移, 结节数目有关. E-cd与肿瘤大小、有无转移, 结节数目呈负相关, integrinβ1与之呈正相关. 我们的研究结果表明, 黄芩甙作用后光学显微镜下肝癌细胞形态发生明显改变, 细胞变小、变圆, 突起明显减少. 进一步电镜观察, 对照组细胞表面微绒毛密集、细长, 为转移和附着于其他组织提供方便. 黄芩甙组微绒毛稀疏, 甚至消失. 经检测黄芩甙组细胞黏附力也明显降低, 表明黄芩甙具有抗肝癌细胞黏附的作用. 同时发现黄芩甙处理组E-cd表达增多, integrinβ1表达下降, 认为黄芩甙通过促进E-cd表达, 抑制integrinβ1表达而使癌细胞间连接紧密, 从而避免癌细胞从原发灶处的脱落、游离, 达到抑制肿瘤侵袭、转移的作用.
细胞周期是细胞生命活动的基本过程. 细胞的增殖、凋亡、分化均是细胞周期依赖性的. 细胞周期的调控是一个复杂的生物学过程, 许多癌基因、抑癌基因直接参与细胞周期的调控, 或者本身就是细胞周期调控复合体的主要成分[9-10]. 这些基因变异的结果, 导致细胞周期的失控, 失去控制的细胞无限制增殖, 形成的克隆群体便是肿瘤. 因此, 有学者认为肿瘤是一类细胞周期疾病. 调节细胞周期为策略将是今后抗肿瘤治疗的新途径之一[11-12]. 细胞周期的长短主要决定于G1期, G1期阻滞可使细胞增殖周期延长. S期可反映细胞的增殖情况, S期占细胞周期比例高, 则提示DNA合成活跃. 一般而言, 肿瘤细胞的S期比例较正常细胞要高, 其增殖活性也较正常细胞高. 目前的研究表明, 肿瘤细胞的黏附作用增强, 可诱导产生一些蛋白质, 如p21Cip1/Wafl, 血管内皮生长因子等, 并通过某些信号转导机制来调控细胞周期蛋白的表达, 进而影响细胞周期. 有研究证明, EMT-6细胞转染黏附分子后, 细胞间黏附作用加强, 同时伴有P27的高表达, 细胞大量滞留于G1期. 我们用PI标记流式细胞仪分析黄芩甙作用后肝癌细胞BEL-7402细胞周期的变化, 结果发现随着黄芩甙药物浓度的增加, 细胞黏附力降低, 细胞周期中G0/G1期的比例逐渐增加, S期比例逐渐减少. 与上述结果不一致, 可能与细胞系不同有关. Chang et al[13]研究发现, 黄芩甙影响肝癌细胞周期, 而且细胞系结果不一致. 黄芩甙作用于HepG2细胞, G2/M期显著增多, 作用于Hep3B细胞G1期细胞增多. 本研究与Yano et al研究结果一致[14], 表明黄芩甙主要作用于G1/S节点, 使细胞停滞于G1期, S期细胞减少, 反映细胞增殖活性降低, 趋于分化成熟.
在抗肿瘤治疗过程中, 化疗药物除直接杀伤肿瘤细胞外, 更主要的作用是诱导肿瘤细胞进入凋亡程序. 在许多哺乳动物细胞系统中, 细胞之间可通过传递一种"生存信号"来避免进入凋亡程序. 许多研究表明, 这种"生存信号"可通过细胞-细胞和细胞-基质之间的黏附作用进行传递. 肿瘤细胞相互间也通过上述黏附作用传递"生存信号", 以避免发生凋亡, 对抗化疗药物的致凋亡作用. 研究发现, 运用mAb阻断E-cd介导的细胞-细胞间黏附作用后, 可促进细胞凋亡. 当细胞与细胞外基质失去正常的黏附作用后, 细胞发生凋亡, 这种现象被称为 "anoikis". 本研究结果显示, 黄芩甙在发挥抗黏附作用的同时, 肝癌细胞凋亡增多, 证实了上述观点.
黄芩甙是黄芩的主要有效成分之一, 近年来发现其具有抗肿瘤作用, 表现为抑制肿瘤细胞增殖, 对其抗肿瘤机制尚不甚清楚. 本研究旨在观察黄芩甙对肝癌细胞黏附、细胞凋亡及细胞周期的影响, 探讨三者之间的关系.
肿瘤细胞的侵袭与转移是恶性肿瘤的基本特征. 恶性肿瘤细胞在侵袭和转移过程中, 与宿主组织成分发生多次黏附, 抗黏附治疗与其他包括化疗在内的治疗联合应用, 不但可以产生协同作用, 降低用药剂量, 而且可以在多个环节上阻断肿瘤的侵袭和转移, 弥补彼此之间的不足.
多数学者认为, 如果E-cd介导的黏附功能受损或表达减少, 肿瘤细胞连接松散, 易脱落, 许多癌组织中均出现E-cd的表达缺失或基因突变. 某些恶性肿瘤导入E-cd基因后, 能明显降低肿瘤细胞侵袭和转移的能力. Kuefer et al首先报道了在进展期和伴有转移的前列腺癌患者血清中E-cd明显升高, 其可作为预测肿瘤进展和转移的指标. Strobel et al的实验研究表明阻断卵巢癌integrinβ1可以有效抑制肿瘤的腹膜播散.
本文从黏附角度探讨黄芩甙对肝癌细胞的作用, 视角较新颖. 引入Matrigel基质胶, 模拟体外黏附模型中细胞外基质的作用, 方法较先进.
本文结果有助于对黄芩甙作用机制的深入、广泛认识, 对黄芩甙的进一步开发应用提供了实验基础.
本文设计合理, 统计学处理恰当, 结论明确, 论证有据, 条理分明, 对基础研究有一定的参考意义.
编辑: 程剑侠 电编:何基才
| 1. | Dong Y, Yang MM, Kwan CY. In vitro inhibition of proliferation of HL-60 cells by tetrandrine and coriolus versicolor peptide derived from Chinese medicinal herbs. Life Sci. 1997;60:PL135-PL140. [PubMed] |
| 2. | Matsuzaki Y, Kurokawa N, Terai S, Matsumura Y, Kobayashi N, Okita K. Cell death induced by baicalein in human hepatocellular carcinoma cell lines. Jpn J Cancer Res. 1996;87:170-177. [PubMed] |
| 3. | Hazan RB, Qiao R, Keren R, Badano I, Suyama K. Cadherin switch in tumor progression. Ann N Y Acad Sci. 2004;1014:155-163. [PubMed] |
| 4. | Sun JJ, Zhou XD, Liu YK, Tang ZY, Feng JX, Zhou G, Xue Q, Chen J. Invasion and metastasis of liver cancer: expression of intercellular adhesion molecule 1. J Cancer Res Clin Oncol. 1999;125:28-34. [PubMed] |
| 5. | Garcia S, Martini F, De Micco C, Andrac L, Sappa P, Hardwigsen J, Lavaut MN, Le Treut YP, Charpin C. Prognostic value of E-cadherin expression in hepatocellular carcinoma. Ann Pathol. 1998;18:98-102. [PubMed] |
| 6. | Kuefer R, Hofer MD, Gschwend JE, Pienta KJ, Sanda MG, Chinnaiyan AM, Rubin MA, Day ML. The role of an 80 kDa fragment of E-cadherin in the metastatic progression of prostate cancer. Clin Cancer Res. 2003;9:6447-6452. [PubMed] |
| 7. | Strobel T, Cannistra SA. Beta1-integrins partly mediate binding of ovarian cancer cells to peritoneal mesothelium in vitro. Gynecol Oncol. 1999;73:362-367. [PubMed] |
| 9. | Gakiopoulou H, Korkolopoulou P, Levidou G, Thymara I, Saetta A, Piperi C, Givalos N, Vassilopoulos I, Ventouri K, Tsenga A. Minichromosome maintenance proteins 2 and 5 in non-benign epithelial ovarian tumours: relationship with cell cycle regulators and prognostic implications. Br J Cancer. 2007;97:1124-1134. [PubMed] |
| 12. | Liu W, Kato M, Akhand AA, Hayakawa A, Takemura M, Yoshida S, Suzuki H, Nakashima I. The herbal medicine sho-saiko-to inhibits the growth of malignant melanoma cells by upregulating Fas-mediated apoptosis and arresting cell cycle through downregulation of cyclin dependent kinases. Int J Oncol. 1998;12:1321-1326. [PubMed] |
| 13. | Chang WH, Chen CH, Lu FJ. Different effects of baicalein, baicalin and wogonin on mitochondrial function, glutathione content and cell cycle progression in human hepatoma cell lines. Planta Med. 2002;68:128-132. [PubMed] |
| 14. | Yano H, Mizoguchi A, Fukuda K, Haramaki M, Ogasawara S, Momosaki S, Kojiro M. The herbal medicine sho-saiko-to inhibits proliferation of cancer cell lines by inducing apoptosis and arrest at the G0/G1 phase. Cancer Res. 1994;54:448-454. [PubMed] |