修回日期: 2007-10-29
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 以cyclinE基因编码区为靶位, 构建表达小干扰RNA(siRNA)的质粒载体, 观察转染后对HepG2细胞的影响.
方法: 针对cyclinE基因序列构建表达siRNA的真核表达载体pSilencer3.1-H1hygro, 利用脂质体Metafectene转染cyclinE基因高表达的肝癌细胞株HepG2. 流式细胞仪检测细胞周期及凋亡率, MTT法检测细胞增殖活性, RT-PCR和Western blot法观察转染后细胞cyclinE基因表达.
结果: 成功构建了表达siRNA的真核质粒载体, 转染后cyclinE基因mRNA及蛋白表达水平分别下降了79%和65%.
结论: 靶向cyclinE基因的siRNA可有效沉默HepG2细胞高表达的cyclinE基因, 从而抑制肝癌细胞的增殖并促进凋亡.
引文著录: 田雪飞, 黄燕, 朱才, 肖竺, 郭永良. 靶向cyclinE小干扰RNA对肝癌HepG2细胞增殖和凋亡的影响. 世界华人消化杂志 2007; 15(32): 3385-3389
Revised: October 29, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To design pSilencer3.1-H1hygro plasmid expressing small interfering RNA (siRNA) that targets the coding region of cyclinE, and to evaluate the inhibitory effect of this siRNA on HepG2 cells after transfection.
METHODS: pSilencer3.1-H1hygro vector of the siRNA based on the coding region of cyclinE was constructed. The plasmid and liposome metafectene were cotransfected into HepG2 cells, which overexpressed cyclinE. Cell proliferation and apoptosis were assessed by MTT assay and flow cytometry, respectively, and expression of cyclinE was detected by RT-PCR and Western blotting.
RESULTS: The plasmid expressing siRNA targeted on the coding region of cyclinE was successfully constructed. Expression of cyclinE mRNA and protein was suppressed by up to 79% and 65%, respectively.
CONCLUSION: siRNA targeted on cyclinE can silence cyclinE overexpression, and subsequently suppress proliferation and promote apoptosis of HepG2 cells.
- Citation: Tian XF, Huang Y, Zhu C, Xiao Z, Guo YL. Effects of small RNA interference to target cyclinE gene on apoptosis and proliferation of HepG2 hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3385-3389
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3385.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3385
细胞周期蛋白E(cyclinE)基因表达的cyclinE蛋白可与细胞周期依赖性激酶2(cyclin dependent kinase 2, CDK2)结合形成cyclinE-CDK2复合物, 在G1晚期调控细胞从G1期进入S期[1]. cyclinE的表达随细胞周期波动出现精确的周期性合成与降解, 从而保持基因复制的稳定性[2]. cyclinE的过表达使细胞过多从G1期进入S期, 导致细胞恶性增殖. Reynolds et al报道肝细胞癌组织中cyclinE呈过表达现象[3], 并与晚期肝癌患者总生存率及病情的恶化预后相关[4]. 我们利用RNA干扰(RNA interference, RNAi)技术, 设计了靶向cyclinE的短片段双链RNA(small interfering RNA, siRNA)表达质粒载体, 并观察转染后对cyclinE高表达的肝癌细胞株HepG2的影响.
人肝癌细胞株HepG2由本研究室引进并保存, 含H1启动子的转录载体pSlilencer3.1-H1hygro质粒购自Ambion公司, 真核绿色荧光蛋白表达载体pEGFP质粒由中南大学湘雅医院朱才博士馈赠, 转化受体菌为E.coli DH5α菌株. 脂质体转染试剂Metafectene为德国Biontex公司产品, 大量质粒提取试剂盒为德国Qiagen公司产品, TRIzol RNA提取试剂为美国Gibco公司产品, 小量质粒提取试剂盒、RT-PCR相关试剂及引物合成为大连宝生物工程有限公司产品, 鼠抗人cyclinE mAb及羊抗人actin mAb为美国Santa Cruz公司产品, 蛋白质分子量标准、化学增强发光试剂盒、辣根过氧化物酶标记的抗鼠二抗为美国Cell Signaling Technology公司产品.
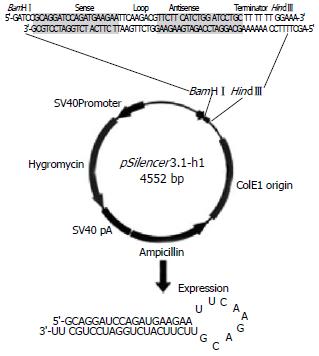
1.2.1 靶位的选择及siRNA的设计及表达载体的构建: siRNA设计原则参照文献[5]. siRNA干扰作用靶点对应于人cyclinE基因编码区71-90 nt(GenBank序列号No. XM_049430). 靶位序列为GCAGGATCCAGATGAAGAA, 经Blast分析, 未发现同源序列. siRNA表达载体插入序列: 上游限制位点为BamHⅠ, 下游限制位点为HindⅢ, Loop序列为TTCAAGACG. 人工合成各单链DNA片段, 退火形成发夹状siRNA DNA双链, 插入到pSilencer3.1-H1hygro的BamHⅠ和HindⅢ之间. 重组体转化大肠杆菌DH5α, 筛选hygro抗性克隆, 提取质粒并测序鉴定. 另外合成非同源无义序列作为无义siRNA对照组. siRNA真核表达载体的构建及鉴定由武汉晶赛公司完成(图1).
1.2.2 质粒转染: 待细胞生长融合达60%-80%后, 表达siRNA的pSilencer3.1-H1 hygro质粒与脂质体Metafectence共转染, 混合比例为1:4(质量/体积), 转染步骤按说明书进行. 转染后6 h, 换为含100 mL/L小牛血清(FBS)的DMEM培养基. 建立两个试验对照组, 即无义siRNA组和空白质粒组. Metafectence的转染效果评价: 含绿色荧光蛋白的表达质粒pEGFP转染HepG2细胞, 转染后培养72 h, 用磷酸盐缓冲液(PBS)洗涤细胞, 荧光显微镜观察细胞, 随机选取10个视野, 荧光细胞数与总细胞数之比为转染效率.
1.2.3 流式细胞仪检测细胞周期及凋亡: 转染后培养72 h, 胰酶消化细胞, 1000 r/min离心5 min, 弃上清, 750 mL/L乙醇4℃固定24 h. 调整细胞浓度为109 /L, 取1 mL细胞悬液, PBS洗2次, 加入PBS染色液(PI 50 mg/L, RNase 100 mg/L), 4℃避光染色30 min, 上机检测.
1.2.4 细胞生长、增殖抑制试验: 向24孔板中分别接种细胞数约为1×104的HepG2细胞, 置50 mL/L CO2中培养, 分别于24 h, 48 h, 72 h检测每组(每组5个孔)每个孔的细胞总数, 取5个孔的平均值, 根据上述数据绘制细胞生长曲线图. 取对数生长期转染后HepG2细胞接种96孔板, 每孔接种5×103个细胞, 分别于培养24 h, 48 h, 72 h后每孔加入5 g/L MTT 10 μL, 37℃条件下继续培养4 h, 弃上清, 每孔加入二甲基亚砜(DMSO)100 μL, 酶标仪波长490 nm处检测吸光度A值, 试验重复3次. 按下列公式计算细胞抑制率: 细胞生长抑制率 = (对照孔A值-试验孔A值)/对照孔A值×100%.
1.2.5 cyclinE: mRNA及蛋白表达检测: 转染后培养72 h, 收集细胞. 总RNA提取按TRIzol试剂盒说明进行, 紫外分光光度计测定总RNA浓度与纯度, -70℃保存备用. 逆转录取2 µL总RNA, 10 mmol/L Oligo dT 1 µL, 用DEPC水补至总体积12 µL后70℃ 5 min, 冰上骤冷后加入5×Buffer 4 µL, 20 mU/L RNA酶抑制剂1 µL, 10 mmol/L dNTP 2 µL, 200 mU/L M-MLV 1 µL, 37℃反应60 min, 94℃灭活5 min. PCR序列根据GenBank中人cyclinE、β-actin cDNA序列进行设计(表1). 细胞总蛋白提取: 1×106个细胞用PBS洗涤3-4次后, 加入细胞裂解液(50 mmol/L Tris-HCl, 1 mmol/L EDTA, 2% SDS, 5 mmol/L DTT, 10 mmol/L PMSF)200 µL, 冰上放置30 min裂解, 最大功率脉冲超声粉碎30 s, 13 000 r/min离心30 min去除细胞碎片, 留含总蛋白的上清液, Bradford法测定蛋白浓度, Western blot检测cyclinE的表达. PCR及Western blot条带应用Eagle Eye Ⅱ图像分析处理系统分析结果.
| 基因 | 引物序列 | PCR反应条件 | 目的片段大小 |
| cyclinE | CGTTGCTTCACTTCTCCT GAAGGGCTTCAACTGTTCC | 94℃ 1 min, 55℃ 45 s, 72℃ 45 s 35 cycles | 369 bp |
| β-actin | CAAAGACCTGTACGCCAACA GAAGCATTTGCGGTGGAC | 255 bp |
统计学处理 实验数据用mean±SD表示, 采用单因素方差分析处理, 组间两两比较采用SNK-q检验. 全部数据经SPSS10.0统计软件处理, P<0.05表示差异有显著性.
空白质粒与无义siRNA两组间各期细胞所占比例均无统计学差异(P>0.05). cyclinE siRNA组中S期、G2-M期细胞所占比例与空白质粒及无义siRNA两组比较明显下降, 统计学差异显著(P<0.01). 凋亡细胞(Sub-G1期)所占比例明显高于空白质粒及无义siRNA两组, 差异有统计学意义(P<0.01, 表2).
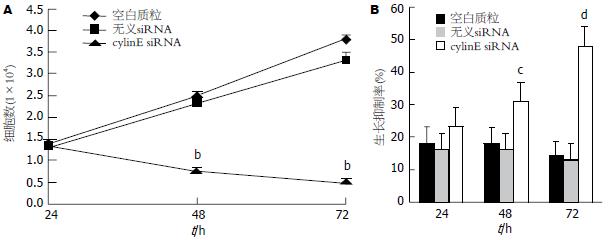
与空白质粒及无义siRNA组比较, cyclinE siRNA转染后48 h、72 h, HepG2细胞数显著减少(P<0.01)(图2A). 从MTT法检测的生长抑制率结果也可以看出, 转染后24 h三组间差异无统计学意义, 转染后48 h, cyclinE siRNA组生长抑制率开始增加, 转染后72 h则显著高于空白质粒及无义siRNA组(P<0.01)(图2B). 空白质粒与无义siRNA转染对HepG2细胞均无明显生长抑制作用, 两组间差异无统计学意义(P>0.05).
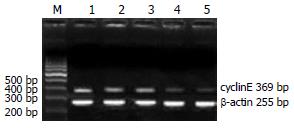
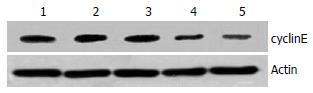
HepG2细胞转染表达cyclinE siRNA的质粒后72 h, 与空白质粒及无义siRNA组比较, RT-PCR检测结果显示HepG2细胞中cyclinE mRNA表达水平显著降低(P<0.01), 下降了79%(图3, 表3), Western blot检测结果也显示CyclinE蛋白表达含量明显减少(P<0.01), 比空白质粒组相比, 下降了65%以上(图4, 表3). 而siRNA对cyclinE表达无抑制作用.
肝细胞癌(hepatocellular carcinoma, HCC)是临床常见的恶性肿瘤之一.
癌基因的高表达是HCC患者病情进展的重要原因[6], 因此, 如何将正常或治疗基因导入靶细胞纠正缺陷基因的表达, 已成为HCC基因治疗的探索热点. 但肝癌基因治疗面临的难题之一是目的基因在肝癌组织中表达的特异性不高, 靶向性不强, 有的基因产物可引起全身严重的毒副作用[7]. 相对于基因敲除技术长期抑制基因功能, RNAi使基因表达暂时降低或抑制, 基因组的信息仍保持完整. 已有研究证明siRNA能抑制多种癌基因表达, 因此可设计针对特定癌基因的siRNA阻止肝癌的形成与进展, 如靶向原癌基因Bcl-2[8], p28GANK[9], surviving[10], 以及新一类癌基因, 凋亡调控基因Mcl-1[11]等. RNAi技术的应用为肝癌基因治疗提供了广阔的临床应用前景.
cyclinE定位于人19q12-13, 含有一个与CDKs相互作用的细胞周期素盒. 通常cyclinE在G1期合成, S期至峰值后逐渐消失, G2-M期不表达, 而在肝癌细胞HepG2中可在整个细胞周期表达. cyclinE可与CDK2结合形成复合物, 促进细胞G1-S期进程, 使细胞进入S期后就不再依赖于细胞外促生长因子而顺序完成整个细胞周期[2]. 虽然Li et al[12]采用化学合成siRNA瞬时转染cyclinE高表达的肝癌细胞株, 也获得了明显的基因沉默效果, 但采用siRNA表达框架构建siRNA表达载体更有利于进行稳定表达siRNA和长效抑制的研究. 从转染到细胞的DNA模板中在体内转录得到siRNAs, 从而不需要直接进行RNA的操作, 故能提高siRNA的稳定性[13], 并可使siRNA的体内实验维持较长时间的基因沉默[14]. 本研究设计靶向cyclinE编码区基因的siRNA, 构建了cyclinE siRNA的真核表达质粒, 可高特异性地下调癌基因表达, 使转染后HepG2细胞cyclinE mRNA及蛋白表达水平分别下降79%和65%. 对细胞增殖活性的进一步检测显示, cyclinE基因沉默使细胞生长抑制率明显增高, 促进细胞凋亡, 细胞S期, G2-M期比例减少, 使细胞周期阻滞于G0-G1期. 空白对照和无义siRNA均无抑制作用, 表明siRNA作用具有序列特异性. 结果表明, cyclinE基因高表达具有促进肝癌细胞增殖恶变的作用, 抑制cyclinE基因可达到抑制肝癌细胞增殖的效果. 此外, 我们曾在靠近编码区末端选择靶位点设计siRNA, 下调cyclinE基因表达的效果并不明显, 推测siRNA的基因沉默效果除了严格遵从编码碱基的选择设计原则外, 可能还与基因编码区域的选择靶点相关.
尽管近年来在HCC的手术治疗及介入治疗等方面取得了长足进步, 但其总体疗效仍不尽人意. 可重新激活抑癌基因的DNA甲基化抑制剂5-氮-2'-脱氧胞苷(5-Aza-CdR), 由于缺乏特异性, 细胞毒性以及可能激活"沉默"的癌基因等原因使临床应用受到限制[15]. 病毒介导的基因治疗方法的靶向特异性与安全性尚待进一步考证. RNAi技术以其高特异性, 高效率等优点, 已成为抗肿瘤研究的热点. 其在肝癌研究中的应用也不断拓展, 如沉默癌基因过表达相关的信号传导通路Wnt/beta-catenin[16], 设计靶向尿激酶型血浆酶原激活物(u-PA)、骨桥蛋白(Osteopontin)等的siRNA降低肝癌细胞的侵袭转移能力[17-18], 钙黏蛋白T(T cadherin)在肝癌中基因功能的探索[19], 甚至对非编码(nc)RNAs的遗传物质进行研究等[20]. 采用RNAi技术特异性地抑制肝癌癌基因, 癌相关基因或突变基因的过度表达, 有望成为临床HCC基因治疗的新手段.
癌基因的高表达是HCC患者病情进展的重要原因. cyclinE基因在肝癌细胞HepG2中整个细胞周期高表达. 目前肝癌基因治疗有基因在肝癌组织中表达的特异性不高, 靶向性不强及毒副作用等不足, RNAi技术以其高特异性, 高效率等优点, 已成为抗肿瘤研究的热点.
本文采用siRNA表达框架构建siRNA表达载体, 以cycleE为靶基因设计短片段双链RNA(siRNA)使之发生基因沉默.
本文采用RNAi技术特异性地抑制肝癌癌基因, 癌相关基因或突变基因的过度表达, 有望成为临床HCC基因治疗的新手段.
本文应用的以cycleE为靶基因设计的siRNA表达框架构建siRNA表达载体转染后可通过抑制肝癌细胞增殖, 促进肝癌细胞的凋亡而发挥抗肿瘤作用.
本文内容新颖, 结构严谨, 分析有据, 有较强的可读性.
编辑: 李军亮 电编:郭海丽
| 2. | Berger C, Pallavi SK, Prasad M, Shashidhara LS, Technau GM. Cyclin E acts under the control of Hox-genes as a cell fate determinant in the developing central nervous system. Cell Cycle. 2005;4:422-425. [PubMed] |
| 3. | Ohashi R, Gao C, Miyazaki M, Hamazaki K, Tsuji T, Inoue Y, Uemura T, Hirai R, Shimizu N, Namba M. Enhanced expression of cyclin E and cyclin A in human hepatocellular carcinomas. Anticancer Res. 2001;21:657-662. [PubMed] |
| 4. | Kohzato N, Dong Y, Sui L, Masaki T, Nagahata S, Nishioka M, Konishi R, Tokuda M. Overexpression of cyclin E and cyclin-dependent kinase 2 is correlated with development of hepatocellular carcinomas. Hepatol Res. 2001;21:27-39. [PubMed] |
| 5. | Reynolds A, Leake D, Boese Q, Scaringe S, Marshall WS, Khvorova A. Rational siRNA design for RNA interference. Nat Biotechnol. 2004;22:326-330. [PubMed] |
| 6. | Cha C, Dematteo RP. Molecular mechanisms in hepatocellular carcinoma development. Best Pract Res Clin Gastroenterol. 2005;19:25-37. [PubMed] |
| 7. | Ekerfelt C, Ernerudh J, Bunikis J, Vrethem M, Aagesen J, Roberg M, Bergstrom S, Forsberg P. Compartmentalization of antigen specific cytokine responses to the central nervous system in CNS borreliosis: secretion of IFN-gamma predominates over IL-4 secretion in response to outer surface proteins of Lyme disease Borrelia spirochetes. J Neuroimmunol. 1997;79:155-162. [PubMed] |
| 8. | Kanda T, Yokosuka O, Imazeki F, Arai M, Saisho H. Enhanced sensitivity of human hepatoma cells to 5-fluorouracil by small interfering RNA targeting Bcl-2. DNA Cell Biol. 2005;24:805-809. [PubMed] |
| 9. | Li H, Fu X, Chen Y, Hong Y, Tan Y, Cao H, Wu M, Wang H. Use of adenovirus-delivered siRNA to target oncoprotein p28GANK in hepatocellular carcinoma. Gastroenterology. 2005;128:2029-2041. [PubMed] |
| 10. | Lu X, Zheng Q, Xiong J. Effect of siRNA targeting survivin gene on the biological behavior of hepatocellular carcinoma. J Huazhong Univ Sci Technolog Med Sci. 2005;25:48-50, 58. [PubMed] |
| 11. | Schulze-Bergkamen H, Fleischer B, Schuchmann M, Weber A, Weinmann A, Krammer PH, Galle PR. Suppression of Mcl-1 via RNA interference sensitizes human hepatocellular carcinoma cells towards apoptosis induction. BMC Cancer. 2006;6:232. [PubMed] |
| 12. | Li K, Lin SY, Brunicardi FC, Seu P. Use of RNA interference to target cyclin E-overexpressing hepatocellular carcinoma. Cancer Res. 2003;63:3593-3597. [PubMed] |
| 13. | Lu PY, Xie F, Woodle MC. In vivo application of RNA interference: from functional genomics to therapeutics. Adv Genet. 2005;54:117-142. [PubMed] |
| 14. | Scherr M, Morgan MA, Eder M. Gene silencing mediated by small interfering RNAs in mammalian cells. Curr Med Chem. 2003;10:245-256. [PubMed] |
| 15. | Egger G, Liang G, Aparicio A, Jones PA. Epigenetics in human disease and prospects for epigenetic therapy. Nature. 2004;429:457-463. [PubMed] |
| 16. | Sangkhathat S, Kusafuka T, Miao J, Yoneda A, Nara K, Yamamoto S, Kaneda Y, Fukuzawa M. In vitro RNA interference against beta-catenin inhibits the proliferation of pediatric hepatic tumors. Int J Oncol. 2006;28:715-722. [PubMed] |
| 17. | Salvi A, Arici B, Alghisi A, Barlati S, De Petro G. RNA interference against urokinase in hepatocellular carcinoma xenografts in nude mice. Tumour Biol. 2007;28:16-26. [PubMed] |
| 19. | Riou P, Saffroy R, Chenailler C, Franc B, Gentile C, Rubinstein E, Resink T, Debuire B, Piatier-Tonneau D, Lemoine A. Expression of T-cadherin in tumor cells influences invasive potential of human hepatocellular carcinoma. FASEB J. 2006;20:2291-2301. [PubMed] |
| 20. | Panzitt K, Tschernatsch MM, Guelly C, Moustafa T, Stradner M, Strohmaier HM, Buck CR, Denk H, Schroeder R, Trauner M. Characterization of HULC, a novel gene with striking up-regulation in hepatocellular carcinoma, as noncoding RNA. Gastroenterology. 2007;132:330-342. [PubMed] |