修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 研究苦参碱对四氯化碳(CCl4)所致的小鼠慢性肝纤维化肝组织诱生型一氧化氮合酶(iNOS)表达的干预及意义.
方法: 将健康昆明小鼠50只, 随机分为4组: CCl4组(A组, n = 15)、CCl4+苦参碱治疗组(B组, n = 15)、生理盐水对照组(C组, n = 10)、苦参碱对照组(D组, n = 10). 各组分别于造模4 wk、8 wk后取材, 常规HE染色法观察比较不同组别小鼠肝组织病理变化, 免疫组化方法检测各组肝组织内iNOS的表达.
结果: A组小鼠4 wk肝组织出现脂肪变, 随CCl4给药时间延长, 肝组织损伤加重, 第8周出现空泡样变及点状坏死, 多见于门管区, 小叶结构紊乱. B组各时间点肝组织结构较A组有明显改善, 肝细胞坏死和脂肪变性程度显著减轻. C组、D组肝小叶结构完整, 肝细胞结构清晰. 免疫组化结果显示, A组、B组各时间点受损肝细胞均有iNOS表达, A组与B组iNOS表达分值相比差异有显著性(2.20±0.12 vs 1.20±0.02, P<0.01; 1.2±0.06 vs 0.60±0.02, P<0.01). C组、D组肝细胞iNOS表达阴性.
结论: iNOS参与CCl4诱导的小鼠肝慢性纤维化损伤. 苦参碱可通过干预受损肝细胞iNOS表达, 有效降低CCl4所致肝脏损伤.
引文著录: 马宁芳, 黄宏森, 张超, 郭晓珍, 李叶莉, 郭晓才. 苦参碱对四氯化碳所致小鼠慢性肝纤维化肝组织一氧化氮合酶表达的干预及意义. 世界华人消化杂志 2007; 15(32): 3367-3371
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To study the effects of matrine on the expression of inducible nitric oxide synthase (iNOS) in carbon tetrachloride (CCl4)-induced liver injury in mice.
METHODS: Fifty mice were randomly divided into four groups: CCl4 group (group A, n = 15), CCl4 + matrine group (group B, n = 15), matrine control group (group C, n = 10), and saline control group (group D, n = 10). Mice in each group were sacrificed at 4 and 8 weeks, and the liver pathology was estimated by hematoxylin and eosin (HE) staining. The expression of iNOS in liver tissues of every group was detected by immunohistochemistry.
RESULTS: The animals in group A at 4 weeks developed slight steatosis and obvious inflammation. Prolonged CCl4 administration enhanced liver damage and pronounced steatosis, as well as spotty necrosis, which were mostly observed in the portal area. There was structural damage to the hepatic lobules in group A at 8 wk. Liver structure obviously improved in group B at all time points. The liver structure in groups C and D was integrated and clear. The score of iNOS-IR hepatocytes in group A was significantly higher than that in group B (2.20 ± 0.12 vs 1.20 ± 0.02, P < 0.01; 1.2 ± 0.06 vs 0.60 ± 0.02, P < 0.01). No iNOS-IR hepatocytes were detected in groups C and D.
CONCLUSION: iNOS is involved in CCl4-induced hepatic fibrosis in mice. Matrine inhibits expression of iNOS in injured hepatocytes and relievs CCl4-induced liver injury.
- Citation: Ma NF, Huang HS, Zhang C, Guo XZ, Li YL, Guo XC. Inhibitory effects of matrine on the expression of inducible nitric oxide synthase during hepatic fibrosis induced by carbon tetrachloride in mice. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3367-3371
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3367
肝纤维化(fibrosis)是多种慢性肝病发展致肝硬化的必经阶段. 现有的研究表明肝纤维化的病理过程是可逆的. 因此在肝脏受损的早期阶段进行合理治疗, 有望逆转肝纤维化进程, 进而缓解乃至治愈肝纤维化, 防止肝硬化的形成[1]. 肝损伤是肝纤维化的启动因素, 各种致病因素如乙肝病毒、乙醇、血吸虫、化学毒物等所致的肝细胞变性、坏死在肝纤维化形成过程中起到较强的刺激和诱导作用, 故寻找合适的治疗靶点以保护肝细胞是抗肝纤维化的关键. 一氧化氮(nitric oxide, NO)为一种多生物活性物质. 机体内NO合成酶(NOS)具有诱生型(iNOS)和结构型(cNOS)两种. 内毒素和某些细胞因子如白细胞介素(IL-1), 肿瘤坏死因子(TNF)、干扰素(IFN)等可诱导iNOS合成分泌大量NO[2]. 临床资料及动物实验结果显示, 血液中高浓度的NO与肝细胞损伤有关[3], 但NO如何介导肝的慢性病变过程, 目前很少报道. 苦参碱(matrine)是苦参及其同属植物苦豆子等的主要有效成分, 临床实验显示其具有良好的保护肝细胞、减轻肝纤维化等作用[4-5]. 现有的研究认为苦参碱作用机制可能与抑制HSC活化, 促进氧自由基清除等有关[6-7]. 我们观察了小鼠肝纤维化形成过程中肝组织iNOS的表达水平及苦参碱对iNOS表达的干预作用, 以进一步理解肝纤维化的病理机制并探讨阻断肝纤维化发展的可能途径. 已知TGF-β1与肝损伤、肝纤维化密切相关[8], 本文以其做为肝损伤参考指标.
清洁级健康成年昆明小鼠50只, 雌雄各半, 体质量25-28 g, 购于中山大学医学院实验动物中心(SCXK粤2004-0011). 苦参碱注射液为广州明兴制药有限公司产品(5 g/L), 四氯化碳(CCl4, 500 mL/瓶)为上海化学试剂一厂产品, 粟米油市售, 兔抗iNOS多克隆抗体、兔抗TGF-β1多克隆抗体为Santa Cruz产品, 兔两步法(非生物素)检测试剂盒(Non-Biotin HRP Detection System)及DAB显色试剂盒为北京中杉金桥生物技术有限公司产品.
将CCl4溶于食用粟米油中, 配成500 mL/L以备用.
1.2.1 造模及分组: 将所有小鼠随机分为4组: CCl4组(A组, n = 15), 苦参碱治疗组(B组, n = 15), 苦参碱对照组(C组, n = 10)及正常对照组(D组, n = 10). 所有小鼠饲养1 wk后, A组及B组小鼠轮替背部皮下及四肢内侧注射500 mL/L的CCl4粟米油混悬液, 首次注射CCl4原液(6 mL/kg体质量), 隔4 d后sc 500 mL/L CCl4-粟米油6 mL/kg体质量, 2次/wk, 共8 wk. C组、D组单纯采用同体积的粟米油sc. 在造模的同时, B组及C组分别加用100 mg/kg体质量苦参碱ip, 1次/d. A组、B组造模过程中分别死亡小鼠5只和2只, C、D两组无小鼠死亡. 4 wk末、8 wk末分别于腹腔麻醉下取小鼠中叶肝组织, 置于40 g/L中性甲醛固定, 常规方法制做肝石蜡切片备用, HE染色, 光学显微镜下观察比较肝组织病理改变.
1.2.2 免疫组化方法: 按试剂盒说明肝组织切片依次经过60℃烤箱熔蜡、二甲苯脱蜡、酒精梯度水化、30 mL/L过氧化氢溶液封闭、枸橼酸缓冲液修复抗原、正常山羊血清封闭等步骤后, 加一抗(兔抗iNOS 1:100或兔抗TGF-β1)4℃冰箱过夜, 次日取出切片PBS冲洗3次, 依次加二抗(山羊抗兔)孵育、PBS冲洗DAB显色, 苏木素复染、脱水, 中性树胶固定封片. 阴性对照用PBS代替一抗. 根据iNOS及TGF-β1阳性细胞反应强度及百分比设定免疫组化反应级别: 0级(阳性细胞数<5%, 着色浅淡), 1级(阳性细胞数5%-20%, 淡棕色), 2级(阳性细胞数20%-50%, 棕黄色), 3级(阳性细胞数>50%, 深棕色). 采用双盲计分法由专业技术人员统计各组切片iNOS及TGF-β1表达均值(每张切片随机选取5个视野).
统计学处理 使用SPSS10软件对数据进行统计学处理, 组间均数比较采用方差分析, 两组间比较采用LSD-t检验, P<0.05表示统计学上差异有显著性.
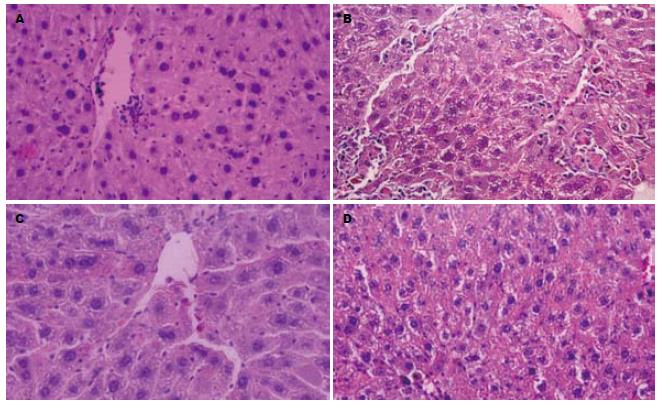
A组4 wk肝组织肉眼未见明显改变, 8 wk肝脏表面有细颗粒感, 质地较硬. HE染色镜下可见4 wk肝组织汇管区及中央静脉周围有炎细胞浸润, 肝细胞出现脂肪变. 8 wk肝组织出现点状或灶状坏死, 多见于界板区, 小叶结构紊乱. 门脉区及坏死区纤维组织增生,有假小叶形成. B组肝脏色泽、大小、质地、表面光滑度较A组有明显改善, 4 wk肝组织结构破坏不明显, 肝细胞坏死和脂肪变性程度显著减轻. 8 wk肝组织中央静脉和汇管区有少量纤维索延伸, 间隔较薄, 无完全间隔形成(图1). C组、D组各时间点肝组织表面光滑, 质脆软. 镜下可见肝小叶结构完整, 中央静脉周围有放射状排列的肝细胞索, 彼此连接成网状. 肝细胞呈多边形, 界限清楚, 胞质丰富, 两组间结构无明显差别.
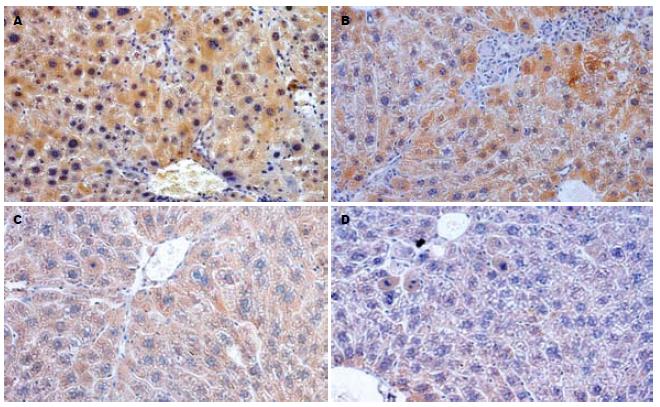
A组各时间点肝实质内均可见iNOS免疫阳性细胞, 4 wk iNOS表达于肝枯否氏细胞及肝细胞胞质内, 呈棕色颗粒状. 8 wk肝脏实质内同样可见iNOS免疫阳性细胞, 界板及坏死肝组织周围肝细胞呈高表达. B组iNOS免疫阳性细胞数量及总体反应强度均低于A组, 与A组各时间点相比差异有显著性(1.20±0.02 vs 2.20±0.12, P<0.01; 0.60±0.02 vs 1.2±0.06, P<0.01; 图2, 表1). C组、D组肝组织内iNOS表达为阴性. TGF-β1免疫组化显示, A组4 wk肝细胞有广泛的TGF-β1表达, 8 wk肝细胞TGF-β1表达减弱. B组各时间点TGF-β1中、轻度表达, 而C组、D组肝细胞TGF-β1表达为弱阳性或阴性(表1).
CCl4诱导肝纤维化是较为成熟的肝毒模型, 在肝硬化动物实验中广泛应用. 研究表明, 各种慢性致肝损伤因素通过诱导肝星状细胞(HSC)的增殖与活化, 使细胞外基质(ECM)合成与降解代谢失衡、肝脏内胶原纤维过度增生和广泛沉积, 形成肝纤维化. 此过程涉及细胞、细胞因子和ECM等多因素间相互作用和调节, 但不论何种原因引起的肝纤维化, 最终都将因ECM的大量沉积使肝组织结构破坏而影响肝脏功能[9]. 在多种器官纤维化的研究中, 转化生长因子-β(TGF-β1)是研究得最多、也是作用最强的致纤维化因子[10-11]. 在哺乳动物中, TGF-β可分为TGF-β1, TGF-β2和TGF-β3 3种亚型[12], 其中TGF-β1的生物学活性最明显. 在生理状态下, TGF-β1主要由淋巴细胞、巨噬细胞和血小板表达分泌, 组织间质细胞也有不同程度的表达, 而实质细胞则不表达, 但在器官慢性炎症或纤维化时, 实质细胞也启动TGF-β1表达[8], 故我们将TGF-β1作为肝损伤的一个观察指标. 由于肝脏的内源性生物素含量较高, 为避免假阳性, 本实验免疫组化采用两步法非生物素检测系统. 结果显示, A组各时间点肝细胞均有较强的表达, 但8 wk肝细胞TGF-β1表达比4wk减弱, 可能与8 wk大量的肝细胞坏死有关. B组TGF-β1中轻度表达, 而C组、D组肝细胞TGF-β1表达为弱阳性或阴性.
国内外学者从化学药物、细胞因子及其受体拮抗剂、基因治疗等方面对抗纤维化药物进行了广泛的探索, 但大多由于副作用及安全性问题而难以在临床广泛应用. 我国的抗肝纤维化研究结果表明, 苦参碱有较好的药理活性和抗纤维化作用[6-7]. 目前认为苦参碱抗肝纤维化的作用与其抑制HSC激活、抑制肝内胶原合成有关, 但确切机制仍不明了. 本文组织学检测结果显示, CCl4组小鼠肝组织出现明显的病理改变, 随CCl4给药时间的延长肝组织损伤程度加重, 出现纤维组织增生和假小叶形成. 而给予苦参碱ip后, B组各时间点肝组织结构较A组有明显改善, 肝损伤程度减轻, 表明苦参碱对CCl4诱导的小鼠肝纤维化有良好的干预作用. NO是一种新型生物信使分子, 由NOS催化L-精氨酸生成. 肝脏有两种NOS类型, 原生型(cNOS)和诱生型(iNOS). 前者由内皮细胞产生, 合成NO的生物效应以生理状态下细胞间信息传递为主. 后者由肝脏多种细胞在内毒素及某些细胞因子诱导下产生, 合成大量具有细胞毒性作用的NO, 参与各种肝病的病理过程[3]. 临床资料显示, 在肝硬化患者血清中, 呼出气体中的一氧化氮水平明显升高, 且NO水平与内毒素水平有显著相关性[13-14], 提示肝病患者体内NO生物合成机制被激活是其肝细胞损伤的重要机制之一. 细胞培养实验显示, 肝脏枯否氏细胞在外界因素刺激下可产生大量的NO, 已知巨噬细胞释放的NO可通过抑制靶细胞线粒体中三羧酸循环、电子传递和细胞DNA合成等途径, 发挥杀伤靶细胞的效应[15]. 在肝损伤动物模型体内iNOS mRNA和NO的细胞来源问题说法不一. 在CCl4作用后, 肝脏枯否氏细胞产生NO, 胆管结扎致肝损害甚至肝纤维化时肝脏所有非实质细胞均产生NO, 即肝脏在不同损伤程度及不同类型损害时其iNOS表达各异[16-18]. 我们用CCL4诱导小鼠慢性肝纤维化过程中发现, 除了枯否氏细胞表达iNOS外, 肝细胞自身也有明显的iNOS表达, 且iNOS的表达水平与肝脏的损伤程度成正比, 提示肝细胞高表达的iNOS与肝纤维化发生有关. 受损肝细胞合成的NO与枯否细胞分泌的细胞因子及HSC的激活和增殖之间有何内在关系值得深入探讨. 苦参碱ip后能显著降低受损肝细胞iNOS表达, 减轻肝细胞损伤, 表明苦参碱抗肝纤维化的作用与其抑制受损肝细胞iNOS的活性、减少NO合成有关, 提示血清NO水平可作为判断苦参碱治疗肝纤维化、肝硬化疗效的参考指标.
临床实验显示苦参碱具有良好的保护肝细胞、减轻肝纤维化等作用, 其确切机制不明了. 研究表明诱生型NOS(iNOS)与肝细胞损伤有关, 苦参碱与iNOS之间关系如何目前未见相关报道.
各种致病因素所致的肝细胞变性、坏死在肝纤维化形成过程中起较强的刺激和诱导作用, 寻找合适的靶点保护肝细胞是抗肝纤维化的关键, 是目前研究的热点之一.
本文整体设计基本合理, 数据可信, 具有一定的参考价值.
编辑: 李军亮 电编:郭海丽
| 2. | Chen T, Zamora R, Zuckerbraun B, Billiar TR. Role of nitric oxide in liver injury. Curr Mol Med. 2003;3:519-526. [PubMed] |
| 3. | Nadler EP, Dickinson EC, Beer-Stolz D, Alber SM, Watkins SC, Pratt DW, Ford HR. Scavenging nitric oxide reduces hepatocellular injury after endotoxin challenge. Am J Physiol Gastrointest Liver Physiol. 2001;281:G173-181. [PubMed] |
| 4. | Shi GF, Li Q. Effects of oxymatrine on experimental hepatic fibrosis and its mechanism in vivo. World J Gastroenterol. 2005;11:268-271. [PubMed] |
| 5. | Zhang JP, Zhang M, Zhou JP, Liu FT, Zhou B, Xie WF, Guo C. Antifibrotic effects of matrine on in vitro and in vivo models of liver fibrosis in rats. Acta Pharmacol Sin. 2001;22:183-186. [PubMed] |
| 8. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] |
| 9. | Bedossa P, Paradis V. Liver extracellular matrix in health and disease. J Pathol. 2003;200:504-515. [PubMed] |
| 10. | Bissell DM, Roulot D, George J. Transforming growth factor beta and the liver. Hepatology. 2001;34:859-867. [PubMed] |
| 11. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci U S A. 1999;96:2345-2349. [PubMed] |
| 12. | Mercado-Pimentel ME, Runyan RB. Multiple transforming growth factor-beta isoforms and receptors function during epithelial-mesenchymal cell transformation in the embryonic heart. Cells Tissues Organs. 2007;185:146-156. [PubMed] |
| 13. | Goh BJ, Tan BT, Hon WM, Lee KH, Khoo HE. Nitric oxide synthase and heme oxygenase expressions in human liver cirrhosis. World J Gastroenterol. 2006;12:588-594. [PubMed] |
| 14. | Sarela AI, Mihaimeed FM, Batten JJ, Davidson BR, Mathie RT. Hepatic and splanchnic nitric oxide activity in patients with cirrhosis. Gut. 1999;44:749-753. [PubMed] |
| 15. | Kesherwani V, Sodhi A. Differential activation of macrophages in vitro by lectin Concanavalin A, Phytohemagglutinin and Wheat germ agglutinin: production and regulation of nitric oxide. Nitric Oxide. 2007;16:294-305. [PubMed] |
| 16. | 刁 同进, 李 又林, 赵 晓东, 李 冬梅, 姚 晓平, 杨 甲梅, 吴 孟超. 一氧化氮在大鼠异种肝移植急性排异中的作用及其黄递酶组化研究. 肝胆胰外科杂志. 2000;12:193-197. |
| 17. | Rockey DC, Chung JJ. Regulation of inducible nitric oxide synthase and nitric oxide during hepatic injury and fibrogenesis. Am J Physiol. 1997;273:G124-130. [PubMed] |
| 18. | McNaughton L, Puttagunta L, Martinez-Cuesta MA, Kneteman N, Mayers I, Moqbel R, Hamid Q, Radomski MW. Distribution of nitric oxide synthase in normal and cirrhotic human liver. Proc Natl Acad Sci U S A. 2002;99:17161-17166. [PubMed] |