修回日期: 2007-10-23
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 观察降脂颗粒对非酒精性脂肪肝大鼠的治疗作用及其对血清瘦素、肝组织瘦素受体mRNA、P-JAK2/P-STAT3蛋白含量表达的影响.
方法: 将60只SD♂大鼠, 随机分为空白组(正常饮食)和造模组(高脂饮食). 待造模成功后将造模组大鼠随机分为模型对照组、降脂颗粒低、中、高剂量组和东宝甘泰组. 治疗4 wk后行肝组织生化和病理学检测, 并同时应用ELISA试剂盒检测血清瘦素, RT-PCR法检测肝组织瘦素受体mRNA表达, 应用Western blot检测肝组织P-JAK2和P-STAT3蛋白的表达.
结果: 低、中、高剂量组降脂颗粒能明显降低非酒精性脂肪肝大鼠模型肝脂(TG和TC)水平, 改善脂肪变性, 降低肝脏炎症反应, 并能明显降低血清瘦素高水平状态(193.02±23.8 ng/L, 163.97±31.38 ng/L, 147.83±17.59 ng/L vs 317.22±39.26 ng/L, P<0.01), 改善瘦素抵抗, 同时增加瘦素受体mRNA的表达(1.87±0.06, 2.20±0.04, 2.78±0.04 vs 1.50±0.05, P<0.01), 增加肝组织P-JAK2和P-STAT3蛋白的含量(119.88±2.98, 123.45±0.68, 124.34±3.42 vs 113.15±1.27, P<0.01; 94.15±0.78, 100.18±3.33, 101.94±2.20 vs 89.06±0.69, P<0.01).
结论: 降脂颗粒对非酒精性脂肪肝大鼠肝脏脂质和炎症有较好的治疗作用, 其可能机制是改善瘦素抵抗, 增加肝脏瘦素受体mRNA表达及P-JAK2, P-STAT3蛋白含量.
引文著录: 马赞颂, 柳涛, 郑培永, 邢练军, 季光. 中药降脂颗粒对非酒精性脂肪肝大鼠肝脏瘦素受体mRNA及P-JAK2/P-STAT3的影响. 世界华人消化杂志 2007; 15(32): 3360-3366
Revised: October 23, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To study the effect of Jiangzhi granules on non-alcoholic fatty liver disease in rats, and on the expression of leptin receptor mRNA, P-JAK2 and P-STAT3 in the liver.
METHODS: Sixty-eight male Sprague-Dawley rats were randomly divided into two groups: blank group (n = 8), fed a normal diet; Model group (n = 60), fed high fat diet, Fifty-eight rats in Model group were randomly divided into five groups: control group (n = 10), Jiangzhi granules low-dose group (n = 12), Jiangzhi granules moderate dose group (n = 12), Jiangzhi granules high-dose group (n = 12) and Dongbao Gantai (DB) group (n = 12). We examined the effect of traditional Chinese medicine and DB on liver/body weight ratio, expression of leptin receptor mRNA (RT-PCR), P-JAK2 (Western blotting), P-STAT3 (Western blotting), triglyceride (TG) and total cholesterol (TC) in liver tissue.
RESULTS: In the low-, moderate- and high-dose groups, Jiangzhi granules significantly reduced liver lipid (TG, TC) levels, improved steatosis, reduced hepatitis, and significantly reduced the high level of serum leptin (193.02 ± 23.8 ng/L, 163.97 ± 31.38 ng/L, 147.83 ± 17.59 ng/L vs 317.22 ± 39.26 ng/L, P < 0.01), improved leptin resistance, increased expression of leptin receptor mRNA (1.87 ± 0.06, 2.20 ± 0.04, 2.78 ± 0.04 vs 1.50 ± 0.05, P < 0.01), P-JAK2 (119.88 ± 2.98, 123.45 ± 0.68, 124.34 ± 3.42 vs 113.15 ± 1.27, P < 0.01) and P-STAT3 (94.15 ± 0.78, 100.18 ± 3.33, 101.94 ± 2.20 vs 89.06 ± 0.69, P < 0.01).
CONCLUSION: Jianghzhi granules effectively improve liver function, hepatitis and steatosis. Jiangzhi granules can increase expression of leptin receptor mRNA, p-JAK2 and p-STAT3 in liver tissue.
- Citation: Ma ZS, Liu T, Zheng PY, Xing LJ, Ji G. Effect of Jiangzhi granules on expression of leptin receptor mRNA, P-JAK2 and P-STAT3 in rats with non-alcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3360-3366
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3360.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3360
肝脏是脂肪代谢的主要场所, 非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是肝脏脂肪代谢异常所导致的肝内三酰甘油(triacylglyceride, TG)蓄积过多的一种病理状态[1]. 该病与中心性肥胖、2型糖尿病、代谢综合征(肥胖、血脂障碍、胰岛素抵抗和高血压等)多囊卵巢综合征以及高三酰甘油血症等密切相关[2]. 目前认为该病的发病机制主要是"二次打击学说", 第一次打击是胰岛素抵抗引起的脂肪在肝细胞的沉积, 第二次打击是在脂肪沉积的基础上的脂质过氧化、氧化应激和异常的细胞因子等参与的炎症反应形成脂肪性肝炎. 最近有临床研究显示, leptin在NAFL、肥胖、非酒精性脂肪性肝炎患者中血清水平升高[3-5]. 动物实验也提示leptin在NAFL、肝纤维化、非酒精性脂肪性肝炎中表达增高, 在促进炎症、促进肝纤维化中起主要作用[6-8]. 然而, 其确切机制尚不清楚. 现代医学尚无特效药物治疗该病. 因此, 寻找治疗NAFLD的有效药物亦是当务之急. 降脂颗粒系龙华医院院内制剂, 全方由绞股兰15 g、虎杖15 g、丹参9 g、茵陈9 g、干荷叶6 g五味中药组成, 长期应用于临床, 安全而有效. 我们通过高脂饮食诱导NAFLD大鼠模型, 观察降脂颗粒对NAFLD大鼠的治疗作用及其对血清瘦素、肝组织瘦素受体mRNA、P-JAK2、P-STAT3蛋白含量表达的影响, 探讨降脂颗粒治疗NAFLD的可能机制.
清洁级♂SD大鼠68只, 体质量180±30 g, 购于上海斯莱克实验动物有限责任公司. 胆固醇, 购于国药集团化学试剂有限公司. TG和TC试剂盒购于南京建成生物工程研究所, leptin试剂盒购于上海森雄科技生物有限公司, RT-PCR试剂盒购于上海申能博彩生物科技有限公司, P-JAK2和P-STAT3试剂盒购于Santa Cruz公司, 降脂颗粒(绞股兰15 g, 虎杖15 g, 丹参9 g, 茵陈9 g, 干荷叶6 g)上海龙华医院提供, 东宝甘泰片, 通化东宝药业股份有限公司.
大鼠适应性饲养1 wk, 按体质量随机分为造模组60只, 空白对照组8只. 造模组给予高脂饲料[9](880 g基础饲料+100 g猪油+20 g胆固醇/kg), 空白组给予普通饲料, 自由饮食饮水. 第4, 8周各处死1只造模组大鼠做肝脏病理HE染色, 以判断造模情况. 造模组大鼠随机分成降脂颗粒低(12只)、中(12只)、高剂量组(12只)、东宝甘泰组(12只)和模型对照组(10只). 降脂颗粒低、中、高剂量组分别以降脂颗粒干膏粉0.414 g, 0.828 g, 1.656 g/kg每日ig; 东宝甘泰组以0.15 片/kg每日ig; 空白对照组及模型对照组分别给予等量的5 g/L CMC液. 治疗4 wk后取下肝脏, 称质量, 备检. 制备肝组织匀浆, 比色法测定肝脏TC和TG. 石蜡切片, HE染色, 光镜下观察肝脂肪变性和炎症程度. 肝细胞脂肪变性程度判断标准参照Diehl法[10], 炎症活动度计分标准参考1981年Knodell提出的慢性肝炎组织学活动指数(HAI)[11], 并结合王泰龄 et al[12]提出的慢性肝炎炎症活动度计分方案. 血清瘦素水平检测严格按照leptin ELISIA试剂盒说明书操作.
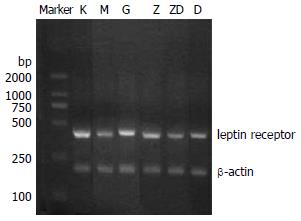
1.2.1 肝脏瘦素受体mRNA测定: 取肝组织100 mg按照TRIzol Reagent液说明书提取总RNA, 然后用紫外分光光度计定量. 按照试剂盒说明书进行cDNA的逆转录. 总RNA经RT反应后进行PCR扩增, leptin receptor (LR) mRNA上游序列: CAGGCAACACTGAAGGGAAGACG, 382 bp, 下游序列: CATCATCTGTGACTTCCATACGC 822 bp; β-actin上游序列: TGTGATGGTGGGTATGGGTCAGAAG, 207 bp, 下游序列: TCACGGTTGGCCTTAGGGTTCAGAG, 431 bp. 采用AMV 49 μL体系, 1st strand cDNA 10×PCR Buffer各5 μL, dNTP 1 μL, 目的基因正负链各2 μL, β-actin正负链各2 μL, Taq酶1 μL, DEPC H2O 29 μL. 反应条件为: 95℃预变性5 min, 95℃ 30 s, 59℃ 40 s, 72℃ 1 min, 30次循环, 72℃延伸10 min. PCR产物加样于20 g/L琼脂糖凝胶, 上样量10 μL, 6×DNA loading Buffer 2 μL, 电压150 V, 电泳35 min, 紫外灯下观察, 凝胶分析系统拍照. 用密度扫描仪对特异性条带进行密度扫描, 测得其灰度值, 与相应的β-actin灰度之比表示leptin receptor mRNA的相对水平.
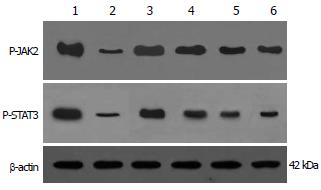
1.2.2 肝组织P-JAK2和P-STAT3蛋白含量的检测: 抗原蛋白提取后采用紫外分光光度计进行蛋白质定量. 取总蛋白50 μg, 加等量SDS凝胶加样缓冲液, 100℃变性3 min, 100 g/L十二烷基硫酸钠一聚丙烯酰胺(SDS-PAGE)凝胶电泳后, 采用半干式电转移仪(Bio-Rad公司), 参照厂家提供程序进行转膜. 转移结束后, 室温下用含50 g/L脱脂奶粉的PBS封闭2 h, 然后分别加入鼠抗人P-JAK2或P-STAT3 mAb(购自Santa Cruz公司, 工作浓度1:1000)室温下振荡1 h, 再加入1:5000稀释的二抗(HRP-GAMG购自Bio-Rad公司)室温下孵育1 h, 放射自显影: 曝光5 min, 用密度扫描仪进行密度扫描, 测得其灰度值, 与相应的β-actin灰度之比表示其蛋白含量.
统计学处理 计量资料以mean±SD表示, 组间比较采用方差分析; 等级资料采用秩和检验, 用SPSS12.0软件包进行数据统计.
空白组大鼠精神充沛, 灵活好动, 饮食正常, 皮毛整洁. 模型组大鼠精神萎靡, 性情较温顺, 不喜动, 皮毛凌乱欠光泽. 用药组均有不同程度的活动减少, 饮食减少, 皮毛欠光泽.
高脂饮食可诱导大鼠NAFLD模型, 表现为模型大鼠肝质量增加, 肝脏指数明显升高(4.20±0.20 vs 2.54±0.23), 各组均能明显降低脂肪肝大鼠的肝脏指数(3.87±0.43, 3.64±0.25, 3.58±0.29), 与模型组比较有显著差异(P<0.05, P<0.01, P<0.01). 降脂颗粒高剂量组明显优于东宝甘泰组(3.88±0.39, P<0.05)和低剂量组(P<0.05).
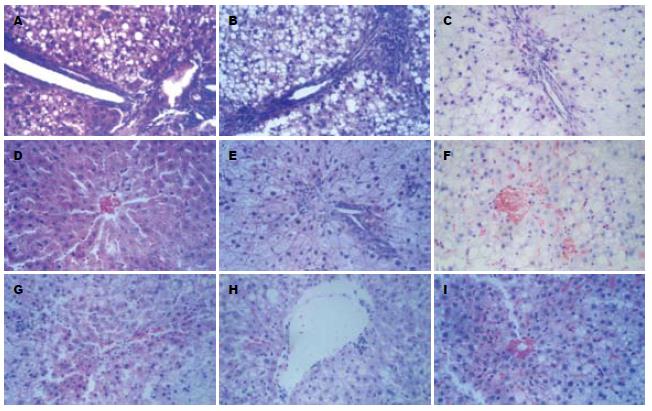
空白对照组肝脏肉眼观察呈鲜红色, 边缘锐利, 表面光滑. 模型组肉眼见肝脏体积增大, 边缘变钝, 颜色呈土黄色, 质软, 与周围组织有粘连, 切面油腻状. 给药组部分肝脏接近正常, 表面呈浅黄色, 油腻状减轻, 指压有弹性. 正常对照组大鼠肝组织切片HE染色未见明显异常. 模型组大鼠所有标本的肝组织切片均可见弥漫性肝细胞脂肪变性, 主要为大泡性脂肪变性, 也有部分小泡性脂肪变性, 同时肝小叶内和汇管区有以大量单个核细胞为主的炎性细胞浸润, 以小叶内炎症为主, 部分大鼠肝组织小叶内坏死灶融合成片. 用药组肝脏病理有不同程度的改善, 轻度至中度脂肪变为主, 肝细胞形态大致正常, 大小较一致, 肝内脂肪滴减少, 散在分布, 核圆位于细胞中央. 在抗炎方面, 降脂颗粒组与东宝甘泰组具有统计学的差异(P<0.05, 图1, 表1).
| 分组 | n | 脂肪变 | 病理炎症 | 肝脏TC(mmol/L) | 肝脏TG(mmol/L) |
| 空白组 | 8 | 0b | 0b | 1.98±0.53b | 0.11±0.04b |
| 模型组 | 10 | 3.10±0.57 | 1.50±0.71 | 9.19±1.03 | 0.75±0.07 |
| 东宝甘泰组 | 12 | 2.50±0.67a | 0.92±0.67a | 7.94±1.17a | 0.67±0.12a |
| 低剂量组 | 12 | 2.42±0.52a | 0.58±0.67b | 6.90±1.26bc | 0.58±0.09bc |
| 中剂量组 | 12 | 2.42±0.67a | 0.42±0.52b | 5.83±1.52bde | 0.51±0.07bde |
| 高剂量组 | 12 | 2.00±0.60bc | 0.33±0.49bc | 5.61±1.35bde | 0.43±0.12bdfg |
模型组大鼠肝脏TG、TC明显升高. 各用药组均能降低肝组织TG和TC水平(P<0.01, P<0.05), 降脂颗粒中、高剂量组明显优于东宝甘泰组(P<0.01). 在肝组织TG方面, 降脂颗粒高剂量组优于中、低剂量组(P<0.05, P<0.01), 中剂量组优于低剂量组(P<0.05), 高中低三组呈一定的量效关系(表1).
降脂颗粒和东宝甘泰均能明显降低NAFLD大鼠血清瘦素水平(P<0.01). 降脂颗粒中、高剂量组明显优于东宝甘泰组(P<0.01), 高剂量组优于低剂量组(P<0.01, 表2). LR mRNA在正常空白组肝组织呈高水平表达, 模型组肝组织LR mRNA呈低水平表达, 东宝甘泰及降脂颗粒各剂量均可增加LR mRNA的表达(P<0.01), 降脂颗粒高剂量组优于其他各组(P<0.01), 降脂颗粒中剂量组优于东宝甘泰组及降脂颗粒低剂量组(P<0.01, 表2, 图2).
模型组大鼠肝组织P-JAK2和P-STAT3的蛋白含量均较正常组大鼠表达为低(P<0.05). 各用药组均可增加P-JAK2和P-STAT3的蛋白含量(P<0.05), 降脂颗粒高剂量组明显优于东宝甘泰组和低剂量组(P<0.01, P<0.05, 表3, 图3).
NAFLD目前发病机制尚未完全搞清楚, 多数学者认为其与肥胖、糖尿病、高血压、高脂血症等胰岛素抵抗相关的代谢综合征有密切关系. 新近的研究显示, NAFLD常伴有胰岛素抵抗(insulin resistance, IR)和高胰岛素血症, 并与机体对瘦素(leptin)的敏感性降低有关[13]. 瘦素是机体脂肪组织的主要调节因子, 由脂肪组织释放入血, 通过血液循环分布到全身各种组织(主要分布于骨骼肌、脂肪组织、外周淋巴组织、中枢神经系统、胃肠道和肝脏等处), 并与其相应受体相结合, 通过Janus家族酪氨酸激酶/信号转导与转录激活因子(JAK/STAT). 其中最主要是通过JAK2/STAT3途径[14-15]产生生物学效应, 发挥其控制食物摄入和调节能量代谢的作用[16-17]. 目前研究认为, 瘦素参与肝脏内糖及脂肪代谢主要是通过调控肝脏磷酸烯醇式丙酮酸梭激酶(phosphoenolpyruvate carboxykinase, PEPCK)的基因表达和糖异生的效率, 促进肝脏对乳酸的摄取, 刺激肝糖原产生; 同时通过蛋白激酶A激活肉毒碱脂酰转移酶, 影响肝脏的脂肪代谢. 瘦素能通过减少摄食(减少约50%)及提高机体能量消耗即加强肝脏脂肪代谢而降低三酰甘油[18-19], 提示瘦素在脂肪肝治疗中具有重要作用. 然而, 现有研究结果表明, 非酒精性脂肪肝患者普遍存在瘦素抵抗. 瘦素抵抗通过上调固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1, SREBP-1)基因的表达, 使瘦素特异性抑制肝脏脂酰辅酶A去饱合酶-1(stearoyl-CoA desaturase-1 SCD-1)mRNA表达的能力下降[20-21], 促进肝内脂质合成, 导致脂肪肝的发生发展.
Tobe et al[22]在研究血浆瘦素水平与脂肪肝关系的实验中发现, 脂肪肝患者血浆瘦素水平明显高于对照组, 而且与转氨酶的升高平行. 经多元回归分析表明, 瘦素是脂肪肝发生的独立危险因素, 瘦素水平与BMI、血清胆固醇、低密度脂蛋白(LDL)、三酰甘油水平相关. 而且, 肥胖时, 瘦素的有效生物学作用明显下降, 而胰岛素水平则明显升高, 出现胰岛素抵抗. 瘦素抵抗可能参与肝脏脂肪变性的形成[23-24].
近年来, 有学者研究了瘦素抵抗的机制. 瘦素是通过与其受体结合来传递其调节能量代谢的信号, 当受体表达异常时, 可引起瘦素抵抗. Bartek et al[25]发现脂肪肝患者血清中的瘦素和游离瘦素受体水平均显著增高, 提示瘦素与其受体结合可能存在障碍. 肝组织瘦素受体mRNA变异或表达异常, 使受体功能下调时, 血清中的瘦素不能发挥生理作用, 从而产生瘦素抵抗[26]. 有研究表明, 瘦素受体或受体后缺陷的存在[27-28]即瘦素JAK2/STAT3信号转导发生障碍, 使瘦素不能发挥生物学效应从而产生瘦素抵抗.
我们的实验结果表明, 模型组大鼠血清瘦素浓度显著高于正常对照组. 然而, 尽管模型组动物体内有很高的瘦素水平, 还是发生了脂质代谢紊乱、NAFLD, 表明机体对瘦素的作用不敏感或反应性降低, 存在瘦素抵抗. 降脂颗粒组及西药东宝甘泰组血清瘦素水平与模型组相比均有不同程度的下降, 具有显著的统计学差异. 伴随着血清瘦素水平的下降, 脂肪代谢明显得到改善, 脂肪肝程度也明显减轻, 得到了肝脏脂质及病理结果的证实, 说明降脂颗粒可以改善NAFLD大鼠体内的瘦素抵抗, 增强瘦素的敏感性. 我们推测降脂颗粒有可能对瘦素受体以及JAK2、STAT3的磷酸化产生影响, 因此我们测定了肝脏瘦素受体mRNA和P-JAK2、P-STAT3的表达情况, 以证实我们假说的合理性. 我们的结果表明, 模型组大鼠肝组织瘦素受体mRNA表达较正常对照组明显减弱, 各用药组大鼠肝组织瘦素受体mRNA表达均较模型组为高, 尤以降脂颗粒组为显著, 与东宝甘泰组相比具有统计差异. 我们推测高瘦素血症对瘦素受体的表达有负反馈调节作用. 这与有关报道一致[29].
为了研究降脂颗粒对瘦素JAK2/STAT3表达的影响, 我们对P-JAK2和P-STAT3的含量进行了测定, 这是因为瘦素生物学效应的发挥, 必须与瘦素受体结合后使JAK2和STAT3磷酸化[30], 才能使信号转导下去发挥瘦素的生物效应. 进一步实验表明, 降脂颗粒可以增加P-JAK2和P-STAT3蛋白的含量, 与模型组比较有显著性差异, 提示降脂颗粒可能对瘦素JAK2/STAT3信号通路存在调节作用. 目前, 国内外尚无有关非酒精性脂肪肝肝组织瘦素JAK2/STAT3信号通路的报道. 我们首次进行了这方面的探索, 当然, 还有很多内容亟需进一步深入研究.
随着人民生活水平的提高, 脂肪肝的发病率逐年上升. 然而, 现代医学对NAFLD的病理机制尚不清楚, 亦无理想的防治药物, 而中医药对防治NAFLD具有较好的疗效, 越来越被广大患者所接受.
Leptin在非酒精性脂肪性肝中的作用日益受到大家的重视. 大部分临床和实验研究显示, leptin在非酒精性脂肪性肝、非酒精性脂肪性肝炎、肝纤维化中表达升高. 本实验结果与此一致, 并探讨降脂颗粒对肝脏瘦素受体及其相关信号的影响.
有研究显示提升瘦素水平是治疗脂肪肝的有效途径. 本实验则认为血中瘦素水平升高是致脂肪肝的危险因素, 提示降脂颗粒可以降低血瘦素水平, 并首次研究降脂颗粒对肝脏瘦素受体及P-JAK2和P-STAT3的影响.
本文结果提示leptin在非酒精性脂肪性肝中表达升高而肝组织瘦素受体mRNA表达降低, 中药降脂颗粒有降低leptin提高肝组织瘦素受体mRNA的作用. 实验表明, 降脂颗粒可增加P-JAK2和P-STAT3蛋白的含量, 提示降脂颗粒可能对瘦素JAK2/STAT3信号通路存在调节作用, 这为我们对瘦素的认识和中药的应用提供了新的内容.
本文实验设计合理, 思路清晰,分析有据, 科学性和可读性较强.
编辑: 程剑侠 电编:郭海丽
| 2. | Marchesini G, Brizi M, Bianchi G, Tomassetti S, Bugianesi E, Lenzi M, McCullough AJ, Natale S, Forlani G, Melchionda N. Nonalcoholic fatty liver disease: a feature of the metabolic syndrome. Diabetes. 2001;50:1844-1850. [PubMed] |
| 3. | Pagano C, Soardo G, Pilon C, Milocco C, Basan L, Milan G, Donnini D, Faggian D, Mussap M, Plebani M. Increased serum resistin in nonalcoholic fatty liver disease is related to liver disease severity and not to insulin resistance. J Clin Endocrinol Metab. 2006;91:1081-1086. [PubMed] |
| 4. | Valtuena S, Numeroso F, Ardigo D, Pedrazzoni M, Franzini L, Piatti PM, Monti L, Zavaroni I. Relationship between leptin, insulin, body composition and liver steatosis in non-diabetic moderate drinkers with normal transaminase levels. Eur J Endocrinol. 2005;153:283-290. [PubMed] |
| 5. | Javor ED, Ghany MG, Cochran EK, Oral EA, DePaoli AM, Premkumar A, Kleiner DE, Gorden P. Leptin reverses nonalcoholic steatohepatitis in patients with severe lipodystrophy. Hepatology. 2005;41:753-760. [PubMed] |
| 6. | Balasubramaniyan V, Nalini N. Effect of hyperleptinaemia on chronic ethanol-induced hepatotoxicity in mice. Fundam Clin Pharmacol. 2006;20:129-136. [PubMed] |
| 7. | Gauthier MS, Favier R, Lavoie JM. Time course of the development of non-alcoholic hepatic steatosis in response to high-fat diet-induced obesity in rats. Br J Nutr. 2006;95:273-281. [PubMed] |
| 10. | Diehl AM, Goodman Z, Ishak KG. Alcohollike liver disease in nonalcoholics. A clinical and histologic comparison with alcohol-induced liver injury. Gastroenterology. 1988;95:1056-1062. [PubMed] |
| 11. | Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981;1:431-435. [PubMed] |
| 13. | Chitturi S, Abeygunasekera S, Farrell GC, Holmes-Walker J, Hui JM, Fung C, Karim R, Lin R, Samarasinghe D, Liddle C. NASH and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology. 2002;35:373-379. [PubMed] |
| 14. | Saxena NK, Ikeda K, Rockey DC, Friedman SL, Anania FA. Leptin in hepatic fibrosis: evidence for increased collagen production in stellate cells and lean littermates of ob/ob mice. Hepatology. 2002;35:762-771. [PubMed] |
| 15. | Rizk NM, Stammsen D, Preibisch G, Eckel J. Leptin and tumor necrosis factor-alpha induce the tyrosine phosphorylation of signal transducer and activator of transcription proteins in the hypothalamus of normal rats in vivo. Endocrinology. 2001;142:3027-3032. [PubMed] |
| 16. | Larsson H, Elmstahl S, Berglund G, Ahren B. Evidence for leptin regulation of food intake in humans. J Clin Endocrinol Metab. 1998;83:4382-4385. [PubMed] |
| 17. | Flynn MC, Plata-Salaman CR. Leptin (OB protein) and meal size. Nutrition. 1999;15:508-509. [PubMed] |
| 18. | Cohen P, Miyazaki M, Socci ND, Hagge-Greenberg A, Liedtke W, Soukas AA, Sharma R, Hudgins LC, Ntambi JM, Friedman JM. Role for stearoyl-CoA desaturase-1 in leptin-mediated weight loss. Science. 2002;297:240-243. [PubMed] |
| 19. | Petersen KF, Oral EA, Dufour S, Befroy D, Ariyan C, Yu C, Cline GW, DePaoli AM, Taylor SI, Gorden P. Leptin reverses insulin resistance and hepatic steatosis in patients with severe lipodystrophy. J Clin Invest. 2002;109:1345-1350. [PubMed] |
| 20. | Tobe K, Suzuki R, Aoyama M, Yamauchi T, Kamon J, Kubota N, Terauchi Y, Matsui J, Akanuma Y, Kimura S. Increased expression of the sterol regulatory element-binding protein-1 gene in insulin receptor substrate-2(-/-) mouse liver. J Biol Chem. 2001;276:38337-38340. [PubMed] |
| 21. | Cohen P, Friedman JM. Leptin and the control of metabolism: role for stearoyl-CoA desaturase-1 (SCD-1). J Nutr. 2004;134:2455S-2463S. [PubMed] |
| 22. | Tobe K, Ogura T, Tsukamoto C, Imai A, Matsuura K, Iwasaki Y, Shimomura H, Higashi T, Tsuji T. Relationship between serum leptin and fatty liver in Japanese male adolescent university students. Am J Gastroenterol. 1999;94:3328-3335. [PubMed] |
| 23. | Chitturi S, Farrell G, Frost L, Kriketos A, Lin R, Fung C, Liddle C, Samarasinghe D, George J. Serum leptin in NASH correlates with hepatic steatosis but not fibrosis: a manifestation of lipotoxicity? Hepatology. 2002;36:403-409. [PubMed] |
| 24. | Campillo B, Sherman E, Richardet JP, Bories PN. Serum leptin levels in alcoholic liver cirrhosis: relationship with gender, nutritional status, liver function and energy metabolism. Eur J Clin Nutr. 2001;55:980-988. [PubMed] |
| 25. | Bartek J, Bartos J, Galuska J, Galuskova D, Stejskal D, Ivo K, Ehrmann J, Ehrman J Jr, Chlup R. Expression of ob gene coding the production of the hormone leptin in hepatocytes of liver with steatosis. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2001;145:15-20. [PubMed] |
| 26. | Koteish A, Diehl AM. Animal models of steatosis. Semin Liver Dis. 2001;21:89-104. [PubMed] |
| 27. | Carpenter LR, Farruggella TJ, Symes A, Karow ML, Yancopoulos GD, Stahl N. Enhancing leptin response by preventing SH2-containing phosphatase 2 interaction with Ob receptor. Proc Natl Acad Sci U S A. 1998;95:6061-6066. [PubMed] |
| 28. | Crouse JA, Elliott GE, Burgess TL, Chiu L, Bennett L, Moore J, Nicolson M, Pacifici RE. Altered cell surface expression and signaling of leptin receptors containing the fatty mutation. J Biol Chem. 1998;273:18365-18373. [PubMed] |
| 29. | 赵 彩彦, 李 丽, 李 建梅, 邓 卓军, 刘 敬稳, 李 燕红. 非酒精性脂肪性肝病大鼠肝组织瘦素受体表达的变化. 中国组织化学与细胞化学杂志. 2005;14:613-617. |
| 30. | Guo F, Bakal K, Minokoshi Y, Hollenberg AN. Leptin signaling targets the thyrotropin-releasing hormone gene promoter in vivo. Endocrinology. 2004;145:2221-2227. [PubMed] |