修回日期: 2007-10-25
接受日期: 2007-10-28
在线出版日期: 2007-11-08
Obestatin与Ghrelin是两种重要的脑肠肽(brain-gut peptide, BGP), 与其受体结合后发挥重要的生物学功能. Obestatin位于胃生长素前体原的76-98片段, 可以结合孤儿G蛋白GPR39受体, 抑制食物摄取、 空肠的蠕动和体质量的增加. 而Ghrelin则位于胃生长素前体原的24-51肽段, 可以结合蛋白受体GHS-R, 增加食欲和体质量, 促进GH的释放, 影响心血管功能和免疫机能等. Obestatin被认为是Ghrelin的生物学拮抗剂或阴阳活性多肽.
引文著录: 唐胜球, 江青艳, 张永亮, 朱晓彤, 束刚, 高萍. 脑肠肽Obestatin与Ghrelin的研究进展. 世界华人消化杂志 2007; 15(31): 3324-3331
Revised: October 25, 2007
Accepted: October 28, 2007
Published online: November 8, 2007
Obestatin and ghrelin are two important brain-gut peptides that can combine with their receptors and exert important biological functions. Obestatin is a 76-98 amino acid polypeptide segment of proghrelin that binds to the orphan G-protein-coupled receptor GPR39, which can suppress food intake, inhibit jejunal contraction, and decrease body-weight gain. Ghrelin is a 24-51 amino acid peptide segment of proghrelin that binds to receptor GHS-R, which can enhance appetite and body weight, promote the release of GH, and affect cardiovascular and immune functions. Obestatin is regarded as on biological antagonist, or a Yin and Yang activated polypeptide of ghrelin.
- Citation: Tang SQ, Jiang QY, Zhang YL, Zhu XT, Shu G, Gao P. Research progress on brain-gut peptide obestatin and ghrelin. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3324-3331
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3324.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3324
为了寻找研制新型药物的新途径, 斯坦福大学的Zhang et al对人类基因数据库和其他机体组织进行了详细研究. 在研究过程中, 他们将注意力放在了那些数百万年的进化过程中保留下来的在生物进化过程中发挥非常重要作用的基因片段上. 结果在胃生长素前体(proghrelin)基因序列的末端, 科学家们找到了一种新的蛋白质, 并将其命名为肥胖抑制素(Obestatin), 其中"obe"是拉丁文来源词"obedere"的缩写, 表示大量摄食, 而"statin"则表示"抑制". 接着Zhang et al成功从大鼠的胃组织中成功分离出这种能够抑制饥饿感的激素. 除了人类之外, 在其他10多种哺乳动物的组织中也发现了此激素. Zhang et al[1]的研究同时也证实Obestatin与已发现的胃生长素Ghrelin之间存在密切的联系, 在维持机体的代谢平衡中起重要的生物学作用. 本文主要就Obestatin与Grhelin结构与分布、受体的分子结构、生理功能及二者的关系作一综述.
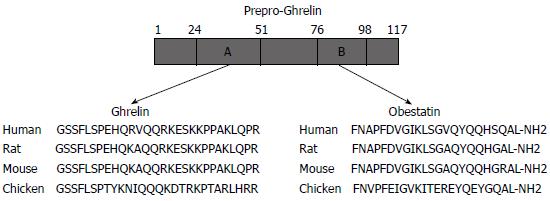
研究证实Obestatin产生于胃部, 位于胃生长素前体原的76-98多肽段, 由23个氨基酸残基所组成[1]. 这个氨基酸区域在种属间具有高度保守性, 表明他在不同种属间有相关的生物功能. 从大鼠胃组织和血液中纯化出这种分泌肽, 与所预测的肽段大小和氨基酸序列相同. 与Ghrelin类似, 其翻译形成的前体原在剪切后, 他的C末端需经过酰胺化修饰后才能形成有活性的功能肽. 该激素可与孤儿G蛋白受体GPR39结合.
Ghrelin的分子质量为3370.9, 颗粒直径为90-150 nm, 是含有28个氨基酸残基的多肽. Proghrelin N端的前23个氨基酸残基具有分泌信号肽特征, 从第24位的甘氨酸到第51位的28个氨基酸残基为Ghrelin序列, 基因序列见图1. Ghrelin的C末端的P-R结构(脯氨酸-精氨酸)为其识别部位. 对Ghrelin的组成和结构分析表明, Ghrelin主要有两种分子存在形式, 即第3位丝氨酸残基N端辛酰基化和去N端辛酰基化. 第3位丝氨酸残基N端辛酰基化, 则具有生物活性, 去N端辛酰基化后, 则失去生物活性[2]. Ghrelin主要由胃底分泌, 下丘脑、肠道、肾脏和胎盘也有少量分泌[3].
Obestatin受体GPR39与Ghrelin受体GHS-R(Growth hormone secretagogue receptor, GHS-R)来源于同一家族. GPR39由452个氨基酸残基构成, 具有7个跨膜域. GPR39是与G蛋白耦联的受体, 定位于人2号染色体, 在空肠、回肠、十二指肠、胃、肝脏及垂体中高度表达[4], 其表达部位是调节能量平衡的主要器官[5].
Ghrelin受体GHS-R有Ia和Ib两种亚型, GHS的促分泌效应主要是通过与Ia型GHS-R结合而发挥的. GHS-R Ia含366个氨基酸残基, 有7个跨膜域; 而GHS-R Ib仅含289个氨基酸残基, 有5个跨膜域. Ghrelin的功能性受体GHS-R Ia mRNA主要在垂体、下丘脑弓状核、腹内侧核、漏斗核、睾丸组织、Leydig细胞和Sertoli细胞内表达, 而在甲状腺、胰腺、脾脏、脂肪组织及肾上腺表达水平很低; 而非功能性GHS-R Ib mRNA在组织器官中广泛表达. GHS-R在一些正常组织中常缺乏表达, 但在肿瘤组织中却呈高浓度表达. 比如在乳腺癌组织中有GHS-R表达, 但在正常乳腺组织或乳腺纤维腺瘤中不表达[6].
为了研究Obestatin所发挥的生理作用, Zhang及其研究小组在实验室人工合成了Obestatin激素, 并在体质量正常的大鼠身上进行了实验, 每天三次采用酰胺化的Obestatin腹腔内(1 µmol/kg体质量)或脑室内(8 nmol/kg体质量)注射成年公鼠. 结果发现, 实验鼠胃部的排空过程变慢, 食物在肠道中的运动速度减缓, 鼠的进食量平均下降了一半, 体质量在8 d内减轻了20%[1]. 可能是因为Obestatin抑制了Ghrelin的活性, 使胃的排空和空肠的收缩受到抑制, 促使传入迷走神经传入信号, 使中枢产生过饱应答. 而未被酰胺化的Obestatin则没有这种效果. Zhang et al的实验研究同时也证明, 注射Obestatin的公鼠血浆内瘦素的水平没有受影响, 说明Obestatin缺乏分解脂肪的功能, 也不能确定Obestatin是否有降血脂的功能. Obestatin的作用可能主要是调节胃肠的过饱和, 通过刺激机体, 产生反胃或内脏的不适感来抑制食欲. 近来在判断减肥药的药效时, 研究者强调, 应排除那些对实验对象的食欲产生非特异性抑制的因素[7]. 尽管啮齿类动物和人的Obestatin的序列同源性达到87%, GPR39的达到93%[8-9], 但是从啮齿类动物实验得到的结果也不总与人的结果吻合. Obestatin与人的肥胖症及其他疾病之间的联系尚需进一步探讨.
随着Obestatin的深入研究, 目前大多数研究者的结论认为, 采用脑室、腹腔和静脉注射不同浓度Obestatin并不影响鼠的摄食或体质量变化[10-15]. Obestatin (300 mg/kg)与胆囊收缩素(CCK)(1 mg/kg)一起腹腔注射大鼠不会改变CCK引起的摄食量降低, 也不会影响摄食、迷走神经活力和CCK引起的饱感信号[10]. 基于Obestatin对摄食和体质量影响的不同实验结果, Lagaud et al[16]进行了更深入的探讨. 他们采用宽量程的Obestatin对小鼠和大鼠进行了研究, 实验结果显示Obestatin抑制摄食与剂量有关, 低剂量和高剂量对摄食量都无影响, 这也是其他研究者未发现Obestatin该作用效果的原因之一.
其他研究者证实, Obestatin影响大鼠记忆和学习, 有抗焦虑的作用, 但和Ghrelin一样可以提高记忆力[17]. Obestatin可抑制渴感[18], 影响睡眠[19], 促进人视网膜上皮细胞[20]和猪卵巢颗粒细胞增殖, 并且有剂量依赖性[21].
根据本课题组最近研究发现, Obestatin对长白仔猪原代培养肝细胞也有一定的促增殖作用, 10 nmol Obestatin 能抑制IGF-I的分泌, 对Apo-B也有一定下调作用.
3.2.1 对食欲和脂肪合成的影响: Ghrelin是一种促进食欲和脂肪合成的强效激素[22-24]. 研究表明, 禁食48 h后大鼠胃中Ghrelin mRNA的表达增加, 血清Ghrelin浓度升高, 当给予食物后, Ghrelin浓度又恢复原来水平, 说明禁食可刺激Ghrelin合成, 促进胃内分泌细胞分泌Ghrelin[25]. 在白天或晚上给活动大鼠脑室注射Ghrelin, 均发现Ghrelin具有强烈的促食欲的生理效应. 此外, 给GH基因缺陷型大鼠脑室注射Ghrelin, 同样促进大鼠采食, Ghrelin的促食欲效应不依赖GH的信号转导途径[22]. Tschop et al[23]报道, 皮下或脑室注射Ghrelin增加小鼠与大鼠的采食、减少体脂利用并增加体质量. 对小鼠脑室和外周注射Ghrelin后发现, Ghrelin可强烈刺激小鼠食欲, 减少能量消耗, 增加体质量, 甚至改善由于生长激素缺乏引起的食欲减退症状[26]. 给健康人静脉注射Ghrelin, 可增加能量摄入量, 促进食欲[27]. 大量实验表明, 高Ghrelin水平可以增加体质量, 引起机体肥胖[23,27-29]. 禽类的研究结果却不同, Furuse et al[30]给雏鸡脑室注射大鼠Ghrelin或GH释放因子, 结果发现2 h内两者都强烈地抑制雏鸡的采食. 对于预先禁食3 h的雏鸡, 脑室注射Ghrelin仍可引起剂量依赖性的采食下降.
3.2.2 Ghrelin对胃肠道功能的影响: 研究证实Ghrelin的结构与胃动素相类似, Ghrelin在外周或中枢参与下对胃肠生理活动进行调节. 他能通过下丘脑刺激食欲, 增加胃酸分泌[31], 提高胃肠蠕动[32].
给大鼠静脉注射Ghrelin引起剂量依赖性的胃酸分泌增多, 胃运动频率增快、幅度增大[33-34]. 但该效应可被迷走神经切断或阿托品处理所阻断, 但不被组胺受体阻断剂所阻断[34], 说明Ghrelin通过迷走神经调节机体胃功能[34]. 给麻醉大鼠脑室注射Ghrelin, 同样刺激胃酸分泌, 该效应也可被迷走神经切断或阿托品预处理所阻断[35]. 然而, 以GHS和Ghrelin中枢处理清醒大鼠, 均能抑制其胃酸的分泌[36]. 这两种完全相反的结果可能与大鼠是否麻醉有关. 但这些结果都表明Ghrelin通过迷走神经对胃酸的分泌发挥调节作用. 外周Ghrelin被认为可以通过血脑屏障进入脑部发挥作用, 然而, 给完全切断迷走神经的小鼠腹腔注射Ghrelin, 并未引起采食增加[37]. 通过手术或化学方法阻滞迷走神经传入纤维, 可消除静脉注射Ghrelin引起的采食与激活NPY神经元和GHRH神经元的效应[38].
3.2.3 对心血管功能的影响: Ghrelin对心血管系统发挥多种生理功能, 包括对心力衰竭的保护. 给健康人静脉注射Ghrelin, 显著降低平均动脉血压, 增加心输出量, 并不影响心率[39], 且对患慢性心衰患者也有同样的生理效应[40]. Ghrelin对心血管系统的调节作用与他促生长激素分泌作用无关. Ghrelin可影响血液动力学指标, 给人静脉内注射Ghrelin, 血清生长激素浓度明显增加, 平均动脉压明显下降, 心脏指数增加16%, 每搏输出量增加22%[41]. 对结扎盲肠而引起休克的大鼠进行研究也发现, 与未经处理的休克组大鼠相比, 腿静脉注射10 nmol/kg剂量的Ghrelin可明显改善休克大鼠的左心室功能, 增加心输出量与平均动脉压、心脏指数和每搏输出量[42].
3.2.4 促进GH的分泌: 动物实验和临床研究都表明, Ghrelin有可重复刺激GH释放的作用, 且大剂量给药无明显副作用, 并与其他激素的分泌有密切关系. Nagaya et al[41]给人静脉注射Ghrelin发现循环血中GH水平明显升高, Ghrelin具有强烈的刺激GH释放的作用, 并且呈剂量依赖性反应[31]. 对自由活动大鼠的研究发现, 不同剂量Ghrelin(3、12、60 nmol/kg)可引起剂量依赖性GH释放增加. 虽然3 nmol/kg Ghrelin与3 nmol/kg GHRH对GH 促分泌作用相似, 但12 nmol/kg Ghrelin远比同剂量的GHRH促GH分泌作用强[35].
迷走神经参与垂体释放GH的调节. 迷走神经传入纤维将胃肠道和后脑的孤束核相连[42], 大约90%的膈下迷走神经纤维是传入神经纤维, 一些迷走传入纤维末梢存在于胃肠道黏膜和黏膜下层中, 直接感受胃肠腔中的各种刺激. 通过化学或手术的方法选择性地阻滞胃迷走神经, 将减弱Ghrelin外周处理引起的GH释放效应, 表明Ghrelin还可通过迷走神经生理性调节GH的释放[20].
3.2.5 对免疫系统的影响: 已发现B细胞和T细胞能够识别乳腺癌、肺癌、肾癌等肿瘤细胞表达的肿瘤抗原, 进而介导免疫反应. 在健康人血液B细胞、T细胞和中性粒细胞中发现有Ghrelin表达[43]. Dixit et al[44]研究人员发现, 人类T细胞分泌的Ghrelin通过抑制T细胞分泌细胞因子, 从而调节由此引起的厌食症, 并进一步提出Ghrelin可能通过同T细胞膜上的GHS-R结合来调节机体免疫反应. 睾丸癌组织中淋巴细胞所表达的Ghrelin有可能同肿瘤所致的厌食症和机体肿瘤免疫有关. 在高浓度下, Ghrelin能抑制乳腺癌、肺癌、甲状腺癌细胞株的增殖[45].
3.2.6 对甲状腺功能的影响: Caminos et al[46]的研究观察到甲亢患者血清Ghrelin水平明显降低, 而甲减患者血清Ghrelin水平明显升高. 有资料据报道, 肥胖个体血Ghrelin水平低下[47], 厌食和节食等负能量平衡状态时升高[48]. 但甲亢的消瘦和负能量平衡却导致血清Ghrelin水平降低, 甲减时能量消耗和摄食减少却显示血清Ghrelin水平升高. 这些研究结果提示, 甲状腺功能异常时血清Ghrelin水平的变化并非是体质量、体脂量和能量代谢变化所致. 甲状腺激素可能对中枢或外周Ghrelin的产生和分泌具有直接的调控作用. 又因甲状腺功能减退伴血清Ghrelin水平的显著增高, 而摄食明显减少, 提示Ghrelin的促摄食作用需甲状腺激素的协同参与, 或甲状腺激素水平低下机体产生Ghrelin抵抗, 导致血清Ghrelin水平代偿性升高. 血清Ghrelin和胖素-A(orexin-A)不是甲亢和甲减患者摄食改变的直接调节因子. 血清Ghrelin水平随甲状腺功能改变而变化的机制尚需进一步研究[45].
3.2.7 Ghrelin对能量代谢的影响: Ghrelin通过促进GH的释放, 增加胰岛素抵抗, 刺激糖原生成, 从而调节机体血糖水平. 综合近年研究结论, Ghrelin对胰岛素分泌的影响效应并不一致. 有报道指出, 给人静脉注射Ghrelin, 即使在血糖浓度升高的情况下仍能抑制胰岛素的分泌[49], 在其他实验动物上也有相似效应. 但也有研究发现, Ghrelin可以促进胰岛素的分泌. Ghrelin在大鼠胰岛α细胞中和胰高血糖素共存, 同时发现Ghrelin能增加胰岛α细胞内Ca2+浓度, 刺激胰岛素分泌[50]. 最近有报道表明, 缺乏重要的核转录因子Nkx2.2或Pax4会导致小鼠胰岛β细胞发育分化受阻, 并被Ghrelin细胞替代. 正常小鼠胰腺也存在一小类细胞能产生Ghrelin, 称为胰岛ε细胞, 揭示胰岛β细胞和ε细胞具有共同的前体细胞. 该前体细胞在某些转录因子的调节下发生不同的分化, 从而维持胰岛内胰岛素和Ghrelin的平衡, 进而调节机体的葡萄糖代谢[51].
下丘脑是控制机体食欲与能量稳态的调节中枢, 与胃肠道生理功能的调控密切相关, 并在参与机体采食、GH释放和能量稳态方面发挥重要作用[52]. 在啮齿类动物中, 机体主要通过Ghrelin和Leptin分别传递外周饥饿和饱食信号, 在下丘脑能量平衡中枢进行整合, 然后通过各种途径对食欲进行调节, 从而维持机体的能量稳态[29]. 研究发现, Ghrelin能减弱Leptin对NPY/AgRP神经元的抑制效应, 促进促食欲神经肽NPY和AgRP的表达和产生, 从而促进采食, 增加体质量[53-54]. 因而, 通过激活NPY/Y1受体信号转导通路, Ghrelin作为Leptin的天然拮抗剂发挥调节食欲与能量稳态的生理作用[22,24,28,55].
3.2.8 其他: Ghrelin的mRNA可以在人的所有组织中找到[56], Ghrelin还具有调节心脏、肾、胰腺、脂肪组织和性腺功能的作用[57]. 研究发现, Ghrelin能抑制由HCG和cAMP介导的大白鼠体外细胞睾酮分泌或直接影响LH的促睾酮分泌功能[58]. Furuta et al[59]报道, 卵巢切除大鼠脑室内注射Ghrelin可明显抑制黄体生成素(LH)的分泌. Ghrelin及其受体参与人和大白鼠睾丸组织促性腺激素轴系统的调控, 因此Ghrelin可能还是维持体内激素平衡的一个重要因子. 另据报道, 胰岛细胞瘤、前列腺癌、甲状腺癌和胃肠道类癌细胞中Ghrelin和GHSR水平升高, 提示Ghrelin的内分泌机制在肿瘤发病中可能起作用. Volante et al[60]报道, 在甲状腺癌细胞系中Ghrelin抑制细胞生长, 其抑制作用呈量效相关. Shimizu et al[61]发现, 肺癌患者血浆中Ghrelin水平高于对照组, 而化疗后患者的血浆中Ghrelin水平明显升高.
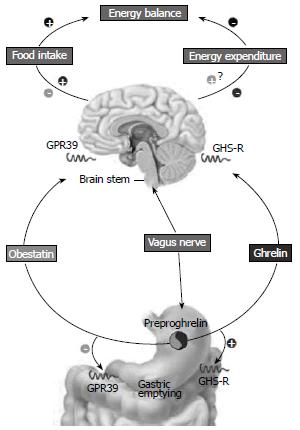
Zhang et al[1]研究报道, Obestatin是一种与Ghrelin有诸多相似之处的脑肠激素, 由胃部产生, 是由激素前导物质Proghrelin的蛋白质衍生而来. Proghrelin翻译后还存在不同剪切方式, 经过翻译后的不同片段剪切和不同类型的修饰产生不同的物质. Ghrelin是该前体蛋白经乙酰化修饰后形成, Obestatin则经该前体C末端酰胺化修饰产生. Ghrelin能够刺激机体增加对食物的摄入, 使体质量增加[27]; 而Obestatin可以抑制Ghrelin对食欲增加和空肠收缩的刺激作用, 说明Obestatin是Ghrelin的拮抗肽, 而将其称为"反Ghrelin"激素[1]. Lagaud et al[16]的研究证实, 腹腔注射Ghrelin 100 nmol/kg大鼠和小鼠皆显著增加摄食量, Obestatin(100 nmol/kg)则抑制摄食. Ghrelin(100 nmol/kg)和Obestatin(100 nmol/kg)一同注射时互相抵消彼此的作用, 与Zhang et al的结论一致. Obestatin和Ghrelin两种调节肽在同物种中睡眠的影响中也发挥了截然相反的作用[65]. 这些结果都表明, Ghrelin和这个同源的肽段Obestatin之间存在拮抗或阴阳关系. 但胃肠道里众多的小分子肽激素是如何进入血液系统, 从而激活中枢神经系统行使某些既定功能的. 图2采用了"肠-脑反射轴"的概念回答了这个问题, 科学分析了Obestatin与Ghrelin之间关系. 该模型是一个由激素和神经信号通路组成的复杂网络, 神经信号系统的作用是维持体内平衡和调节机体行为过程.
Obestatin和Ghrelin的生理功能及其关系的深入研究有助于我们了解机体对生长轴的调节作用. Obestatin和Ghrelin在某些疾病中的变化对于应用其进行诊断和治疗疾病具有重要意义. 专家分析对能量稳态和体质量控制的微妙平衡中Ghrelin和Obestatin作用, 也许是成功治疗肥胖症的关键, 但Obestatin和Ghrelin的发现仍给研究者留下许多尚未弄清的问题. Obestatin和Ghrelin作为在人体内新发现的两种脑肠肽, 二者的拮抗关系对体质量调节的研究有重要价值, 但其病理生理意义目前尚不完全清楚. 因此, 关于这两个基因的研究仍将继续和深入.
Ghrelin是一种具有多功能的肽, 国内外目前已有大量研究. Obestatin是新近发现的可调节食欲的多肽, 被认为是Ghrelin的对立面, 二者在生物体内相互平衡和协调, 发挥重要生理功能.
本文将最新的Obestatin与Gh-relin研究结果进行比较综述, 对了解Obestatin或Ghrelin的研究有指导作用.
Obestatin和Gh-relin的生理功能及其关系的深入研究有助于大家了解机体对生长轴的调节作用. Obestatin和Ghrelin在某些疾病中的变化对于应用其进行诊断和治疗疾病具有临床价值.
脑肠肽(brain-gut peptide, BGP): 是一类具有多种生理功能的多肽, 在生长轴的调节中发挥至关重要的作用.
本文综述较全面, 能体现较新的研究成果, 对人体肥胖和食欲、体质量调节的研究有一定的指导价值.
编辑: 程剑侠 电编:李军亮
| 1. | Zhang JV, Ren PG, Avsian-Kretchmer O, Luo CW, Rauch R, Klein C, Hsueh AJ. Obestatin, a peptide encoded by the ghrelin gene, opposes ghrelin's effects on food intake. Science. 2005;310:996-999. [PubMed] |
| 2. | Hattori N, Saito T, Yagyu T, Jiang BH, Kitagawa K, Inagaki C. GH, GH receptor, GH secretagogue receptor, and ghrelin expression in human T cells, B cells, and neutrophils. J Clin Endocrinol Metab. 2001;86:4284-4291. [PubMed] |
| 3. | Gualillo O, Caminos J, Blanco M, Garcia-Caballero T, Kojima M, Kangawa K, Dieguez C, Casanueva F. Ghrelin, a novel placental-derived hormone. Endocrinology. 2001;142:788-794. [PubMed] |
| 4. | Guan XM, Yu H, Palyha OC, McKee KK, Feighner SD, Sirinathsinghji DJ, Smith RG, Van der Ploeg LH, Howard AD. Distribution of mRNA encoding the growth hormone secretagogue receptor in brain and peripheral tissues. BrainRes Mol Br. ain Res. 1997;48:23-29. [PubMed] |
| 5. | Bagnol D. G protein-coupled receptors in hypothalamic circuits involved in metabolic diseases. Curr OpinDrug Discov De. vel. 2004;7:665-682. [PubMed] |
| 6. | Cassoni P, Papotti M, Ghe C, Catapano F, Sapino A, Graziani A, Deghenghi R, Reissmann T, Ghigo E, Muccioli G. Identification, characterization, and biological activity of specific receptors for natural (ghrelin) and synthetic growth hormone secretagogues and analogs in human breast carcinomas and cell lines. J Clin Endocrinol Metab. 2001;86:1738-1745. [PubMed] |
| 7. | Smith RG, Van der Ploeg LH, Howard AD, Feighner SD, Cheng K, Hickey GJ, Wyvratt MJ Jr, Fisher MH, Nargund RP, Patchett AA. Peptidomimetic regulation of growth hormone secretion. Endocr Rev. 1997;18:621-645. [PubMed] |
| 8. | Peeters TL. Ghrelin: a new player in the control of gastrointestinal functions. Gut. 2005;54:1638-1649. [PubMed] |
| 9. | McKee KK, Palyha OC, Feighner SD, Hreniuk DL, Tan CP, Phillips MS, Smith RG, Van der Ploeg LH, Howard AD. Molecular analysis of rat pituitary and hypothalamic growth hormone secretagogue receptors. Mol Endocrinol. 1997;11:415-423. [PubMed] |
| 10. | Gourcerol G, Million M, Adelson DW, Wang Y, Wang L, Rivier J, St-Pierre DH, Tache Y. Lack of interaction between peripheral injection of CCK and obestatin in the regulation of gastric satiety signaling in rodents. Peptides. 2006;27:2811-2819. [PubMed] |
| 11. | Holst B, Egerod KL, Schild E, Vickers SP, Cheetham S, Gerlach LO, Storjohann L, Stidsen CE, Jones R, Beck-Sickinger AG. GPR39 signaling is stimulated by zinc ions but not by obestatin. Endocrinology. 2007;148:13-20. [PubMed] |
| 12. | Nogueiras R, Pfluger P, Tovar S, Arnold M, Mitchell S, Morris A, Perez-Tilve D, Vazquez MJ, Wiedmer P, Castaneda TR. Effects of obestatin on energy balance and growth hormone secretion in rodents. Endocrinology. 2007;148:21-26. [PubMed] |
| 13. | Tremblay F, Perreault M, Klaman LD, Tobin JF, Smith E, Gimeno RE. Normal food intake and body weight in mice lacking the G protein-coupled receptor GPR39. Endocrinology. 2007;148:501-506. [PubMed] |
| 14. | Yamamoto D, Ikeshita N, Daito R, Herningtyas EH, Toda K, Takahashi K, Iida K, Takahashi Y, Kaji H, Chihara K. Neither intravenous nor intracerebroventricular administration of obestatin affects the secretion of GH, PRL, TSH and ACTH in rats. Regul Pept. 2007;138:141-144. [PubMed] |
| 15. | Zizzari P, Longchamps R, Epelbaum J, Bluet-Pajot MT. Obestatin partially affects ghrelin stimulation of food intake and growth hormone secretion in rodents. Endocrinology. 2007;148:1648-1653. [PubMed] |
| 16. | Lagaud GJ, Young A, Acena A, Morton MF, Barrett TD, Shankley NP. Obestatin reduces food intake and suppresses body weight gain in rodents. Biochem Biophys Res Commun. 2007;357:264-269. [PubMed] |
| 17. | Carlini VP, Schioth HB, Debarioglio SR. Obestatin improves memory performance and causes anxiolytic effects in rats. Biochem Biophys Res Commun. 2007;352:907-912. [PubMed] |
| 18. | Samson WK, White MM, Price C, Ferguson AV. Obestatin acts in brain to inhibit thirst. Am J Physiol RegulIntegr Comp Ph. ysiol. 2007;292:R637-R643. [PubMed] |
| 19. | Szentirmai E, Krueger JM. Obestatin alters sleep in rats. Neurosci Lett. 2006;404:222-226. [PubMed] |
| 20. | Camina JP, Campos JF, Caminos JE, Dieguez C, Casanueva FF. Obestatin-mediated proliferation of human retinal pigment epithelial cells: regulatory mechanisms. J Cell Physiol. 2007;211:1-9. [PubMed] |
| 21. | Meszarosova M, Sirotkin AV, Grossmann R, Darlak K, Valenzuela F. The effect of obestatin on porcine ovarian granulosa cells. Anim Reprod Sci. 2007;. [PubMed] |
| 22. | Nakazato M, Murakami N, Date Y, Kojima M, Matsuo H, Kangawa K, Matsukura S. A role for ghrelin in the central regulation of feeding. Nature. 2001;409:194-198. [PubMed] |
| 23. | Tschop M, Smiley DL, Heiman ML. Ghrelin induces adiposity in rodents. Nature. 2000;407:908-913. [PubMed] |
| 24. | Wren AM, Small CJ, Ward HL, Murphy KG, Dakin CL, Taheri S, Kennedy AR, Roberts GH, Morgan DG, Ghatei MA. The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion. Endocrinology. 2000;141:4325-4328. [PubMed] |
| 25. | Toshinai K, Mondal MS, Nakazato M, Date Y, Murakami N, Kojima M, Kangawa K, Matsukura S. Upregulation of Ghrelin expression in the stomach upon fasting, insulin-induced hypoglycemia, and leptin administration. BiochemBiophys Res Co. mmun. 2001;281:1220-1225. [PubMed] |
| 26. | Takaya K, Ariyasu H, Kanamoto N, Iwakura H, Yoshimoto A, Harada M, Mori K, Komatsu Y, Usui T, Shimatsu A. Ghrelin strongly stimulates growth hormone release in humans. J Clin Endocrinol Metab. 2000;85:4908-4911. [PubMed] |
| 27. | Wren AM, Seal LJ, Cohen MA, Brynes AE, Frost GS, Murphy KG, Dhillo WS, Ghatei MA, Bloom SR. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab. 2001;86:5992. [PubMed] |
| 28. | Shintani M, Ogawa Y, Ebihara K, Aizawa-Abe M, Miyanaga F, Takaya K, Hayashi T, Inoue G, Hosoda K, Kojima M. Ghrelin, an endogenous growth hormone secretagogue, is a novel orexigenic peptide that antagonizes leptin action through the activation of hypothalamic neuropeptide Y/Y1 receptor pathway. Diabetes. 2001;50:227-232. [PubMed] |
| 29. | Kojima M, Kangawa K. Ghrelin, an orexigenic signaling molecule from the gastrointestinal tract. Curr Opin Pharmacol. 2002;2:665-668. [PubMed] |
| 30. | Furuse M, Tachibana T, Ohgushi A, Ando R, Yoshimatsu T, Denbow DM. Intracerebroventricular injection of ghrelin and growth hormone releasing factor inhibits food intake in neonatal chicks. Neurosci Lett. 2001;301:123-126. [PubMed] |
| 31. | Masuda Y, Tanaka T, Inomata N, Ohnuma N, Tanaka S, Itoh Z, Hosoda H, Kojima M, Kangawa K. Ghrelin stimulates gastric acid secretion and motility in rats. Biochem Biophys Res Commun. 2000;276:905-908. [PubMed] |
| 32. | Wren AM, Small CJ, Fribbens CV, Neary NM, Ward HL, Seal LJ, Ghatei MA, Bloom SR. The hypothalamic mechanisms of the hypophysiotropic action of ghrelin. Neuroendocrinology. 2002;76:316-324. [PubMed] |
| 33. | Tena-Sempere M, Barreiro ML, Gonzalez LC, Gaytan F, Zhang FP, Caminos JE, Pinilla L, Casanueva FF, Dieguez C, Aguilar E. Novel expression and functional role of ghrelin in rat testis. Endocrinology. 2002;143:717-725. [PubMed] |
| 34. | Date Y, Nakazato M, Murakami N, Kojima M, Kangawa K, Matsukura S. Ghrelin acts in the central nervous system to stimulate gastric acid secretion. Biochem Biophys Res Commun. 2001;280:904-907. [PubMed] |
| 35. | Sibilia V, Pagani F, Guidobono F, Locatelli V, Torsello A, Deghenghi R, Netti C. Evidence for a central inhibitory role of growth hormone secretagogues and ghrelin on gastric acid secretion in conscious rats. Neuroendocrinology. 2002;75:92-97. [PubMed] |
| 36. | Asakawa A, Inui A, Kaga T, Yuzuriha H, Nagata T, Ueno N, Makino S, Fujimiya M, Niijima A, Fujino MA. Ghrelin is an appetite-stimulatory signal from stomach with structural resemblance to motilin. Gastroenterology. 2001;120:337-345. [PubMed] |
| 37. | Date Y, Murakami N, Toshinai K, Matsukura S, Niijima A, Matsuo H, Kangawa K, Nakazato M. The role of the gastric afferent vagal nerve in ghrelin-induced feeding and growth hormone secretion in rats. Gastroenterology. 2002;123:1120-1128. [PubMed] |
| 38. | Nagaya N, Uematsu M, Kojima M, Date Y, Nakazato M, Okumura H, Hosoda H, Shimizu W, Yamagishi M, Oya H. Elevated circulating level of ghrelin in cachexia associated with chronic heart failure: relationships between ghrelin and anabolic/catabolic factors. Circulation. 2001;104:2034-2038. [PubMed] |
| 39. | Nagaya N, Miyatake K, Uematsu M, Oya H, Shimizu W, Hosoda H, Kojima M, Nakanishi N, Mori H, Kangawa K. Hemodynamic, renal, and hormonal effects of ghrelin infusion in patients with chronic heart failure. JClin Endocrinol Me. tab. 2001;86:5854-5859. [PubMed] |
| 40. | Nagaya N, Kojima M, Uematsu M, Yamagishi M, Hosoda H, Oya H, Hayashi Y, Kangawa K. Hemodynamic and hormonal effects of human ghrelin in healthy volunteers. Am J Physiol Regul Integr Comp Physiol. 2001;280:R1483-R1487. [PubMed] |
| 41. | Nagaya N, Uematsu M, Kojima M, Ikeda Y, Yoshihara F, Shimizu W, Hosoda H, Hirota Y, Ishida H, Mori H. Chronic administration of ghrelin improves left ventricular dysfunction and attenuates development of cardiac cachexia in rats with heart failure. Circulation. 2001;104:1430-1435. [PubMed] |
| 42. | Howard AD, Feighner SD, Cully DF, Arena JP, Liberator PA, Rosenblum CI, Hamelin M, Hreniuk DL, Palyha OC, Anderson J. A receptor in pituitary and hypothalamus that functions in growth hormone release. Science. 1996;273:974-977. [PubMed] |
| 43. | Dixit VD, Schaffer EM, Pyle RS, Collins GD, Sakthivel SK, Palaniappan R, Lillard JW Jr, Taub DD. Ghrelin inhibits leptin-and activation-induced proinflammatory cytokine expression by human monocytes and T cells. J Clin Invest. 2004;114:57-66. [PubMed] |
| 44. | Murata M, Okimura Y, Iida K, Matsumoto M, Sowa H, Kaji H, Kojima M, Kangawa K, Chihara K. Ghrelin modulates the downstream molecules of insulin signaling in hepatoma cells. J Biol Chem. 2002;277:5667-5674. [PubMed] |
| 45. | Soriano-Guillen L, Barrios V, Campos-Barros A, Argente J. Ghrelin levels in obesity and anorexia nervosa: effect of weight reduction or recuperation. J Pediatr. 2004;144:36-42. [PubMed] |
| 46. | Caminos JE, Seoane LM, Tovar SA, Casanueva FF, Dieguez C. Influence of thyroid status and growth hormone deficiency on ghrelin. Eur J Endocrinol. 2002;147:159-163. [PubMed] |
| 47. | Cummings DE, Weigle DS, Frayo RS, Breen PA, Ma MK, Dellinger EP, Purnell JQ. Plasma ghrelin levels after diet-induced weight loss or gastric bypass surgery. N Engl J Med. 2002;346:1623-1630. [PubMed] |
| 48. | Broglio F, Arvat E, Benso A, Gottero C, Muccioli G, Papotti M, van der Lely AJ, Deghenghi R, Ghigo E. Ghrelin, a natural GH secretagogue produced by the stomach, induces hyperglycemia and reduces insulin secretion in humans. J Clin Endocrinol Metab. 2001;86:5083-5086. [PubMed] |
| 49. | Date Y, Nakazato M, Hashiguchi S, Dezaki K, Mondal MS, Hosoda H, Kojima M, Kangawa K, Arima T, Matsuo H. Ghrelin is present in pancreatic alpha-cells of humans and rats and stimulates insulin secretion. Diabetes. 2002;51:124-129. [PubMed] |
| 50. | Prado CL, Pugh-Bernard AE, Elghazi L, Sosa-Pineda B, Sussel L. Ghrelin cells replace insulin-producing beta cells in two mouse models of pancreas development. Proc Natl Acad Sci U S A. 2004;101:2924-2929. [PubMed] |
| 51. | Gnanapavan S, Kola B, Bustin SA, Morris DG, McGee P, Fairclough P, Bhattacharya S, Carpenter R, Grossman AB, Korbonits M. The tissue distribution of the mRNA of ghrelin and subtypes of its receptor, GHS-R, in humans. J Clin Endocrinol Metab. 2002;87:2988. [PubMed] |
| 52. | Shuto Y, Shibasaki T, Otagiri A, Kuriyama H, Ohata H, Tamura H, Kamegai J, Sugihara H, Oikawa S, Wakabayashi I. Hypothalamic growth hormone secretagogue receptor regulates growth hormone secretion, feeding, and adiposity. J Clin Invest. 2002;109:1429-1436. [PubMed] |
| 53. | Tschop M, Statnick MA, Suter TM, Heiman ML. GH-releasing peptide-2 increases fat mass in mice lacking NPY: indication for a crucial mediating role of hypothalamic agouti-related protein. Endocrinology. 2002;143:558-568. [PubMed] |
| 54. | Ishii S, Kamegai J, Tamura H, Shimizu T, Sugihara H, Oikawa S. Role of ghrelin in streptozotocin-induced diabetic hyperphagia. Endocrinology. 2002;143:4934-4937. [PubMed] |
| 55. | Kamegai J, Tamura H, Shimizu T, Ishii S, Sugihara H, Wakabayashi I. Central effect of ghrelin, an endogenous growth hormone secretagogue, on hypothalamic peptide gene expression. Endocrinology. 2000;141:4797-4800. [PubMed] |
| 56. | van der Lely AJ, Tschop M, Heiman ML, Ghigo E. Biological, physiological, pathophysiological, and pharmacological aspects of ghrelin. Endocr Rev. 2004;25:426-457. [PubMed] |
| 57. | Tena-Sempere M, Barreiro ML, Gonzalez LC, Gaytan F, Zhang FP, Caminos JE, Pinilla L, Casanueva FF, Dieguez C, Aguilar E. Novel expression and functional role of ghrelin in rat testis. Endocrinology. 2002;143:717-725. [PubMed] |
| 58. | Furuta M, Funabashi T, Kimura F. Intracerebroven-tricular administration of ghrelin rapidly suppresses pulsatile luteinizing hormone secretion in ovariectomized rats. Biochem Biophys Res Commun. 2001;288:780-785. [PubMed] |
| 59. | Tolle V, Bassant MH, Zizzari P, Poindessous-Jazat F, Tomasetto C, Epelbaum J, Bluet-Pajot MT. Ultradian rhythmicity of ghrelin secretion in relation with GH, feeding behavior, and sleep-wake patterns in rats. Endocrinology. 2002;143:1353-1361. [PubMed] |
| 60. | Volante M, Allia E, Fulcheri E, Cassoni P, Ghigo E, Muccioli G, Papotti M. Ghrelin in fetal thyroid and follicular tumors and cell lines: expression and effects on tumor growth. Am J Pathol. 2003;162:645-654. [PubMed] |
| 61. | Shimizu Y, Nagaya N, Isobe T, Imazu M, Okumura H, Hosoda H, Kojima M, Kangawa K, Kohno N. Increased plasma ghrelin level in lung cancer cachexia. Clin Cancer Res. 2003;9:774-778. [PubMed] |
| 62. | Carlini VP, Varas MM, Cragnolini AB, Schioth HB, Scimonelli TN, de Barioglio SR. Differential role of the hippocampus, amygdala, and dorsal raphe nucleus in regulating feeding, memory, and anxiety-like behavioral responses to ghrelin. Biochem Biophys Res Commun. 2004;313:635-641. [PubMed] |
| 63. | Ishizaki S, Murase T, Sugimura Y, Kakiya S, Yokoi H, Tachikawa K, Arima H, Miura Y, Oiso Y. Role of ghrelin in the regulation of vasopressin release in conscious rats. Endocrinology. 2002;143:1589-1593. [PubMed] |
| 64. | Barreiro ML, Pinilla L, Aguilar E, Tena-Sempere M. Expression and homologous regulation of GH secretagogue receptor mRNA in rat adrenal gland. Eur J Endocrinol. 2002;147:677-688. [PubMed] |
| 65. | Szentirmai E, Krueger JM. Obestatin alters sleep in rats. Neurosci Lett. 2006;404:222-226. [PubMed] |