修回日期: 2007-10-10
接受日期: 2007-10-28
在线出版日期: 2007-11-08
目的: 检测肝癌组织中14-3-3基因家族成员表达差异的临床意义.
方法: 用TRIzol一步法提取肝癌组织、硬化肝组织及正常肝组织的总RNA并纯化mRNA. 逆转录合成荧光分子(Cy3/Cy5)标记的cDNA探针与含有14-3-3基因家族成员的基因芯片杂交, 用GenePix Pro3.0图像分析软件分析不同病变肝组织中该基因家族成员的表达差异, 行半定量RT-PCR对结果进行验证并探讨差异表达基因的临床意义.
结果: 在肝癌组织中14-3-3基因家族成员呈差异表达, 其中14-3-3γ在肝癌组织中明显下调, 与肿瘤包膜的完整性相关. 14-3-3η在肝癌组织中明显上调, 与肿瘤患者的临床分期相关. 14-3-3γ与14-3-3η mRNA的表达强度呈负相关(r = -0.403, P<0.05).
结论: 14-3-3基因家族调控机制的紊乱参与肝癌的发生、发展, 其中14-3-3γ和14-3-3η与肝癌的关系最为密切.
引文著录: 刘娟, 姚树坤, 殷飞. 肝癌组织中14-3-3基因差异表达的意义. 世界华人消化杂志 2007; 15(31): 3299-3304
Revised: October 10, 2007
Accepted: October 28, 2007
Published online: November 8, 2007
AIM: To detect the expression of 14-3-3 gene family members in hepatocellular carcinoma (HCC) by GeneChip and determine its clinical significance.
METHODS: Total RNA was isolated from tissue of HCC, liver cirrhosis and normal liver, purified into mRNA by Oligotex, and reverse-transcribed to synthesize two kinds of fluorescently labeled cDNA probes (Cy3-dUTP, Cy5-dUTP). The targets were mixed together and hybridized by GeneChip. The expression of 14-3-3 gene family members among different liver tissues was detected based on signal-to-noise ratios by using GenePix Pro3.0 software, the outcome was verified by semi-quantitative RT-PCR, and the clinical significance of differentially expressed genes was explored.
RESULTS: 14-3-3 gene family members were expressed differently in HCC, 14-3-3γ was down-regulated and closely related to the integrity of the envelope of the tumor. 14-3-3η was up-regulated in HCC and had a close relationship to the clinical stage of HCC. A negative correlation was found between 14-3-3γ and 14-3-3η mRNA expression (r = -0.403, P < 0.05).
CONCLUSION: Dysfunction of the regulatory mechanism of the 14-3-3 gene family may play a crucial role in the development of HCC. 14-3-3γ and 14-3-3η are closely related to HCC.
- Citation: Liu J, Yao SK, Yin F. Significance of differentially expressed gene 14-3-3 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3299-3304
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3299.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3299
14-3-3是一个高度保守的基因家族, 普遍存在于真核细胞, 参与细胞许多重要的生理过程, 并在其中起至关重要的作用, 如细胞信号转导、细胞周期调控、细胞凋亡、恶性肿瘤的形成等[1]. 14-3-3在肿瘤组织中的表达情况及与肿瘤间的关系已受到极大的关注. 国外研究发现14-3-3基因家族成员在肺癌[2]、乳腺癌[3]等肿瘤组织中异常表达, 认为14-3-3调节失控在肿瘤的发生、发展中发挥重要的作用. 我们用基因芯片技术比较了14-3-3基因家族成员在肝癌、肝硬化和正常肝组织中的表达情况, 筛选出与肝癌发生、发展密切相关的基因, 为肝癌的诊断和治疗提供一个新的靶点.
单发无转移的原发性肝细胞癌(HCC)标本4例(表1), 肝硬化标本1例, 肝血管瘤周边正常肝组织标本1例, 均为河北医科大学第四医院肝胆外科手术切除, 并经病理学检查证实. 手术切除后迅速液氮冷冻, 置于-80℃超低温冰箱中保存. 所用芯片为上海博星基因芯片公司提供的人表达谱芯片BiostarH40s. 另对HCC组织19例(表2), 癌旁硬化肝组织11例及肝血管瘤周边正常肝组织7例(术前均未进行任何形式的治疗)作半定量RT-PCR.
| No. | 年龄 | HBsAg | HBeAg | HBeAb | HBcAb | AFP(μg/L) | 肿瘤大小(cm) | 肿瘤分化 |
| 1 | 57 | (+) | (-) | (-) | (+) | 1647 | 20×20 | 低 |
| 2 | 48 | (+) | (-) | (-) | (+) | 3000 | 8×7 | 低 |
| 3 | 56 | (+) | (-) | (-) | (+) | 1800 | 8×7×5 | 中度 |
| 4 | 35 | (+) | (-) | (+) | (+) | 3000 | 10×6 | 低 |
| No. | 年龄 | 性别 | HBV | HCV | AFP(μg/L) | 肿瘤大小(cm) | 包膜 | 癌栓 | 播散灶 | 病理诊断 |
| 1 | 57 | 男 | (+) | (-) | 1647 | 20×20 | 无 | 有 | 无 | HCC, III |
| 2 | 49 | 男 | (+) | (-) | 3.44 | 8×6 | 完整 | 无 | 无 | HCC, II |
| 3 | 48 | 男 | (+) | (-) | 3000 | 8×7 | 部分 | 有 | 无 | HCC, III |
| 4 | 58 | 男 | (+) | (-) | 3000 | 20×10×10 | 无 | 有 | 有 | HCC, II |
| 5 | 56 | 男 | (+) | (-) | 1800 | 8×7×5 | 完整 | 无 | 有 | HCC, II |
| 6 | 63 | 男 | (+) | (-) | 164.8 | 7×5×5 | 完整 | 无 | 无 | HCC, III |
| 7 | 53 | 男 | (+) | (-) | 397.9 | 12×15 | 部分 | 无 | 有 | HCC, III |
| 8 | 71 | 男 | (+) | (-) | 9.37 | 13×10 | 部分 | 无 | 无 | HCC, III |
| 9 | 50 | 男 | (-) | (-) | 974.9 | 15×10×10 | 无 | 有 | 无 | HCC, IV |
| 10 | 50 | 男 | (+) | (-) | 3000 | 20×20 | 无 | 有 | 无 | HCC, II |
| 11 | 60 | 女 | (+) | (-) | 195.1 | 6×5×5 | 部分 | 有 | 无 | HCC, III |
| 12 | 37 | 男 | (+) | (-) | 408 | 5×5 | 完整 | 无 | 无 | HCC, II |
| 13 | 47 | 女 | (+) | (-) | 1522.1 | 10×10 | 部分 | 无 | 无 | HCC, III |
| 14 | 49 | 男 | (+) | (-) | 3000 | 4×4×4 | 完整 | 无 | 多发 | HCC, III |
| 15 | 49 | 女 | (+) | (-) | 40.63 | 4×5×4 | 部分 | 无 | 有 | HCC, IV |
| 16 | 66 | 男 | (+) | (-) | 1144 | 8×6×6 | 完整 | 无 | 无 | HCC, II |
| 17 | 60 | 男 | (+) | (-) | 1389 | 10×6×6 | 完整 | 无 | 无 | HCC, III |
| 18 | 63 | 男 | (+) | (-) | 3000 | 10×10 | 部分 | 无 | 有 | HCC, II |
| 19 | 35 | 男 | (+) | (-) | 3000 | 10×10 | 部分 | 无 | 有 | HCC, III |
1.2.1 芯片流程: 按RNA抽提步骤用TRIzol试剂抽提HCC、肝硬化及正常肝组织的总RNA, 分离纯化mRNA, 紫外分光光度计测定和电泳分析总RNA和mRNA的质量. 基因芯片的杂交步骤按博星实验室表达谱芯片实验操作流程进行, 用Cy3-dUTP标记正常肝组织mRNA, 用Cy5-dUTP分别标记HCC和肝硬化组织mRNA, 逆转录成cDNA探针, 乙醇沉淀后将标记的两种探针混合溶解在杂交液中, 置于95℃水浴中变性2 min. 芯片置于95℃水浴中变性30 s, 取出后浸无水乙醇30 s, 取出后立即置于冰上, 将探针置于芯片上, 用盖玻片覆盖, 置于杂交箱中, 用Parafilm密封, 放入42℃杂交箱内杂交过夜(16-18 h), 洗片室温凉干后, 用ScanArray4000扫描仪扫描芯片, 用GenePix Pro3.0软件分析Cy3和Cy5两种荧光信号的强度和比值. 对原始数据进行标准化处理. 基因显著性差异表达的判定标准为: (1)该基因点的Cy3, Cy5信号值皆大于200, 或其中之一大于800; (2)该基因点的Cy5信号值/Cy3信号值的比值>2或<0.5.
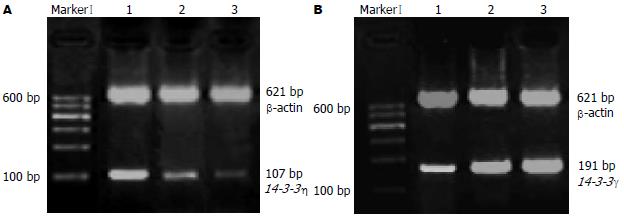
1.2.2 半定量RT-PCR: 将RNA逆转录合成cDNA. PCR扩增, 引物序列为: 内参β-actin: F: 5'-A CACTGTGCCCATCTACGAGG-3'; R: 5'-CATACTGCTCAGGCCGGGGA-3', 片段长度为621 bp. 14-3-3γ: F: 5'-GGCTAAATGAGAATG AAAGCGACT-3'; R: CGATCCATGACATACAGACCTGA-3', 片段长度为191 bp. 14-3-3η: F: 5'-AGAAGATTGAGAAGGAGCTGGAGA-3', R: 5'-AAACACCTTGCTCTCATACTGGAAA-3', 片段长度为107 bp. PCR反应条件: 95℃预变性5 min, 95℃变性30 s, 50-56℃复性30 s, 循环30-35个周期, 最后72℃延伸5 min. PCR反应时同时扩增β-actin作为内参照, 复性温度及循环次数根据不同引物及模板进行调整. 25 g/L琼脂糖凝胶电泳检测并进行灰度扫描成像. 用目的基因和内参基因两电泳条带的单位面积内的灰度比值来反映目的基因的相对表达水平, 计算公式为: 目的基因相对表达水平 = (目的基因灰度值-背景灰度值)/(内参基因灰度值-背景灰度值).
统计学处理 对半定量RT-PCR结果应用SPSS11.5软件统计, 两两比较用t检验, 多组比较采用单因素方差分析, 两因素的相关分析用直线相关分析(Pearson相关系数). P<0.05为差异具有统计学意义.
电泳18S, 28S条带清晰, 且28S带的宽度和亮度是18S的2倍(图1), A260/A280在1.7-2.2之间, 显示得到了高质量的总RNA.
各组扫描结果经计算机数据叠加后产生的图像, 绿色代表该基因与正常肝组织相比较下调, 红色代表上调, 黄色代表表达丰度相似(图2). 14-3-3基因家族成员在HCC组织中的差异表达, 其中14-3-3γ在HCC组织中均明显下调, 14-3-3η在HCC组织中均明显上调(表3, 图2).
| 全称 | 基因 ID | 肝癌 | |||||
| 1 | 2 | 3 | 4 | ||||
| 下调基因 | |||||||
| 14-3-3γ | Tyrosine 3-monooxygenase/tryptophan-5-Monooxygenase activation protein, gamma polypeptide | Hs.520974 | 0.08 | 0.21 | 0.48 | 0.41 | |
| 上调基因 | |||||||
| 14-3-3η | yrosine 3-monooxygenase/tryptophan-5- Monooxygenase activation protein, eta polypeptide | Hs.226755 | 3.15 | 3.20 | 2.82 | 3.51 | |
| 其他基因 | |||||||
| 14-3-3τ | Tyrosine 3-monooxygenase/tryptophan-5- Monooxygenase activation protein, theta polypeptide | Hs.74405 | 0.63 | 0.98 | 1.04 | 1.05 | |
| 14-3-3ζ | Tyrosine 3-monooxygenase/tryptophan-5- Monooxygenase activation protein, zeta polypeptide | Hs.492407 | 2.62 | 1.99 | 3.25 | 1.14 | |
| 14-3-3β | Tyrosine 3-monooxygenase/tryptophan-5- Monooxygenase activation protein, beta polypeptide | Hs.592135 | 0.89 | 1.01 | 1.98 | 2.11 | |
| 14-3-3ε | Tyrosine 3-monooxygenase/tryptophan-5- Monooxygenase activation protein, epsilon polypeptide | Hs.513851 | 0.38 | 1.31 | 0.52 | 0.78 | |
| 14-3-3σ | Stratifin | Hs.523718 | 1.29 | 2.33 | 0.95 | 1.67 | |
HCC组织中14-3-3γ mRNA的表达显著低于癌旁硬化组织和正常肝组织(P<0.01), HCC组织中14-3-3η mRNA的表达显著高于癌旁硬化肝组织和正常肝组织(P<0.05, 表4). 并且, 14-3-3γ mRNA的表达水平在包膜不完整的癌组织中要显著低于包膜完整的癌组织(P<0.05), 而14-3-3η mRNA在临床分期越晚的HCC患者中的表达水平显著升高(P<0.05, 表5, 图3A-B). HCC组织中14-3-3γ与14-3-3η mRNA的表达强度呈负相关(r = -0.403, P<0.05).
| 临床参数 | n | 14-3-3γ mRNA | 14-3-3η mRNA |
| 年龄(岁) | |||
| ≥50 | 12 | 0.725±0.100 | 0.544±0.084 |
| <50 | 7 | 0.674±0.235 | 0.615±0.164 |
| 性别 | |||
| 男 | 16 | 0.725±0.147 | 0.569±0.113 |
| 女 | 3 | 0.608±0.219 | 0.576±0.189 |
| 肿瘤直径(cm) | |||
| <5 | 17 | 0.800±0.014 | 0.444±0.100 |
| ≥5 | 2 | 0.695±0.165 | 0.585±0.116 |
| 癌灶个数 | |||
| 1 | 12 | 0.742±0.149 | 0.583±0.093 |
| ≥2 | 7 | 0.645±0.168 | 0.548±0.165 |
| 门脉瘤栓 | |||
| 无 | 13 | 0.701±0.186 | 0.589±0.132 |
| 有 | 6 | 0.718±0.088 | 0.530±0.088 |
| AFP(μg/L) | |||
| <400 | 6 | 0.763±0.101 | 0.573±0.132 |
| ≥400 | 13 | 0.680±0.177 | 0.563±0.102 |
| 包膜 | |||
| 无 | 4 | 0.725±0.106 | 0.515±0.102 |
| 不完整 | 8 | 0.622±0.189a | 0.606±0.149 |
| 完整 | 7 | 0.793±0.099 | 0.561±0.094 |
| 病理分级 | |||
| II | 7 | 0.734±0.098 | 0.553±0.120 |
| III | 10 | 0.667±0.198 | 0.606±0.115 |
| IV | 2 | 0.816±0.022 | 0.449±0.108 |
| 临床分期 | |||
| I+II | 10 | 0.683±0.204 | 0.503±0.086a |
| III | 9 | 0.732±0.093 | 0.630±0.119 |
14-3-3广泛分布于真核生物细胞中, Mr 30×103, 共有7种(β, γ, ε, ζ, η, σ和τ)亚型, 主要以同源或异源二聚体的形式存在. 他们的组织分布具有很大的差异, 14-3-3β, γ在脑组织中表达广泛, 14-3-3τ主要表达在T细胞和睾丸, 14-3-3σ则主要表达于上皮细胞中. 不同类型的14-3-3在不同组织或细胞中表达的差异提示不同的14-3-3同工蛋白可能具有其独特的作用[4-5]. 已经证实, 有200种蛋白与14-3-3蛋白有关联, 14-3-3蛋白与靶蛋白结合后改变靶蛋白的催化活性、细胞定位以及对蛋白酶和磷酸酶的敏感性[6], 而这些靶蛋白的功能涉及到细胞周期调控、细胞内信号传导, 应激反应、凋亡、转录调节、细胞代谢和细胞骨架的完整等诸多方面. 由于14-3-3蛋白在细胞生理功能中发挥着如此重要的作用, 并且能够结合和调节所有与癌症发生进程有关的蛋白[7-12], 如Raf, Bcr, p53, p130Cas, p27和Ron等. 其在肿瘤发生、发展中所起的作用日益受到重视, 人们已经将其定义为潜在的致癌基因[13], 进而研究其在肿瘤组织中的表达情况, 以期为肿瘤诊断和治疗提供新的帮助. 已有研究发现在多种肿瘤细胞中14-3-3σ基因的"CpG岛"发生高频率的甲基化, 使14-3-3σ基因沉默或低表达, 从而引起G2期检控点损伤, 导致基因缺陷积累, 细胞发生恶性转化[14-15]. Qi et al[2,16]研究发现, 肺癌组织中14-3-3β、14-3-3γ、14-3-3σ和14-3-3θ基因的表达均明显上调, 并且抑制14-3-3ζ的表达能增强肿瘤对放疗的敏感性, 认为可以将14-3-3蛋白作为肺癌的诊断标志物和治疗的靶点.
到目前为止, 有关14-3-3基因家族成员在各种肝组织中的分布情况以及与HCC之间关系尚无系统的研究. 我们利用基因芯片技术一次性平行比较了14-3-3基因家族成员在不同肝组织中的表达情况, 首次发现, 14-3-3基因家族成员在HCC组织中差异表达, 而在硬化肝组织和正常肝组织间的表达无显著差别. 在诸多成员中, 14-3-3γ基因在HCC组织中的表达较正常肝组织及硬化肝组织明显降低, 14-3-3η基因在肝癌组织中的表达则明显上调, 其余14-3-3基因成员在各种肝组织中的表达无明显差别, 提示14-3-3基因家族调控机制的紊乱在HCC的发生, 发展中发挥重要的作用, 其中14-3-3γ和14-3-3η与HCC的关系最为密切. RT-PCR研究进一步发现, 包膜不完整的癌组织中14-3-3γ mRNA的表达水平显著低于包膜完整的癌组织, 提示14-3-3γ基因的失活可能增强HCC的侵袭性; 而14-3-3η mRNA在临床分期越晚的HCC患者中表达水平越高, 提示14-3-3η能够反映患者的临床进程. 已有研究表明, 14-3-3η基因在DNA损伤引发的细胞周期停滞中发挥重要的调节作用, 其编码产物14-3-3η与转录因子miz1结合后, 促使因DNA受损而引发细胞周期停滞的细胞重新进入增殖周期, 进而导致细胞的异常增殖、恶变[17]. 因此, 选择性的增强14-3-3γ基因的活性和抑制14-3-3η基因的过度活化能抑制因乙醇、病毒感染和各种理化因素引发的肝细胞损伤和过度增殖, 为HCC的治疗提供一个新的靶点. 而14-3-3基因在肝癌组织中的差异表达, 也使得14-3-3γ基因和14-3-3η基因有可能成为区分肝癌和其他肝组织、HCC和其他癌组织的标志物, 为HCC的诊断提供一个新的选择.
14-3-3是一个高度保守的基因家族, 普遍存在于真核细胞, 参与细胞许多重要的生理过程, 并在其中起至关重要的作用, 如细胞信号转导、细胞周期调控、细胞凋亡、恶性肿瘤的形成等. 近年来, 14-3-3在肿瘤组织中的表达情况及与肿瘤间的关系已受到极大的关注, 已有学者将其定义为潜在的致癌基因.
Qi et al研究发现14-3-3基因家族成员在肺癌、乳腺癌等肿瘤组织中异常表达, 认为14-3-3调节失控在肿瘤的发生、发展中发挥重要的作用. 有研究发现在多种肿瘤细胞中14-3-3σ基因的"CpG岛"发生高频率的甲基化, 使14-3-3σ 基因沉默或低表达, 从而引起G2期检控点损伤, 导致基因缺陷积累, 细胞发生恶性转化. Qi et al研究发现, 肺癌组织中14-3-3β、14-3-3γ、14-3-3σ和14-3-3θ基因的表达均明显上调, 并且抑制14-3-3ζ的表达能增强肿瘤对放疗的敏感性, 认为可以将14-3-3作为肺癌的诊断标志物和治疗的靶点.
到目前为止, 尚无有关14-3-3基因家族成员在各种肝组织中的分布情况以及与HCC之间关系的报道. 我们利用基因芯片技术一次性平行比较了14-3-3基因家族成员在不同肝组织中的表达情况, 筛选出与肝癌发生、发展密切相关的基因, 分析其与肝癌患者临床参数间的关系, 为肝癌的诊断和治疗提供一个新的靶点.
本文研究发现, 14-3-3基因家族调控机制的紊乱参与了肝癌的发生、发展, 其中14-3-3γ和14-3-3η与肝癌的关系最为密切. 选择性的增强14-3-3γ基因的表达和抑制14-3-3η基因的过度活化能够抑制因乙醇、病毒感染和各种理化因素引发的肝细胞损伤和过度增殖, 为HCC的治疗提供一个新的靶点, 而14-3-3基因在肝癌组织中的差异表达, 也使得14-3-3γ基因和14-3-3η基因有可能成为区分肝癌和其他肝组织、HCC和其他癌组织的标志物, 为HCC的诊断提供一个新的选择.
本文选题新颖, 语句通顺, 图表清晰, 对相关的基础研究有一定参考价值.
编辑: 程剑侠 电编:何基才
| 1. | Yaffe MB. How do 14-3-3 proteins work?-- Gatekeeper phosphorylation and the molecular anvil hypothesis. FEBS Lett. 2002;513:53-57. [PubMed] |
| 2. | Qi W, Liu X, Qiao D, Martinez JD. Isoform-specific expression of 14-3-3 proteins in human lung cancer tissues. Int J Cancer. 2005;113:359-363. [PubMed] |
| 3. | Urano T, Saito T, Tsukui T, Fujita M, Hosoi T, Muramatsu M, Ouchi Y, Inoue S. Efp targets 14-3-3 sigma for proteolysis and promotes breast tumour growth. Nature. 2002;417:871-875. [PubMed] |
| 4. | Fu H, Subramanian RR, Masters SC. 14-3-3 proteins: structure, function, and regulation. Annu Rev Pharmacol Toxicol. 2000;40:617-647. [PubMed] |
| 5. | Berg D, Holzmann C, Riess O. 14-3-3 proteins in the nervous system. Nat Rev Neurosci. 2003;4:752-762. [PubMed] |
| 6. | van Heusden GP. 14-3-3 proteins: regulators of numerous eukaryotic proteins. IUBMB Life. 2005;57:623-629. [PubMed] |
| 7. | Wilker E, Yaffe MB. 14-3-3 Proteins--a focus on cancer and human disease. J Mol Cell Cardiol. 2004;37:633-642. [PubMed] |
| 8. | Masters SC, Subramanian RR, Truong A, Yang H, Fujii K, Zhang H, Fu H. Survival-promoting functions of 14-3-3 proteins. Biochem Soc Trans. 2002;30:360-365. [PubMed] |
| 9. | Pendergast AM. Stress and death: breaking up the c-Abl/14-3-3 complex in apoptosis. Nat Cell Biol. 2005;7:213-214. [PubMed] |
| 10. | Okamoto K, Kashima K, Pereg Y, Ishida M, Yamazaki S, Nota A, Teunisse A, Migliorini D, Kitabayashi I, Marine JC. DNA damage-induced phosphorylation of MdmX at serine 367 activates p53 by targeting MdmX for Mdm2-dependent degradation. Mol Cell Biol. 2005;25:9608-9620. [PubMed] |
| 11. | Sekimoto T, Fukumoto M, Yoneda Y. 14-3-3 suppresses the nuclear localization of threonine 157-phosphorylated p27 (Kip1). EMBO J. 2004;23:1934-1942. [PubMed] |
| 12. | Briknarova K, Nasertorabi F, Havert ML, Eggleston E, Hoyt DW, Li C, Olson AJ, Vuori K, Ely KR. The serine-rich domain from Crk-associated substrate (p130cas) is a four-helix bundle. J Biol Chem. 2005;280:21908-21914. [PubMed] |
| 13. | Tzivion G, Gupta VS, Kaplun L, Balan V. 14-3-3 proteins as potential oncogenes. Semin Cancer Biol. 2006;16:203-213. [PubMed] |
| 14. | Hermeking H. The 14-3-3 cancer connection. Nat Rev Cancer. 2003;3:931-943. [PubMed] |
| 15. | Ferguson AT, Evron E, Umbricht CB, Pandita TK, Chan TA, Hermeking H, Marks JR, Lambers AR, Futreal PA, Stampfer MR. High frequency of hypermethylation at the 14-3-3 sigma locus leads to gene silencing in breast cancer. Proc Natl Acad Sci U S A. 2000;97:6049-6054. [PubMed] |
| 16. | Qi W, Martinez JD. Reduction of 14-3-3 proteins correlates with increased sensitivity to killing of human lung cancer cells by ionizing radiation. Radiat Res. 2003;160:217-223. [PubMed] |
| 17. | Wanzel M, Kleine-Kohlbrecher D, Herold S, Hock A, Berns K, Park J, Hemmings B, Eilers M. Akt and 14-3-3eta regulate Miz1 to control cell-cycle arrest after DNA damage. Nat Cell Biol. 2005;7:30-41. [PubMed] |