修回日期: 2007-09-27
接受日期: 2007-09-28
在线出版日期: 2007-11-08
目的: 研究老年胃癌患者的临床因素以及术后化疗对预后产生的影响.
方法: 对1997-01/2006-01我院收治的老年胃癌术后患者118例进行回顾性分析, 采用Kaplan-Meier和Cox回归分析评价性别、临床分期、组织学分化、浸润深度、淋巴结转移、远处转移、脉管癌栓、手术切除淋巴结数量、术后肿瘤残留及术后化疗等因素对预后的影响.
结果: 单因素分析显示临床分期、浸润深度、淋巴结转移、远处转移、术后化疗和肿瘤残留情况与预后明显相关(P<0.05). 多因素分析证实, 术后化疗、肿瘤残留情况及临床分期为预后的独立因素(P = 0.000, P = 0.000和P = 0.002).
结论: 术后化疗、肿瘤残留情况及临床分期是老年胃癌术后患者预后的独立危险因素, Ⅲ期及Ⅳ期老年患者接受术后化疗具有明显的生存优势, 但是, 术后化疗并未改善Ⅰ期及Ⅱ期老年患者的生存期.
引文著录: 张煜, 马力文, 梁莉. 老年胃癌术后患者118例的预后分析. 世界华人消化杂志 2007; 15(31): 3294-3298
Revised: September 27, 2007
Accepted: September 28, 2007
Published online: November 8, 2007
AIM: To study the relationship between clinical characteristics, postoperative chemotherapy and prognosis in elderly patients with gastric cancer.
METHODS: One hundred and eighteen elderly postoperative patients with gastric cancer were retrospectively analyzed from January 1997 to January 2006 in our hospitals, using Kaplan-Meier and Cox regression analysis to evaluate candidate prognosis factors, such as gender, clinical stage, differentiation, invasion depth, lymph node metastasis, distant metastasis, lymph-vascular space invasion, number of surgical resection lymph nodes, tumor residual and postoperative chemotherapy.
RESULTS: In univariate survival analysis, clinical stage, invasion depth, lymph node metastasis, distant metastasis, postoperative chemotherapy and tumor residual were obviously correlated with the prognosis (P < 0.05). In multivariable analysis, postoperative chemotherapy, tumor residual and clinical stage were confirmed to be independent factors (P = 0.000, P = 0.000 and P = 0.002).
CONCLUSION: Postoperative chemotherapy, tumor residual and clinical stage are independent prognostic factors in elderly postoperative gastric cancer patients, with stage Ⅲ and Ⅳ elderly patients that accept postoperative chemotherapy having an obvious survival advantage. However, postoperative chemotherapy does not improve survival in stage Ⅰ and Ⅱ elderly patients.
- Citation: Zhang Y, Ma LW, Liang L. Prognostic factors analysis of 118 elderly postoperative patients with gastric cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3294-3298
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3294.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3294
胃癌是我国最常见的恶性肿瘤之一, 居消化道肿瘤死亡原因的第一位, 具有发病率高, 早期诊断率低, 手术切除率低, 死亡率高等特点, 是严重危害人民健康的疾病. 文献报道胃癌预后主要与浸润深度、淋巴结转移、远处转移、病理类型及分化程度、手术方式和术后肿瘤残留情况等多种因素有关[1]. 该病多发于老年人, 胃癌发病率从40岁以后明显升高, 60岁以上是胃癌高发人群. 胃癌死亡率在30-59岁年龄组中呈下降趋势, 60岁以上年龄组呈上升趋势, 人口老化是胃癌死亡率上升的重要因素[2]. 因此进一步探讨老年胃癌的临床特点以及术后化疗的疗效具有重要意义.
1997-01/2006-01我院接受手术治疗的老年胃癌患者118例, 术后ECOG评分均为0-2分, 男97例, 女21例, 平均年龄71(65-86)岁. 全部病例均经病理证实为胃腺癌, 分期按照1997年UICC修订后的第5版TNM分期标准. 因为胃癌具有异质性, 同一胃癌患者的病理标本中可能含有多种成分, 如同时包括低分化腺癌及印戒细胞癌, 病理类型以该患者胃癌标本内分化最差的成分为准.
按照临床特点, 包括性别、临床分期、组织学分化、浸润深度、淋巴结转移、远处转移、脉管癌栓、手术切除淋巴结数量、术后肿瘤残留以及治疗情况(术后是否接受化疗)分组, 并对比分析其对生存期的影响. 随访时间1997-01/2007-04, 中位随访时间68.0(15-123) mo. 至随访结束时死亡68例, 存活50例.
统计学处理 采用SPSS13.0统计分析软件分析. 生存分析采用Kaplan-Meier和Cox回归分析, 生存率比较采用Log rank检验, P<0.05为有统计学意义.
共入选病例118例, 利用Kaplan-Meier计算总的中位生存期30.5 mo, 1年总生存率77.1%, 3年总生存率45.4%, 5年总生存率33.3%.
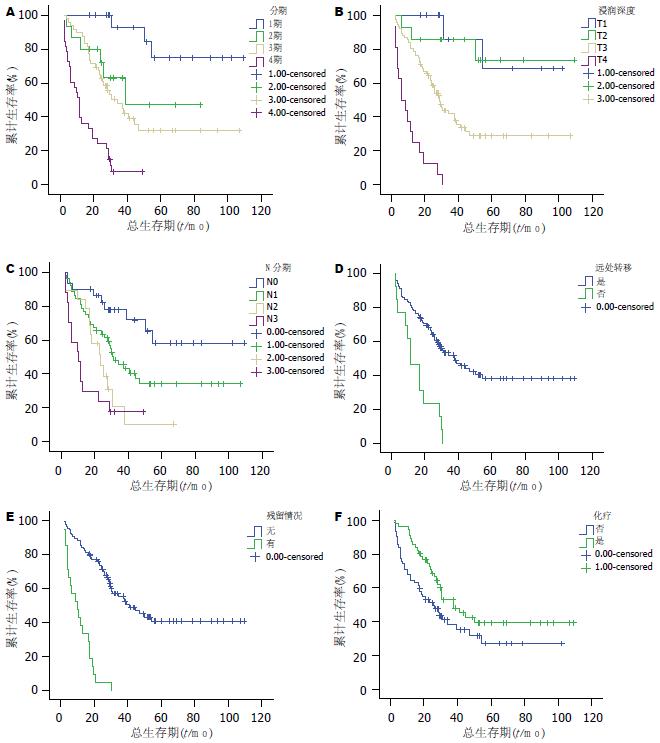
2.1.1 临床因素与预后的关系: 临床因素包括性别、临床分期、组织学分化、浸润深度、淋巴结转移、远处转移、脉管癌栓、手术切除淋巴结数量、术后肿瘤残留. Kaplan-Meier寿命表分析结果显示, 临床分期、浸润深度、淋巴结转移、远处转移、手术后肿瘤残留与生存期相关(P<0.05), 而其他因素与生存期无关(表1).
| 临床因素 | n | 1年生存率(%) | 3年生存率(%) | 5年生存率(%) | MST(mo) | P值 | |
| 性别 | 男 | 97 | 76.3 | 41.8 | 30.3 | 28.8 | 0.152 |
| 女 | 21 | 81.0 | 62.6 | 47.0 | 41.1 | ||
| 临床分期 | Ⅰ | 21 | 100 | 92.9 | 75.0 | ? | |
| Ⅱ | 15 | 86.7 | 63.0 | 47.3 | 39.2 | 0.000 | |
| Ⅲ | 49 | 89.8 | 47.7 | 32.0 | 34.3 | (图1A) | |
| Ⅳ | 33 | 39.4 | 7.6 | 0 | 11.5 | ||
| 组织学分化 | 印戒细胞癌 | 26 | 76.9 | 47.4 | 41.5 | 29.0 | 0.145 |
| 低分化腺癌 | 52 | 75.0 | 39.7 | 21.0 | 28.3 | ||
| 中分化腺癌 | 36 | 80.6 | 54.8 | 43.8 | 44.6 | ||
| 高分化腺癌 | 1 | ||||||
| 黏液腺癌 | 3 | ||||||
| 浸润深度 | T1 | 12 | 100 | 85.7 | 68.6 | ||
| T2 | 14 | 92.9 | 85.7 | 73.5 | 0.0000 | ||
| T3 | 76 | 80.3 | 41.9 | 28.9 | 29.0 | (图1B) | |
| T4 | 16 | 31.3 | 0 | 0 | 6.1 | ||
| 淋巴结转移 | 0 | 30 | 90 | 77.8 | 58.0 | ||
| 1-6 | 52 | 80.8 | 45.7 | 34.2 | 31 | 0.000 | |
| 7-15 | 19 | 84.2 | 20.6 | 0 | 23.3 | (图1C) | |
| ≥16 | 17 | 35.3 | 0 | 0 | 10.6 | ||
| 远处转移 | (+) | 13 | 46.2 | 0 | 0 | 11.7 | 0.000 |
| (-) | 105 | 88.6 | 69.4 | 57.2 | 37.8 | (图1D) | |
| 脉管癌栓 | (+) | 18 | 72.2 | 36.5 | 36.5 | 26 | 0.612 |
| (-) | 100 | 78.0 | 46.7 | 33.3 | 30.5 | ||
| 切除淋巴结数 | ≤15 | 62 | 82.3 | 45.0 | 36.1 | 30.5 | 0.535 |
| >15 | 56 | 71.4 | 46.8 | 27.4 | 30.2 | ||
| 肿瘤残留 | (-) | 97 | 85.6 | 55.6 | 40.8 | 41.1 | 0.000 |
| (+) | 21 | 38.1 | 0 | 0 | 10 | (图1E) | |
| 化疗组 | 56 | 66.1 | 38.1 | 27.1 | 37.8 | 0.045 | |
| 未化疗组 | 62 | 89.3 | 53.0 | 39.5 | 25.6 | (图1F) | |
| I期 | 化疗 | 6 | 100 | 100 | 75 | 0.983 | |
| 未化疗 | 15 | 100 | 90 | 75 | |||
| II期 | 化疗 | 7 | 100 | 62.5 | 62.5 | 0.365 | |
| 未化疗 | 8 | 75 | 62.5 | 31.3 | |||
| III期 | 化疗 | 28 | 100 | 61.2 | 42.4 | 41.1 | 0.019 |
| 未化疗 | 21 | 76.2 | 27.8 | 13.9 | 23.2 | ||
| IV期 | 化疗 | 15 | 60.0 | 16.7 | 0 | 19.2 | 0.003 |
| 未化疗 | 18 | 22.2 | 0 | 0 | 6.1 |
2.1.2 术后化疗与生存期的关系: 将入选病例按手术后是否接受化疗分为两组并加以分析, 2组的ECOG评分状况大致相同. 118例术后胃癌患者中接受化疗者共56例, 主要以铂类加5-FU为主; 3/4级骨髓抑制共19例(33.9%), 3/4级非血液毒性反应共13例(23.2%), 以消化道反应为主. 62例患者因经济原因及畏惧化疗副作用而未接受化疗. 有5例患者因化疗副反应而未能完成第1周期化疗, 1例在化疗时突发猝死. 结果表明胃癌术后化疗具有统计学意义的生存优势, 中位生存期37.8对比25.6 mo(P = 0.045)(表1, 图1F).
将单因素分析中显示与预后相关的临床分期、术后肿瘤残留情况、是否接受化疗引入Cox回归模型进行分析. 结果表明临床分期、是否接受化疗及肿瘤残留情况均是预后的独立危险因素(P = 0.000、P = 0.000和P = 0.002, 表2).
| 参数 | 分级 | P值 | RR | 95%可信区间 |
| 临床分期 | Ⅰ期 | 0.000 | 0.047 | 0.013-0.071 |
| Ⅱ期 | 0.005 | 0.248 | 0.093-0.659 | |
| Ⅲ期 | 0.003 | 0.390 | 0.211-0.720 | |
| Ⅳ期 | ||||
| 术后肿瘤残留 | 有残留 | 0.027 | 2.474 | 1.488-4.111 |
| 无残留 | ||||
| 术后化疗 | 化疗 | 0.002 | 0.344 | 0.176-0.672 |
| 未化疗 |
为了解不同分期患者接受化疗的受益情况, 我们根据临床分期做了进一步的分层分析(表1). 结果显示, Ⅲ、Ⅳ期胃癌老年患者接受化疗组具有明显的生存优势(P<0.05), 可以使总生存期明显提高; 而Ⅰ、Ⅱ期接受术后化疗的老年患者并不具备生存优势. 这可能与Ⅰ、Ⅱ期老年患者生存期较长, 化疗获益程度相对被抵消所致.
胃癌术后易出现转移复发, 5年生存率较低, 国内文献一般在50%以下. 詹友庆 et al[3]分析了405例胃癌根治术后患者的预后情况, Ⅰ、Ⅱ、Ⅲ、Ⅳ期患者术后5年生存率分别为75.6%、58.7%、28.0%及17%, 总的5年生存率为43.4%. Hejna et al[4]统计了5个meta分析的结果, 5年生存率为12%-91.2%, 中位生存期为13-60 mo. 影响胃癌预后的因素很多, 较为公认的是临床分期、肿瘤大小、浸润深度、病理类型、淋巴结转移、是否行根治手术等因素. 肿瘤直径、脉管癌栓、年龄、性别、肿瘤部位及血小板增多在部分文献中也显示对预后有影响. 一些肿瘤标记物的表达水平, 如VEGF、P53、HER-2、MSI、COX-2、E-钙黏蛋白及转移抑制基因nm23等[5-6]也在部分文献中被认为对预后有影响. 日本国立癌中心分析了6112例胃癌切除病例的资料, 其中以肿瘤的浸润深度(RR: 4.76)对胃癌预后的影响因素最大, 其次为淋巴结转移(RR: 4.39)、远处转移(RR: 2.33)、淋巴清除(RR: 2.06)、年龄(RR: 1.94)、癌的组织学类型(RR: 1.55)以及肿瘤的大小(RR: 1.40)[7]. 我们入选的临床因素为性别、临床分期、组织学分化、浸润深度、淋巴结转移、远处转移、脉管癌栓、手术切除淋巴结数量、术后肿瘤残留情况. 研究分析显示, 临床分期、肿瘤浸润深度、淋巴结转移、远处转移及术后肿瘤残留均与预后明显相关, 与多数文献报导相一致. 而组织分化程度、脉管癌栓并未证实与预后有关.
姑息性化疗优于最佳支持治疗的结论已经基本达成共识, 单药的有效率为10%-30%左右, 联合化疗有效率为30%-60%左右, 中位生存期延长6 mo左右[8]. 但是胃癌术后辅助化疗是否对生存有益一直存在争议. 在过去的30年中, 相关的研究一直没有停止过. 在1993年以前, 对胃癌辅助化疗基本没有系统性大样本的研究[9]. 直到1993年, Hermans et al[10]首次进行了胃癌辅助化疗的meta分析, 共收录了11项研究, 收录了2096名患者, 结论并没有证实辅助化疗对生存有益(RR: 0.88). Earle et al[11]在1999年发表的meta分析结果说明了辅助化疗可以使患者轻度受益(RR: 0.80), 同样2000年Mari et al[12]的研究也得出基本相似的结论: 胃癌根治术后患者行辅助化疗轻度有益(RR: 0.82). 2002年时, Panzini et al[13]的meta分析结果说明胃癌患者接受辅助化疗明显受益(RR: 0.72), 可明显延长生存期. 然而Janunger et al[14]在2002年的研究不支持将辅助化疗作为胃癌的标准治疗(RR: 0.84). 总之, 虽然目前不能将辅助化疗作为胃癌的标准治疗, 但多数研究的结论均支持术后辅助化疗对生活质量及总生存期有益, 多个meta分析的结果也支持上述观点. 但是由于meta分析本身就存在出版偏倚等严重缺陷, 使得目前胃癌辅助化疗的效果仍难以确定, 这个观点也得到了Sastre et al[8]的支持.
老年胃癌患者占所有胃癌人数的50%左右. 因老年人的身体机能衰退, 合并症多, 化疗的副作用更值得注意, 对生存期的影响也需要慎重评价. Trumper et al[15]的分析结果显示, 257例70岁以上的老年食管及胃癌患者接受化疗的毒性反应对比非老年组(823例)无显著性差异, 提示老年患者也可较好的耐受化疗. 在本组回顾性分析研究中, 约10%的老年患者因化疗的副作用而选择中断治疗, 1例患者猝死. 但从整体来说, Ⅲ、Ⅳ期胃癌老年患者接受化疗组具有明显的生存优势, 较大的提高了生存质量及生存期, 应当予以肯定; 而Ⅰ期及Ⅱ期老年患者的术后化疗作用尚未明确, 需要进一步研究来证实.
胃癌仍是全球发病率较高的癌症之一, 2002年全球新诊断胃癌934 000例, 死亡700 000例. 中国及日本属高发国家. 手术是目前胃癌唯一可治愈的手段, 但近2/3的胃癌确诊时分期较晚, 多属姑息性治疗, 并且胃癌术后复发及转移率较高. 目前正进行大量临床试验, 试图通过辅助治疗来提高生存期. 主要的辅助治疗措施包括: 术后辅助化疗与放疗、术前化疗及放疗等. 美国目前针对胃癌的手术方式多为D0及D1, 并根据INT0116试验确立了术后同步放化疗为筛选患者的最佳治疗措施. 尽管如此, 目前我国胃癌治疗的现状并不乐观, 手术方式尚未标准及规范化, 辅助化疗方案及放疗也未取得共识. 老年患者占据胃癌中相当大的一部分, 关注老年胃癌患者的健康显得非常重要.
在我国, 以D2为主或包括更大范围的根治性手术正逐渐被外科医师所接受. 国外通过多个meta分析认为辅助化疗具备一定的生存优势, 但并不显著. 我国关于胃癌术后化疗对生存期的报道较少, 目前正进行临床回顾性分析及随机对照试验来证实辅助化疗的疗效. 而关于辅助放疗、术前放疗及化疗、术中放疗及化疗的研究正在进行. S1单药或联合顺铂作为辅助化疗方案的疗效也在接受进一步评定. 基础研究中, VGFR受体抗体2DC101和西妥昔单抗注射给胃癌的裸鼠移植模型, 发现联合治疗能有效抑制肿瘤细胞生长. 肿瘤标记物用于化疗疗效判断及预测预后的研究也成为热点之一.
本文主要应用Cox多因素分析来判断老年胃癌患者的预后因素, 着重于确定不同分期的胃癌患者接受术后化疗对生存期的影响. 资料详实, 分析较为准确, 对于临床指导老年胃癌的术后化疗具有一定价值.
本文进一步明确Ⅲ、Ⅳ期老年胃癌术后患者接受化疗的益处, 并建议Ⅰ、Ⅱ期老年胃癌术后患者(不合并高危因素)可不接受化疗.
本文分析方法成熟, 结果可信, 图表清晰, 有一定的临床指导意义.
编辑: 何燕 电编:郭海丽
| 2. | 孙 秀娣, 牧 人, 周 有尚, 戴 旭东, 张 思维, 皇甫 小梅, 孙 杰, 李 连弟, 鲁 凤珠, 乔 友林. 中国胃癌死亡率20年变化情况分析及其发展趋势预测. 中华肿瘤杂志. 2004;26:4-9. |
| 4. | Hejna M, Wohrer S, Schmidinger M, Raderer M. Postoperative chemotherapy for gastric cancer. Oncologist. 2006;11:136-145. [PubMed] |
| 5. | Zheng L, Wang L, Ajani J, Xie K. Molecular basis of gastric cancer development and progression. Gastric Cancer. 2004;7:61-77. [PubMed] |
| 6. | Yasui W, Oue N, Aung PP, Matsumura S, Shutoh M, Nakayama H. Molecular-pathological prognostic factors of gastric cancer: a review. Gastric Cancer. 2005;8:86-94. [PubMed] |
| 7. | Okajima K, Sasako M, Kinoshita T. Important prognostic factors for gastric cancer patients, change of significance in 6112 patients treated in 30 years period. 35th World congress of international society of surgery. 1993;593. |
| 8. | Sastre J, Garcia-Saenz JA, Diaz-Rubio E. Chemo-therapy for gastric cancer. World J Gastroenterol. 2006;12:204-213. [PubMed] |
| 9. | Agboola O. Adjuvant treatment in gastric cancer. Cancer Treat Rev. 1994;20:217-240. [PubMed] |
| 10. | Hermans J, Bonenkamp JJ, Boon MC, Bunt AM, Ohyama S, Sasako M, Van de Velde CJ. Adjuvant therapy after curative resection for gastric cancer: meta-analysis of randomized trials. J Clin Oncol. 1993;11:1441-1447. [PubMed] |
| 11. | Earle CC, Maroun JA. Adjuvant chemotherapy after curative resection for gastric cancer in non-Asian patients: revisiting a meta-analysis of randomised trials. Eur J Cancer. 1999;35:1059-1064. [PubMed] |
| 12. | Mari E, Floriani I, Tinazzi A, Buda A, Belfiglio M, Valentini M, Cascinu S, Barni S, Labianca R, Torri V. Efficacy of adjuvant chemotherapy after curative resection for gastric cancer: a meta-analysis of published randomised trials. A study of the GISCAD (Gruppo Italiano per lo Studio dei Carcinomi dell'Apparato Digerente). Ann Oncol. 2000;11:837-843. [PubMed] |
| 13. | Panzini I, Gianni L, Fattori PP, Tassinari D, Imola M, Fabbri P, Arcangeli V, Drudi G, Canuti D, Fochessati F. Adjuvant chemotherapy in gastric cancer: a meta-analysis of randomized trials and a comparison with previous meta-analyses. Tumori. 2002;88:21-27. [PubMed] |
| 14. | Janunger KG, Hafstrom L, Glimelius B. Chemotherapy in gastric cancer: a review and updated meta-analysis. Eur J Surg. 2002;168:597-608. [PubMed] |
| 15. | Trumper M, Ross PJ, Cunningham D, Norman AR, Hawkins R, Seymour M, Harper P, Iveson T, Nicolson M, Hickish T. Efficacy and tolerability of chemotherapy in elderly patients with advanced oesophago-gastric cancer: A pooled analysis of three clinical trials. Eur J Cancer. 2006;42:827-834. [PubMed] |