修回日期: 2007-09-24
接受日期: 2007-09-28
在线出版日期: 2007-11-08
目的: 研究穿孔素和颗粒酶B蛋白在心脏移植后表达水平变化与心脏移植急性排斥反应的关系.
方法: 采用小鼠腹部心脏移植模型, 分为移植排斥组、实验处理组和同系移植组, 每组20对. 观察移植物存活时间、供心病理改变. 采用Western blot法检测受鼠脾脏淋巴细胞穿孔素及颗粒酶B蛋白表达水平, 免疫荧光方法观察心脏移植物内穿孔素及颗粒酶B的表达情况.
结果: 移植排斥组及实验处理组移植物平均存活时间分别为7.8±0.77 d、14.80±1.01 d, 同系移植组移植物存活均超过28 d, 三组差异有显著性. 移植排斥组与实验组及同系移植组相比较, 移植物内心肌细胞变性坏死严重并有大量炎性细胞浸润. 移植术后7 d, 移植排斥组与实验处理组和同系移植组相比, 受鼠脾脏淋巴细胞穿孔素蛋白表达分别增加3.02倍、4.13倍, 颗粒酶B蛋白表达分别增加3.44倍、 2.50倍, 差异有显著性. 与另外两组相比, 移植排斥组心脏移植物冠状动脉分支内充填大量穿孔素与颗粒酶B阳性细胞, 组织间隙内也有较多双阳性细胞浸润.
结论: 穿孔素与颗粒酶B蛋白表达增加与急性排斥反应相关, 可作为急性排斥反应的早期诊断指标.
引文著录: 朱鹏, 陈义发, 李丹, 陈孝平. 小鼠心脏移植后穿孔素及颗粒酶B表达水平与急性排斥反应的关系. 世界华人消化杂志 2007; 15(31): 3289-3293
Revised: September 24, 2007
Accepted: September 28, 2007
Published online: November 8, 2007
AIM: To investigate the relationship between acute rejection after heart transplantation and protein expression of perforin and granzyme B in organ recipients.
METHODS: All ventral heterotopic cardiac transplantation models were divided into three groups: rejection, treated, and isograft (20 recipients in each). Mean survival time (MST), histopathological changes, and protein expression of perforin and granzyme B in spleen lymphocytes were measured by Western blotting. Immunofluorescence techniques were used to determine the graft expression of perforin and granzyme B.
RESULTS: MST of heart allografts in the rejection and treated groups was 7.8 ± 0.77 d and 14.80 ± 1.01 d, respectively. Graft survival time in the isograft group was > 28 d, The differences between the three groups were statistically significant. The number of infiltrating cells in the rejection group, most of which were positive for perforin and granzyme B protein expression, was much higher than that in the other groups, as was the extent of the histopathological changes. Seven days after transplantation, compared with those in the treated group and isograft group, perforin protein expression in recipient spleen lymphocytes in the rejection group increased by 3.02-fold and 4.13-fold, while granzyme B protein expression increased by 3.44-fold and 2.50-fold, respectively.
CONCLUSION: Perforin and granzyme B can serve as a diagnostic index for acute rejection after transplantation.
- Citation: Zhu P, Chen YF, Li D, Chen XP. Relationship between acute rejection after heart transplantation and protein expression of perforin and granzyme B. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3289-3293
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3289.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3289
免疫排斥反应是影响同种异体器官移植疗效的主要障碍之一, 可导致移植物的结构损害和功能衰竭[1-2]. 急性排斥反应对机体和移植器官危害极大, 其机制较为复杂[3-7]. 穿孔素及颗粒酶B主要是由细胞毒性T淋巴细胞(Tc)分泌的一系列颗粒物质, 可以直接杀伤靶细胞[8-10]. 我们采用小鼠腹部异位心脏移植模型进行相关研究, 探讨穿孔素及颗粒酶B在小鼠脾脏淋巴细胞及心脏移植物内的表达及其在排斥反应中的意义.
近交系C57BL/6小鼠60只及近交系Balb/c小鼠80只, ♂, 6-8 wk龄, 15-20 g, 购于同济医学院器官移植研究所. 供、受体质量无显著性差异, 手术前后不禁饮食. 将实验动物分为3组: A: 移植排斥组, B: 实验处理组和C: 同系移植组, 分别为20对. A组供体为C57BL/6小鼠, 受体为Balb/c小鼠, 无特殊处理, B组供体为C57BL/6小鼠, 受体为Balb/c小鼠, 受鼠在术前1 d经尾静脉行特异性供体脾细胞输注, 术前1 d及术后1 wk联合应用环孢素A(5 µg/g). C组供受体均为Balb/c小鼠, 无特殊处理. 动物模型采用小鼠腹部异位心脏移植模型, 将供心主动脉与受体腹主动脉、供心肺动脉与受体下腔静脉分别行端侧吻合. 双人双目手术显微镜一台(购于上海医用光学仪器厂), 显微手术包(购于上海医疗器械有限公司手术器械厂), 12-0带线缝合针(购于宁波医用缝线厂), 5-0医用丝线(上海医用缝合厂), 戊巴比妥钠(同济医学院职业医学研究所惠赠), 小鼠脾脏淋巴细胞分离液(深圳达科为公司), 大鼠抗穿孔素抗体FITC标记(Abcam, ab16075), 兔抗颗粒酶B抗体(Abcam, ab4059), 兔抗beta-actin抗体、辣根过氧化物酶(HRP)标记羊抗兔及羊抗鼠二抗、羊抗兔荧光二抗试剂盒(晶美公司), 激光共聚焦显微镜(Olympus). 脾细胞悬液制备: 采用10 g/L戊巴比妥钠ip麻醉C57BL/6小鼠(0.01 mL/g), 无菌条件下切取脾脏, 放入盛有少量D-Hanks液培养皿内, 将之剪成小块, 转移至200目钢网上, 用灭菌针芯轻轻研磨, 经网过滤, 即制成单细胞悬液. 1000 r/min离心10 min, 弃上清, 加入适当红细胞裂解液, 吹打混匀, 2-3 min后加入D-Hanks液10 mL终止反应, 1000 r/min离心10 min, 洗2次, 用DMEM培养基调整细胞浓度至5×1010个/L备用, 采用台盼蓝溶液染色计算活细胞百分率.
术后每日手指触诊受鼠腹部, 如供心不再搏动或仅有细微颤动均视为排斥终点, 并设定28 d为观察终点. 移植后7 d分别随机从3组中挑选受鼠各5只, 断颈处死后取供心和脾组织, 锡箔纸包裹后冻存于液氮中, 保存备用. 其中2只供心于40 g/L甲醛溶液内固定24 h后, 石蜡包埋制成切片HE染色后于光学显微镜下观察. 术后7 d, 采用小鼠淋巴细胞分离液分出受鼠脾脏淋巴细胞, 提取蛋白, 采用lowry法调蛋白浓度一致, 用Western blot方法检测穿孔素及颗粒酶B的表达水平, 采用Beta-actin作为内参. 其中一抗(1:2000)37℃孵育2 h, PBS洗15 min, 重复3次, HRP标记二抗(1:1000)37℃孵育1 h, PBS洗3次, 于暗室中进行ECL化学发光法显影. Western blot蛋白条带采用Gel-pro软件进行灰度扫描分析, 并计算相对灰度值. 相对灰度值 = IOD(目的条带)/IOD(内参). 另将移植物取出, 置于样品托, 制成冰冻切片, 约7 µm厚, 采用预冷丙酮固定30 min, 含10 mL/L小牛血清的PBST室温封闭30 min(以下均为避光操作), 加入穿孔素抗体(1:100)室温作用1 h, PBS清洗5 min×3, 羊血清封闭30 min后加入颗粒酶B抗体室温下作用1 h, PBS清洗5 min×3, 羊抗兔CY3荧光素标记二抗室温作用1 h, PBS清洗5 min×3, 封片后于激光共聚焦显微镜下观察. 免疫荧光采用Image-pro Plus软件进行分析.
统计学处理 实验数据采用mean±SD表示, 统计学方法采用单因素方差分析及Pearson相关分析, 用SPSS10.0软件进行统计分析.
移植排斥组(A组)移植心脏平均存活时间为7.8±0.77 d, 实验处理组(B组)移植心脏平均存活时间为14.80±1.01 d, 所有同系移植组(C组)移植物在观察终点28 d时均存活, 3组存活时间比较, 差别有显著性意义(F = 2763.28, P<0.01).
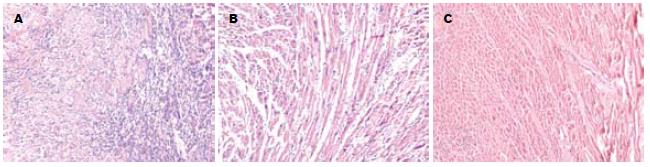
移植术后7 d, 移植排斥组为典型细胞免疫性损伤病理改变, 心肌细胞变性坏死、大量炎性细胞浸润, 以淋巴细胞和单核细胞为主, 病理分级为3级, 实验处理组只有少量炎性细胞浸润, 心肌细胞变性坏死较轻, 病理分级为1A级, 同系移植组几乎无炎性细胞浸润, 心肌细胞无变性坏死, 病理分级为0级(图1).
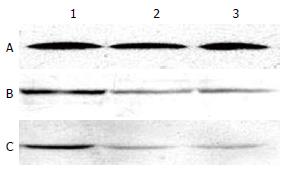
移植排斥组受鼠脾脏淋巴细胞穿孔素蛋白表达最强, 与实验处理组及同系移植组相比, 分别增强3.02倍和4.13倍, 差异有显著性(F = 355.31, P<0.01). 3组淋巴细胞颗粒酶B蛋白表达相比, 移植排斥组分别是实验处理组和同系移植组的4.44倍和3.50倍, 差异有显著性(F = 325.92, P<0.01, 图2, 表1). 将两种蛋白表达的相对灰度值与相应组别移植物存活时间及病理分级行相关分析, 提示受鼠脾脏淋巴细胞穿孔素及颗粒酶B蛋白表达水平与移植物存活时间存在明显负相关(r = -0.710, r = -0.808), 而与病理分级存在明显正相关(r = 0.915, r = 0.965).
| (IOD/IOD) | 移植排斥组 | 实验处理组 | 同系移植组 |
| 穿孔素 | 0.48±0.06 | 0.12±0.03 | 0.09±0.03 |
| 颗粒酶B | 0.42±0.05 | 0.09±0.03 | 0.12±0.04 |
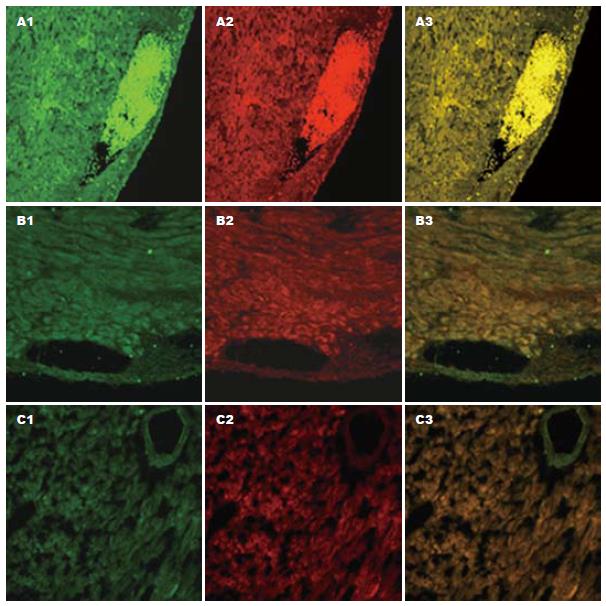
移植术后7 d, 移植排斥组心脏移植物冠状动脉分支内充填大量穿孔素与颗粒酶B阳性细胞, 组织间隙内也有较多双阳性细胞浸润, 单视野内双阳性细胞数为5424±213个. 实验处理组心脏移植物冠状动脉分支及组织间隙内, 此类双阳性细胞明显减少, 单视野内双阳性细胞数为54±18个, 而同系移植组移植物内, 冠状动脉分支及组织间隙内仅有极少量此类双阳性细胞存在, 单视野内双阳性细胞数为4±4个. 3组细胞数比较, 差异显著(F = 10408.42, P<0.01, 图3). 移植物内双阳性细胞数与相应组别移植物存活时间及病理分级行相关分析, 提示移植物内浸润的双阳性细胞数与移植物存活时间呈明显负相关(r = -0.771), 与病理分级呈明显正相关(r = 0.948).
同种异体移植物的识别和排斥, 是涉及免疫效应细胞及调节因子在内的多种细胞间相互复杂作用的结果[11]. 激活的CD4+辅助性T细胞分化为Th1和Th2亚群, 通过他们分泌不同细胞因子而参与不同免疫应答[12-18]. Th1亚群分泌IFN-γ, TNF-β和IL2等, 主要介导细胞毒(CTL)和迟发性超敏反应(DTH), Th2亚群分泌IL4, IL5, IL6, IL10, 主要功能是刺激B细胞增生并产生抗体, 参与体液免疫应答[19-21].
以细胞免疫为主的排斥反应, 始终是影响器官移植效果的主要障碍之一, 其主要效应机制是由Tc介导的细胞毒作用[22-27], 其机制主要有两种: (1)分泌型杀伤, 主要释放一些颗粒性物质, 如穿孔素、颗粒酶等. 颗粒酶经穿孔素在细胞膜上形成的小孔进入细胞内, 激活核酸内切酶系统, 使靶细胞DNA断裂, 引起靶细胞凋亡, 直接杀伤靶细胞. (2)非分泌型杀伤, 主要通过Fasl和TNF途径起作用. 穿孔素又称孔形成蛋白、细胞溶素、C9相关蛋白. 他是一种蛋白酶, 以能在靶细胞膜上形成孔道, 破坏靶细胞膜的完整性而得名, 含534个氨基酸. 在静止的细胞毒性前体细胞内穿孔素表达水平非常低, 一旦激活, 其穿孔素表达水平显著升高. 颗粒酶, 又名丝氨酸蛋白酶, 已发现鼠的颗粒酶有7种, 人的颗粒酶有3种, 其中最主要的是A, B两类. 颗粒酶B具有门冬氨酸酶的活性, 能迅速引起靶细胞DNA的断裂, 作用强于颗粒酶A, 是主要的效应分子[28-30].
目前, 有关穿孔素与颗粒酶研究主要集中于外周血淋巴细胞或移植物浸润细胞的基因表达水平, 蛋白水平研究较少. 我们发现, 移植急性排斥组受鼠脾脏淋巴细胞穿孔素蛋白表达与实验处理组和同系移植组相比, 分别增强3.02倍、4.13倍, 颗粒酶B蛋白表达分别增加3.44倍、2.50倍, 差异有显著性, 二者表达水平与移植物存活时间存在明显负相关, 而与病理分级存在明显正相关. 另外, 移植排斥组术后7 d, 移植物冠状动脉分支内充填大量穿孔素与颗粒酶B阳性细胞, 组织间隙内也有较多双阳性细胞浸润, 显著高于实验处理组及同系移植组. 单视野内浸润的双阳性细胞数与移植物存活时间呈明显负相关, 与病理分级呈明显正相关. 急性排斥反应时, 脾脏淋巴细胞内穿孔素及颗粒酶B蛋白水平上调或移植物内穿孔素与颗粒酶B双阳性的浸润细胞数明显增加, 有助于我们早期诊断急性排斥反应的发生. 另外, 结果还表明特异性供体脾细胞输注联合环孢素能明显抑制淋巴细胞内穿孔素与颗粒酶B蛋白表达, 并抑制其向移植物内浸润, 从而延长移植物存活时间.
有关特异性供体脾细胞输注联合环孢素如何有效抑制Tc激活, 颗粒酶如何引起靶细胞凋亡的具体机制还需进一步研究. 这些机制的阐明对于有效减少排斥反应的发生, 提高移植物的存活率, 延长移植物存活时间均有重要的意义.
免疫排斥反应是影响同种异体器官移植疗效的主要障碍之一. 急性排斥反应对机体和移植器官危害极大, 其机制较为复杂. 穿孔素及颗粒酶B主要是由细胞毒性T淋巴细胞分泌的一系列颗粒物质, 在细胞免疫为主的急性排斥反应中起重要作用.
本文采用小鼠腹部异位心脏移植模型进行相关研究, 探讨穿孔素及颗粒酶B在小鼠脾脏淋巴细胞及心脏移植物内的表达及其在排斥反应中的意义.
有关穿孔素与颗粒酶研究主要集中于外周血淋巴细胞或移植物浸润细胞的基因表达水平, 蛋白水平研究较少. 本研究结合Western blot和免疫荧光等蛋白检测方法, 并在小鼠心脏移植模型上对急性排斥反应过程中穿孔素及颗粒酶B蛋白表达进行探讨.
本文结果对于急性排斥反应早期诊断的发展有重要意义.
本文选题新颖, 采用方法技术成熟, 设计合理, 实验证据充足, 有一定的创新性, 可读性及应用价值.
编辑: 程剑侠 电编:郭海丽
| 1. | Heslan JM, Renaudin K, Thebault P, Josien R, Cuturi MC, Chiffoleau E. New evidence for a role of allograft accommodation in long-term tolerance. Transplantation. 2006;82:1185-1193. [PubMed] |
| 2. | Burton JR Jr, Rosen HR. Acute rejection in HCV-infected liver transplant recipients: The great conundrum. Liver Transpl. 2006;12:S38-47. [PubMed] |
| 3. | Caballero A, Fernandez N, Lavado R, Bravo MJ, Miranda JM, Alonso A. Tolerogenic response: allore-cognition pathways. Transpl Immunol. 2006;17:3-6. [PubMed] |
| 4. | Brook MO, Wood KJ, Jones ND. The impact of memory T cells on rejection and the induction of tolerance. Transplantation. 2006;82:1-9. [PubMed] |
| 5. | Glotz D, Lucchiari N, Pegaz-Fiornet B, Suberbielle-Boissel C. Endothelial cells as targets of allograft rejection. Transplantation. 2006;82:S19-21. [PubMed] |
| 6. | Wilczynski JR. Immunological analogy between allograft rejection, recurrent abortion and pre-eclampsia - the same basic mechanism? Hum Immunol. 2006;67:492-511. [PubMed] |
| 7. | Hornick P. Direct and indirect allorecognition. Methods Mol Biol. 2006;333:145-56. [PubMed] |
| 8. | Andersen MH, Schrama D, Thor Straten P, Becker JC. Cytotoxic T cells. J Invest Dermatol. 2006;126:32-41. [PubMed] |
| 9. | Yannaraki M, Rebibou JM, Ducloux D, Saas P, Duperrier A, Felix S, Rifle G, Chalopin JM, Herve P, Tiberghien P. Urinary cytotoxic mole-cular markers for a noninvasive diagnosis in acute renal transplant rejection. Transpl Int. 2006;19:759-768. [PubMed] |
| 10. | Olive C, Cheung C, Falk MC. Apoptosis and expre-ssion of cytotoxic T lymphocyte effector molecules in renal allografts. Transpl Immunol. 1999;7:27-36. [PubMed] |
| 12. | Colantonio L, Recalde H, Sinigaglia F, D'Ambrosio D. Modulation of chemokine receptor expression and chemotactic responsiveness during differentiation of human naive T cells into Th1 or Th2 cells. Eur J Immunol. 2002;32:1264-1273. [PubMed] |
| 13. | Spellberg B, Edwards JE Jr. Type 1/Type 2 immu-nity in infectious diseases. Clin Infect Dis. 2001;32:76-102. [PubMed] |
| 14. | Glimcher LH, Murphy KM. Lineage commitment in the immune system: the T helper lymphocyte grows up. Genes Dev. 2000;14:1693-1711. [PubMed] |
| 15. | Dong C, Flavell RA. Th1 and Th2 cells. Curr Opin Hematol. 2001;8:47-51. [PubMed] |
| 16. | Tau GZ, von der Weid T, Lu B, Cowan S, Kvatyuk M, Pernis A, Cattoretti G, Braunstein NS, Coffman RL, Rothman PB. Interferon gamma signaling alters the function of T helper type 1 cells. J Exp Med. 2000;192:977-986. [PubMed] |
| 17. | Zhou M, Ouyang W. The function role of GATA-3 in Th1 and Th2 differentiation. Immunol Res. 2003;28:25-37. [PubMed] |
| 18. | Smeltz RB, Chen J, Hu-Li J, Shevach EM. Regulation of interleukin (IL)-18 receptor alpha chain expression on CD4(+) T cells during T helper (Th)1/Th2 differentiation. Critical downregulatory role of IL-4. J Exp Med. 2001;194:143-153. [PubMed] |
| 19. | Smeltz RB, Chen J, Shevach EM. Transforming growth factor-beta1 enhances the interferon-gamma-dependent, interleukin-12-independent pathway of T helper 1 cell differentiation. Immunology. 2005;114:484-492. [PubMed] |
| 20. | Murphy KM, Reiner SL. The lineage decisions of helper T cells. Nat Rev Immunol. 2002;2:933-944. [PubMed] |
| 21. | Kita Y, Li XK, Ohba M, Funeshima N, Enosawa S, Tamura A, Suzuki K, Amemiya H, Hayashi S, Kazui T. Prolonged cardiac allograft survival in rats systemically injected adenoviral vectors containing CTLA4Ig-gene. Transplantation. 1999;68:758-766. [PubMed] |
| 22. | Schulz M, Schuurman HJ, Joergensen J, Steiner C, Meerloo T, Kagi D, Hengartner H, Zinkernagel RM, Schreier MH, Burki K. Acute rejection of vascular heart allografts by perforin-deficient mice. Eur J Immunol. 1995;25:474-480. [PubMed] |
| 23. | Alexander DZ, Pearson TC, Hendrix R, Ritchie SC, Larsen CP. Analysis of effector mechanisms in murine cardiac allograft rejection. Transpl Immunol. 1996;4:46-48. [PubMed] |
| 25. | Voskoboinik I, Trapani JA. Addressing the mys-teries of perforin function. Immunol Cell Biol. 2006;84:66-71. [PubMed] |
| 26. | Satterwhite T, Chua MS, Hsieh SC, Chang S, Scandling J, Salvatierra O, Sarwal MM. Increased expression of cytotoxic effector molecules: different interpretations for steroid-based and steroid-free immunosuppression. Pediatr Transplant. 2003;7:53-58. [PubMed] |
| 27. | Shin GT, Kim SJ, Lee TS, Oh CK, Kim H. Gene expression of perforin by peripheral blood lymph-ocytes as a marker of acute rejection. Nephron Clin Pract. 2005;100:c63-70. [PubMed] |
| 28. | Dugre FJ, Gaudreau S, Belles-Isles M, Houde I, Roy R. Cytokine and cytotoxic molecule gene expression determined in peripheral blood mononuclear cells in the diagnosis of acute renal rejection. Transplantation. 2000;70:1074-1080. [PubMed] |
| 29. | Graziotto R, Del Prete D, Rigotti P, Anglani F, Baldan N, Furian L, Valente M, Antonello A, Marchini F, D'Angelo A. Perforin, Granzyme B, and fas ligand for molecular diagnosis of acute renal-allograft rejection: analyses on serial biopsies suggest methodological issues. Transplantation. 2006;81:1125-1132. [PubMed] |
| 30. | Muthukumar T, Ding R, Dadhania D, Medeiros M, Li B, Sharma VK, Hartono C, Serur D, Seshan SV, Volk HD. Serine proteinase inhibitor-9, an endogenous blocker of granzyme B/perforin lytic pathway, is hyperexpressed during acute rejection of renal allografts. Transplantation. 2003;75:1565-1570. [PubMed] |