修回日期: 2007-10-14
接受日期: 2007-10-28
在线出版日期: 2007-11-08
目的: 探讨免疫抑制剂环孢素A(cyclosporine A, CsA)对顺铂(cisplatin, CDDP)诱导的肝癌细胞(hepatocelluar carcinoma cells, HCC)凋亡的影响及可能机制.
方法: 采用SMMC7721肝癌细胞进行培养, 3 d传一代. 分成A组(空白对照)、B组(加入10 mg/L的CsA)、C组(加入40 mg/L的CsA)、D组(加入20 mg/L的CDDP)、E组(加入10 mg/L的CsA+20 mg/L的CDDP)、F组(加入40 mg/L的CsA+20 mg/L的CDDP), 在荧光显微镜下观察各组细胞的形态学变化, 采用噻唑蓝(methyl thiazolyl tetrazolium, MTT)比色法测定细胞24 h及48 h存活率, 并用流式细胞仪检测各组细胞在24 h的凋亡率.
结果: E, F组在倒置光学显微镜下呈现多量细胞坏死, 凋亡小体较D组明显减少. D组凋亡率最高, 为32.7%±2.8%; 而E, F组凋亡率分别为22.7%±2.4%及22.8%±2.8%; A, B, C组凋亡率最低且组间差异不明显. E, F组与D组相比差异显著(P = 0.008).
结论: CsA可以抑制CDDP诱导的肝癌细胞凋亡.
引文著录: 曾兆林, 崔云甫, 彭威. 环孢素A对顺铂诱导肝癌细胞凋亡的影响. 世界华人消化杂志 2007; 15(31): 3267-3271
Revised: October 14, 2007
Accepted: October 28, 2007
Published online: November 8, 2007
AIM: To investigate the effect of cyclosporine A (CsA) on cisplatin (CDDP)-induced apoptosis of hepatocellular carcinoma (HCC) cells.
METHODS: SMMC 7721 HCC cells were cultured (re-cultured every 3 d) and divided into six groups: A (control), B (10 mg/L CsA), C (40 mg/L CsA), D (20 mg/L CDDP), E (10 mg/L CsA + 20 mg/L CDDP), and F (40 mg/L CsA + 20 mg/L CDDP). Morphological changes were observed by fluorescence microscopy, cell growth was assessed with the methyl thiazolyl tetrazolium (MTT) assay at 24 and 48 h, and apoptosis was assessed by flow cytometry.
RESULTS: The number of necrotic cells in groups E and F was more and the number of apoptotic HCC cells was significantly lower in groups E and F than in group D. The apoptotic rate was significantly lower in groups E (22.7% ± 2.4%) and F (22.8% ± 2.8%) than in group D (32.7% ± 2.8%, P = 0.008). The rate of apoptosis in groups A, B and C was the lowest, although there were no obvious differences between the groups.
CONCLUSION: CsA decreases the rate of CDDP-induced apoptosis in HCC cells.
- Citation: Zeng ZL, Cui YF, Peng W. Effect of cyclosporine A on cisplatin-induced apoptosis of hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2007; 15(31): 3267-3271
- URL: https://www.wjgnet.com/1009-3079/full/v15/i31/3267.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i31.3267
肝移植后常规应用免疫抑制剂环孢素A(cyclos-porine A, CsA), 但是对于肝癌患者, 肝移植后应用CsA是否会导致肿瘤的高复发及CsA对肝癌细胞凋亡的影响仍存在争议. 顺铂(cisplatin, CDDP)属细胞周期非特异性药物, 可抑制癌细胞的DNA复制过程, 并损伤其细胞膜上结构, 有较强的广谱抗癌作用, 并且与多种抗肿瘤药有协同作用, 且无交叉耐药等特点, 为当前联合化疗中最常用的药物之一. 我们通过体外实验观察CsA对CDDP诱导的肝癌细胞凋亡产生的影响及探讨可能的机制.
人肝癌细胞系SMMC7721, 由本院实验中心刘伟老师培养并提供, 在含有100 mL/L胎牛血清、青霉素(100 kU/L)及链霉素(100 kU/L)的高糖DMEM培养基中37℃、50 mL/L CO2条件下培养, 每3 d传一代. 优级胎牛血清、高糖DMEM培养基购自Hyclone公司, Annexin-V凋亡检测试剂盒购自晶美生物工程公司, caspase-3活性检测试剂盒购自BioVision公司, 3, 4-甲基-2-噻唑基-2, 5-二苯基溴化四氮唑(MTT)为Ameresco公司产品, 环孢素-A(甲醇溶解)、DMSO(二甲基亚砜)为Sigma公司产品, CDDP购自齐鲁制药厂.
1.2.1 细胞存活率检测: 将处于对数期的SMMC7721细胞接种于96孔板200 μL完全培养基中, 每孔细胞数为1×105. 分别加终浓度为10, 20, 30, 40, 50 mg/L的CsA, 对照组加入等体积的PBS溶液, 每组设3个复孔. 培养48 h, 每24 h检测1次细胞存活率, 方法: 加入20 μL MTT (5 mg/L), 孵育4 h, 终止培养, 1500 r/min离心5 min, 弃去上清, 每孔加入DMSO 200 μL, 充分振荡混匀, 于酶标仪SLT spectra, Austria上测定450 nm的吸光度A值. 按下列公式计算细胞存活率 = (实验组吸光度/对照组吸光度)×100%.
1.2.2 细胞凋亡的诱导: 取对数生长期细胞, 分成6组: A组(对照组)加入与实验组等量的甲醇(无CsA)及PBS稀释液(无CDDP), B组(单纯加入mg/L/mL的CsA), C组(单纯加入40 mg/L的CsA), D组(单纯加入20 mg/L的CDDP), E组(同时加入10 mg/L的CsA及20 mg/L的CDDP), F组(同时加入40 mg/L的CsA及20 mg/L的CDDP). 以上各组均作用24 h, 以诱导细胞凋亡.
1.2.3 caspase-3的活性检测: 收集上述各组细胞, 1000 r/min离心10 min, 用预冷的PBS液洗涤1次; 加入caspase-3活性检测试剂盒提供的细胞裂解液50 μL置于冰上反应10 min, 10 000 g离心1 min; 将裂解物分离出来加入96孔板, 每孔加入4 mmol/L的DEVD-ρna 5 μL在37℃反应1-2 h; 于酶标仪SLT spectra, Austria上测定450 nm的吸光度A值.
1.2.4 流式细胞仪检测细胞凋亡: 收集上述各组细胞, 总数为1×106以上, 1000 r/min离心10 min, 用预冷的含PBS液洗涤2次, 然后制成500 μL细胞悬液, 经过300目尼龙滤网过滤后加入Annexin-V FITC 10 μL及20 g/L的碘化丙啶(propidine iodide, PI) 5 μL, 4℃下避光反应15 min后送流式细胞室进行肝癌细胞早期凋亡的流式细胞仪(BD FACSort, USA)检测, 软件系统为Cell Quest 3.0, 流式细胞数据分析使用WinMDI 2.8.
收集上述各组细胞, 在倒置光学显微镜下观察各组细胞的形态学变化.
统计学处理 所有数据采用mean±SD表示, 数据处理使用统计软件进行t检验和方差分析. 统计软件使用SPSS13.0, 显著性水平为α = 0.05.
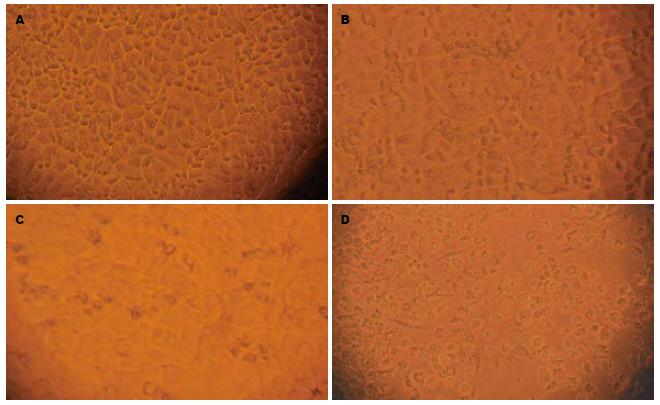
对照组细胞贴壁生长良好, 边界清楚, 呈上皮样细胞形态, 可见较多的核分裂相. 单纯CsA组作用48 h后可见细胞形态基本与对照组相同, 核分裂相略少, 边界稍模糊, 但细胞贴壁生长良好. 单纯CDDP组作用48 h后可见大部分细胞凋亡, 细胞褶皱为圆形, 折光率减弱, 细胞间距变大, 可见凋亡小体, 少部分细胞坏死. CDDP联合CsA组作用48 h后可见多量细胞坏死, 细胞肿大, 细胞膜破裂, 贴壁能力下降, 多数脱落漂浮于培养液中, 部分细胞可见凋亡形态特征(图1).
结果显示, CsA在10-50 mg/L的范围内对肝癌细胞的生长抑制呈减弱趋势, 浓度越高, 作用时间越长, 对肝癌细胞生长的影响越小. 10 mg/L组对肝癌细胞生长抑制作用最强, 其他各组在48 h后抑制作用明显减弱, 与空白对照组比较无差异(表1).
检测结果显示, D组诱导细胞凋亡率最高, 为32.7%±2.8%. E, F组细胞凋亡率较D组低, 分别为22.7%±2.4%和22.8%±2.8%. 两组之间无明显差异(P>0.05), 但与D组相比差异显著(P = 0.008). A, B, C 3组凋亡率及坏死率最低, 组间差异不明显(表2).
A组与B组各时段与单纯裂解液空白对照组比较无变化, C组作用24 h后无变化, 48 h后变化较明显. 其他各组作用24 h效果即很明显, E, F组作用48 h后效果最好(表2).
CsA是肝移植术后常规应用的免疫抑制剂, 但是肝癌患者行肝移植术后是否应用CsA, 用量多少始终是临床经常争论的一个话题. Freise et al[1]通过动物实验证明, 在不应用抗癌药物的情况下, CsA对细胞凋亡呈抑制作用, 并且在某种程度上增加肝癌的复发率和肺部的转移率. Vivarelli et al[2]根据82个肝癌肝移植患者的回顾性调查研究发现, 对于HCC的肝移植患者, 术后CsA的剂量高低对生存率有一定的影响. 因此, 国外有学者建议, 对于患恶性肿瘤的器官移植患者, 应尽量减少CsA的应用. 但随着对凋亡研究的深入, Hartel et al[3]报道, CsA与细胞凋亡的关系呈双向性, 当浓度低时, 促进凋亡, 当浓度高时, 抑制凋亡[4-5]. 国内也有CsA对肝癌细胞增殖和凋亡的影响及联合应用抗癌药物后肝癌细胞增殖、凋亡变化的报道[6]. 从表1可以看出, CsA作用24 h后细胞的存活率明显增加, 证明凋亡率和坏死率降低, 说明CsA对细胞凋亡有抑制作用. 本研究没有观察48 h以后各组的存活率, 但根据以往的研究结果可以推测各组肝癌细胞的存活率可能进一步增加[7-9]. 而表2的结果表明, CsA对肝癌细胞增殖的影响随着浓度的增加而减弱, 20 mg/L以上浓度的CsA对肝癌细胞的增殖几乎没有影响, 而20 mg/L以下浓度对肝癌细胞的增殖有抑制作用. 并且从表1的结果可以看出, CsA对肝癌细胞的增殖存在时效性, 时间越长, 抑制的效果越差[7-8]. 众所周知, CsA对细胞凋亡的抑制作用主要体现在对线粒体渗透性转换孔存在特异性抑制, 通过与钙调磷酸酶结合而阻止线粒体膜电位下降, 进而抑制细胞色素C的释放而抑制细胞凋亡[10-12]. 我们发现B, C组的凋亡率和坏死率与空白对照组相比没有统计学差异, 说明此剂量下的CsA对细胞凋亡的影响不大, 该结果与高金亭 et al[7]的研究结果一致[8-9,13-15]. 这个结果同时也说明, 对于患恶性肿瘤的器官移植患者, 应用低浓度的CsA是安全可靠的, 不会引起肿瘤的复发和转移[16-17]. 我们同样发现单纯CsA组与空白组的caspase-3活性变化没有统计学差异, 说明CsA虽然可以抑制细胞色素C释放, 但却不能阻止caspase-3的激活[18-22], 而CsA对caspase-3下游酶活性的影响如何在国内外还没有相关的报道, 本实验亦没有涉及, 尚需日后进一步研究. CDDP是国内外比较常用的抗肿瘤药物, 可抑制癌细胞的DNA复制过程, 并损伤其细胞膜上结构[23-25]. 其对癌细胞的作用随着剂量的不同而改变, 小剂量引起细胞凋亡, 大剂量则主要引起细胞坏死[26-30]. 本实验中顺铂的剂量为临床常用剂量, 在此剂量下的顺铂主要通过诱导细胞凋亡而杀伤肝癌细胞, 而加入CsA后其诱导凋亡作用减弱了, 可以看出E, F两组的caspase-3活性虽然远远高于CDDP组, 但是流式细胞仪测定凋亡的结果却显示E, F组的凋亡率要小于单纯CDDP组, 说明CsA对于CDDP诱导的凋亡发挥了抑制作用. 分析原因可能与其直接造成细胞坏死和其他因素有关, 其具体作用机制尚需进一步的研究证明.
环孢素和顺铂都有较强的广谱抗癌作用, 并且与多种抗肿瘤药有协同作用, 且无交叉耐药等特点, 为当前联合化疗中最常用的药物之一. 关于环孢素应用于移植后排异反应, 各方说法不一, 有人认为可增加癌症的复发率, 有人认为无影响. 本实验设计了几种不同的方案来验证CsA对肝癌细胞凋亡的影响.
本文的热点在于不同浓度的CsA对肝癌细胞凋亡的影响是不同的, 关于此方面的争论一直是临床中不断的话题. Caspase家族与凋亡的关系近年越来越受到大家的重视, CsA与凋亡的关系及对caspase-3的影响一直是本研究领域中亟待解决的问题, 而顺铂与凋亡的关系近年来也成为研究的重点.
本文中设计了不同浓度梯度的CsA, 并研究各种浓度下其对凋亡的影响, 以及用各种不同的方法研究CsA及CDDP的相互作用和可能的机制.
本文结果表明, CsA对肝癌细胞增殖的影响随着浓度的增加而减弱, 20 mg/L以上浓度的CsA对肝癌细胞的增殖几乎没有影响. 而20 mg/L以下浓度对肝癌细胞的增殖有抑制作用. CsA对CDDP诱导的凋亡发挥了抑制作用, 分析原因可能与其直接造成细胞坏死和其他因素有关, 所以临床中应用CsA抑制排斥反应时不应使用大剂量的CsA, 以免造成肿瘤的复发.
本文研究方案设计合理, 简单明了, 文字流畅, 表达准确, 是一篇较好的论文.
编辑: 程剑侠 电编:郭海丽
| 1. | Freise CE, Ferrell L, Liu T, Ascher NL, Roberts JP. Effect of systemic cyclosporine on tumor recurrence after liver transplantation in a model of hepatocellular carcinoma. Transplantation. 1999;67:510-513. [PubMed] |
| 2. | Vivarelli M, Bellusci R, Cucchetti A, Cavrini G, De Ruvo N, Aden AA, La Barba G, Brillanti S, Cavallari A. Low recurrence rate of hepatocellular carcinoma after liver transplantation: better patient selection or lower immunosuppression? Transplantation. 2002;74:1746-1751. [PubMed] |
| 3. | Hartel C, Hammers HJ, Schlenke P, Fricke L, Schumacher N, Kirchner H, Muller-Steinhardt M. Individual variability in cyclosporin A sensitivity: the assessment of functional measures on CD28-mediated costimulation of human whole blood T lymphocytes. J Interferon Cytokine Res. 2003;23:91-99. [PubMed] |
| 4. | Gabryel B, Chalimoniuk M, Stolecka A, Waniek K, Langfort J, Malecki A. Inhibition of arachidonic acid release by cytosolic phospholipase A2 is involved in the antiapoptotic effect of FK506 and cyclosporin a on astrocytes exposed to simulated ischemia in vitro. J Pharmacol Sci. 2006;102:77-87. [PubMed] |
| 5. | Pompeo A, Baldassare M, Luini A, Buccione R. Cyclosporin A, but not FK506, increases arachidonic acid release and inhibits proliferation of pituitary corticotrope tumor cells. Life Sci. 1999;64:837-846. [PubMed] |
| 7. | 高 金亭, 郑 树森, 梁 廷波, 吴 丽花, 余 松峰, 金 晶, 吴 李鸣, 徐 世国. 环孢素A或他克莫司联合表阿霉素对肝癌细胞增殖、凋亡的影响. 中华医学杂志. 2006;86:345-347. |
| 8. | Graziadei IW, Sandmueller H, Waldenberger P, Koenigsrainer A, Nachbaur K, Jaschke W, Margreiter R, Vogel W. Chemoembolization followed by liver transplantation for hepatocellular carcinoma impedes tumor progression while on the waiting list and leads to excellent outcome. Liver Transpl. 2003;9:557-563. [PubMed] |
| 9. | Goldman B. Multidrug resistance: can new drugs help chemotherapy score against cancer? J Natl Cancer Inst. 2003;95:255-257. [PubMed] |
| 10. | Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science. 1995;267:1456-1462. [PubMed] |
| 11. | Kwon KB, Kim EK, Lim JG, Jeong ES, Shin BC, Jeon YS, Kim KS, Seo EA, Ryu DG. Molecular mechanisms of apoptosis induced by Scorpio water extract in human hepatoma HepG2 cells. World J Gastroenterol. 2005;11:943-947. [PubMed] |
| 12. | Tiu J, Li H, Rassekh C, van der Sloot P, Kovach R, Zhang P. Molecular basis of posttransplant squamous cell carcinoma: the potential role of cyclosporine a in carcinogenesis. Laryngoscope. 2006;116:762-769. [PubMed] |
| 13. | Huesker M, Folmer Y, Schneider M, Fulda C, Blum HE, Hafkemeyer P. Reversal of drug resistance of hepatocellular carcinoma cells by adenoviral delivery of anti-MDR1 ribozymes. Hepatology. 2002;36:874-884. [PubMed] |
| 14. | Guba M, Graeb C, Jauch KW, Geissler EK. Pro- and anti-cancer effects of immunosuppressive agents used in organ transplantation. Transplantation. 2004;77:1777-1782. [PubMed] |
| 15. | Kim JA, Kang YS, Lee YS. Role of Ca2+-activated Cl- channels in the mechanism of apoptosis induced by cyclosporin A in a human hepatoma cell line. Biochem Biophys Res Commun. 2003;309:291-297. [PubMed] |
| 16. | Waldmeier PC, Feldtrauer JJ, Qian T, Lemasters JJ. Inhibition of the mitochondrial permeability transition by the nonimmunosuppressive cyclosporin derivative NIM811. Mol Pharmacol. 2002;62:22-29. [PubMed] |
| 17. | Yoo HY, Patt CH, Geschwind JF, Thuluvath PJ. The outcome of liver transplantation in patients with hepatocellular carcinoma in the United States between 1988 and 2001: 5-year survival has improved significantly with time. J Clin Oncol. 2003;21:4329-4335. [PubMed] |
| 18. | Hatano E, Bradham CA, Stark A, Iimuro Y, Lemasters JJ, Brenner DA. The mitochondrial permeability transition augments Fas-induced apoptosis in mouse hepatocytes. J Biol Chem. 2000;275:11814-11823. [PubMed] |
| 19. | Kerstan A, Armbruster N, Leverkus M, Hunig T. Cyclosporin A abolishes CD28-mediated resistance to CD95-induced apoptosis via superinduction of caspase-3. J Immunol. 2006;177:7689-7697. [PubMed] |
| 20. | Yang B, Jain S, Ashra SY, Furness PN, Nicholson ML. Apoptosis and caspase-3 in long-term renal ischemia/reperfusion injury in rats and divergent effects of immunosuppressants. Transplantation. 2006;81:1442-1450. [PubMed] |
| 21. | Sutton DJ, Tchounwou PB. Mercury-induced externalization of phosphatidylserine and caspase 3 activation in human liver carcinoma (HepG2) cells. Int J Environ Res Public Health. 2006;3:38-42. [PubMed] |
| 22. | Mueller TH, Kienle K, Beham A, Geissler EK, Jauch KW, Rentsch M. Caspase 3 inhibition improves survival and reduces early graft injury after ischemia and reperfusion in rat liver transplantation. Transplantation. 2004;78:1267-1273. [PubMed] |
| 23. | Seki K, Yoshikawa H, Shiiki K, Hamada Y, Akamatsu N, Tasaka K. Cisplatin (CDDP) speci-fically induces apoptosis via sequential activation of caspase-8, -3 and -6 in osteosarcoma. Cancer Chemother Pharmacol. 2000;45:199-206. [PubMed] |
| 24. | Shin EC, Seong YR, Kim CH, Kim H, Ahn YS, Kim K, Kim SJ, Hong SS, Park JH. Human hepatocellular carcinoma cells resist to TRAIL-induced apoptosis, and the resistance is abolished by cisplatin. Exp Mol Med. 2002;34:114-122. [PubMed] |
| 25. | Sawada S, Mese H, Sasaki A, Yoshioka N, Matsumura T. Combination chemotherapy of paclitaxel and cisplatin induces apoptosis with Bcl-2 phosphorylation in a cisplatin-resistant human epidermoid carcinoma cell line. Cancer Chemother Ph. armacol. 2003;51:505-511. [PubMed] |
| 26. | Okamura M, Hashimoto K, Shimada J, Sakagami H. Apoptosis-inducing activity of cisplatin (CDDP) against human hepatoma and oral squamous cell carcinoma cell lines. Anticancer Res. 2004;24:655-661. [PubMed] |
| 27. | Poma P, Notarbartolo M, Labbozzetta M, Sanguedolce R, Alaimo A, Carina V, Maurici A, Cusimano A, Cervello M, D'Alessandro N. Anti-tumor effects of the novel NF-kappaB inhibitor dehydroxymethyl-epoxyquinomicin on human hepatic cancer cells: analysis of synergy with cisplatin and of possible correlation with inhibition of pro-survival genes and IL-6 production. Int J Oncol. 2006;28:923-930. [PubMed] |
| 28. | Iwase M, Watanabe H, Kondo G, Ohashi M, Nagumo M. Enhanced susceptibility of oral squamous cell carcinoma cell lines to FAS-mediated apoptosis by cisplatin and 5-fluorouracil. Int J Cancer. 2003;106:619-625. [PubMed] |
| 29. | Kinoshita H, Yoshikawa H, Shiiki K, Hamada Y, Nakajima Y, Tasaka K. Cisplatin (CDDP) sensitizes human osteosarcoma cell to Fas/CD95-mediated apoptosis by down-regulating FLIP-L expression. Int J Cancer. 2000;88:986-991. [PubMed] |
| 30. | Mese H, Sasaki A, Nakayama S, Alcalde RE, Matsumura T. The role of caspase family protease, caspase-3 on cisplatin-induced apoptosis in cisplatin-resistant A431 cell line. Cancer Chemother Pharmacol. 2000;46:241-245. [PubMed] |