修回日期: 2007-10-12
接受日期: 2007-10-28
在线出版日期: 2007-10-28
目的: 探讨COX-2抑制剂和survivin 反义寡核苷酸联合应用对胰腺癌BxPC-3细胞的抗肿瘤效应及其可能机制.
方法: 应用胰腺癌BxPC-3细胞进行研究, 将BxPC-3细胞分为4组: A组(对照组), B组(Celecoxib 80 μmol/L)组, C组(300 nmol/L survivin ASODN), D组(80 μmol/L celecoxib+300 nmol/L survivin ASODN). 采用MTT检测细胞增殖, 流式细胞仪检测细胞凋亡率, caspase-3试剂盒检测caspase-3活性, 并用RT-PCR检测Bcl-2、survivin 和Mcl-1的mRNA的变化.
结果: 将80 μmol/L celecoxib 和300 nmol/L survivin反义寡核苷酸单独或联合作用于胰腺癌BxPC-3细胞24 h和48 h, D组细胞的存活率明显低于B, C组(24 h: 41.0%±0.4% vs 71.0%±2.2%, 63.3%±4.5%; 48 h: 34.2%±1.1% vs 61.6%±1.7%, 55.0%±3%; P<0.01). 作用24 h后, 流式细胞仪检测细胞凋亡率显示, D组细胞的凋亡率明显高于B, C组(30.33%±3.49% vs 11.93%±1.17%, 22.07%±0.93%; P<0.01). caspase-3活性在B, C, D组明显高于对照组(0.04867±0.0021, 0.02967±0.0021, 0.08767±0.0042 vs 0.007±0.0001; P<0.01), D组细胞的caspase-3活性明显高于B, C组(0.08767±0.0042 vs 0.04867±0.0021, 0.02967±0.0021; P<0.01). 用100 μmol/L塞来昔布作用于胰腺癌BxPC-3细胞24 h后, survivin/β-actin和Mcl-1/β-actin的mRNA的比值明显低于对照组(0.68±0.05 vs 1.05±0.06, P<0.01), 而Bcl-2/β-actin的mRNA的比值无明显变化(0.99±0.02 vs 1.07±0.06, P>0.05).
结论: 联合应用COX-2抑制剂塞来昔布和survivin反义寡核苷酸可明显诱导胰腺癌细胞的凋亡, 抑制细胞增殖, 并能够明显提高caspase-3活性. COX-2抑制剂塞来昔布诱导细胞凋亡可能通过survivin和Mcl-1途径, 而非Bcl-2途径.
引文著录: 刘江伟, 张永久, 李开宗, 窦科峰, 许永华, 张东, 闫兵. COX-2抑制剂联合survivin反义寡核苷酸抗胰腺癌BxPC-3细胞的效应. 世界华人消化杂志 2007; 15(30): 3178-3183
Revised: October 12, 2007
Accepted: October 28, 2007
Published online: October 28, 2007
AIM: To investigate the effects of proliferation and apoptosis in pancreatic cancer cells treated by COX-2 inhibitor celecoxib in combination with survivin antisense oligonucleotides (ASODNs) and their possible mechanism of action.
METHODS: This study was carried out on the human pancreatic cancer BxPC-3 cell line. Cells were divided into four groups: A (control), B (celecoxib 80 μmol/L), C (survivin ASODN300 nmol/L), and D (80 μmol/L celecoxib + 300 nmol/L survivin ASODN). Cell proliferation was detected with the MTT colorimetric assay, the apoptosis rate in cells was measured by flow cytometry, and caspase-3 activity was evaluated using a caspase-3 assay kit. Using (Reverse Transcription Polymerase Chain Reaction) RT-PCR, we examined mRNA for Bcl-2, survivin and Mcl-1.
RESULTS: BxPC-3 cells were treated with celecoxib (80 μmol/L) and survivin ASODN (300 nmol/L) alone or in combination for 24 and 48 hours. Cell viability in group D was significantly lower than that in group B or C (24 hours, 41.0% ± 0.4% vs 71.0% ± 2.2% and 63.3% ± 4.5%; 48 hours, 34.2% ± 1.1% vs 61.6% ± 1.7% and 55.0% ± 3%; P < 0.01). After 24 hours, apoptosis measured by flow cytometry in group D was significantly higher than that in groups B or C (30.33% ± 3.49% vs 11.93% ± 1.17% and 22.07% ± 0.93%; P < 0.01). The caspase-3 activity was significantly increased in group B, C and D compared with the control group (0.04867 ± 0.0021, 0.02967 ± 0.0021 and 0.08767 ± 0.0042 vs 0.007 ± 0.0001; P < 0.01). Caspase-3 activity in group D was significantly higher than that in groups B and C (0.08767 ± 0.0042 vs 0.04867 ± 0.0021, 0.02967 ± 0.0021; P < 0.01). BxPC-3 cells were treated with celecoxib (100 μmol/L) for 24 hours. The grey ratio of mRNA amplified products for survivin/β-actin and Mcl-1/β-actin was significantly lower in the experimental groups than in the control group (0.68 ± 0.05 vs 1.05 ± 0.06; P < 0.01). However, Bcl-2/β-actin in the experimental and control groups did not differ significantly (0. 99 ± 0.02 vs 1.07 ± 0.06; P > 0.05).
CONCLUSION: The combination of celecoxib and survivin ASODNs induces apoptosis, inhibits proliferation and enhances caspase-3 activity. Celecoxib-induced apoptosis may be partly mediated through survivin and Mcl-1 and has no relation to Bcl-2.
- Citation: Liu JW, Zhang YJ, Li KZ, Dou KF, Xu YH, Zhang D, Yan B. Antitumor effects of COX-2 inhibitor in combination with survivin antisense oligonucleotides on pancreatic cancer BxPC-3 cells. Shijie Huaren Xiaohua Zazhi 2007; 15(30): 3178-3183
- URL: https://www.wjgnet.com/1009-3079/full/v15/i30/3178.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i30.3178
环氧化酶-2(COX-2)和凋亡抑制因子survivin是目前肿瘤研究领域的两个"热点". 我们先前的研究表明[1-6], COX-2和survivin在胰腺癌组织中过表达, 而在相邻的正常组织中不表达, 这两种基因的过表达与胰腺癌细胞的增殖、血管生成和细胞凋亡的抑制有关, 而且在胰腺癌组织中COX-2的表达与survivin的表达密切相关. 我们用COX-2抑制剂塞来昔布(celecoxib)或survivin反义寡核苷酸(ASODN)分别作用于胰腺癌BxPC-3细胞可抑制细胞增殖, 诱导细胞凋亡, 并增加胰腺癌细胞对化疗的敏感性. 因此, 我们推测将COX-2抑制剂塞来昔布和survivin反义寡核苷酸联合应用可能发挥更大的抗肿瘤效应, 并且可以减少细胞毒作用, 可能是胰腺癌治疗的有效途径. 我们还对其可能机制进行了探讨.
survivin ASODN序列[2,7]为5'-CCCAGCCTTCCAGCTCCTTG-3', 正义寡核苷酸(SODN)序列为: 5'-CAAGGAGCTGGAAGGCTGGG-3', 二者均经硫代磷酸化修饰(上海生工)celecoxib(Searle公司), 用1 kg/L二甲基亚砜(DMSO)溶解, 制成20 mol/L的储存液, -20℃保存. 阳离子脂质转染剂(lipofectaminetm 2000)系Gibco公司产品, RNA提取液(TRIzol)购自Life Technologies公司, RT-PCR购自TaKaRa公司, 胰腺癌BxPC-3细胞系购自第四军医大学口腔生物细胞培养库, 以含100 mL/L的新生小牛血清(56℃, 灭活30 min)、100 kU/L青霉素、100 mg/L链霉素的RPMI1640培养基(Gibco公司), 在37℃, 50 mL/L CO2饱和湿度条件下培养, 每2-3 d换液传代, 取对数期生长的细胞实验. MTT购自Sigma公司, Annexin V试剂盒购自Roche 公司, caspase-3比色检测试剂盒系Calbiochem 公司产品.
1.2.1 Celecoxib联合survivinASODN对细胞增殖的影响: 实验分为4组: 对照组不加入celecoxib或survivin ASODN, celecoxib(作用浓度为80 μmol/L)组, survivin ASODN(作用浓度300 nmol/L)组, 80 μmol/L celecoxib+300 nmol/L survivin ASODN组. 脂质体包被的survivin ASODN转染方法同前[2], 实验在96孔板上进行. 联合实验组中, 在survivin ASODN转染24 h时更换培养液后加入celecoxib, 然后开始作用24 h和48 h. 用MTT法[2,4]检测各组作用24 h和48 h时的吸光度值, 设3个复孔与空白对照组相比, 计算各组的相对存活率.
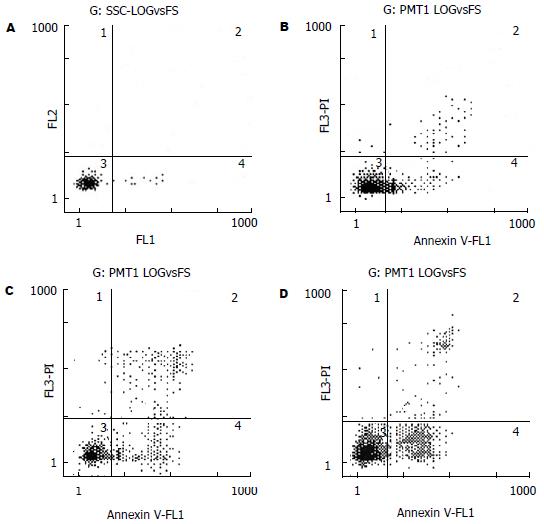
1.2.2 流式细胞术检测联合作用组细胞凋亡率: 实验分组同上. 细胞在50 mL培养瓶中进行培养, 脂质体包被的survivin ASODN转染方法同前[2]. 在联合实验组中, 在survivin ASODN转染24 h, 更换培养液后加入celecoxib. 各组作用BxPC-3细胞24 h, 收集细胞, 用Annexin V试剂盒在流式细胞仪检测细胞凋亡率, 方法同前[2]. 取3次实验的结果, 计算其平均凋亡率.
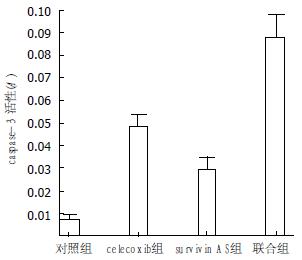
1.2.3 测定联合作用时caspase-3活性: 实验分组同上. 各组作用BxPC-3细胞24 h, 收集细胞, 用PBS冲洗, 离心2次. 参照文献[1]的方法应用caspase-3活性试剂盒, 实验重复2次用酶标免疫测定仪测定波长405 nm下的吸光度值来反映caspase-3相对活性的吸光度.
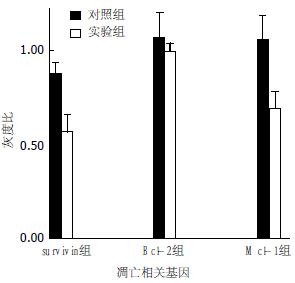
1.2.4 检测celecoxib对细胞Bcl-2, Mcl-1和survivin mRNA的影响: 分别用200 mL的培养瓶培养细胞至70%-80%铺满后, 根据加入的药物和浓度, 实验分对照组(未做处理)和100 µmol/L celecoxib组. 作用BxPC-3细胞24 h, 收获5×106细胞, 用RNA提取液(TRIzol, Life Technologies公司)提取总RNA. 取1 µg总RNA, 按试剂盒的方法组成20 µL反应体系. 用于逆转录合成cDNA的反应条件: 30℃, 10 min; 42℃, 30 min; 99℃, 5 min; 5℃, 5 min. 分别取逆转录产物2 µL为模板, 在25 µL PCR扩增反应体系按以下组成配制成PCR反应液: 各体系分别加入survivin的引物序列为5'-GTGAATTTTTGAAACTGGACAG-3'(F)和5'-CCTTTCCTAAGACATTGCTAAG-3'(R), 243 bp; 内参b-actin引物序列为5'-CTTC TACAATGAGCTGCGTG-3'(F)和5'-TCATGAGGTAGTCAGTCAGG-3'(R), 309 bp; Mcl-1为5'-ATCTCTCGGTACCTTCGGGAGC-3'(F)和5'-CTTGATGCCACCTTCTAGGTCC-3'(R), 444 bp; Bcl-2为5'-GACTTCGCCGAGATGTCCAG-3'(F)和5'-TCACTTGTGGCTCAGATAGG-3'(R), 390 bp. 将反应液放置 PCR循环仪中循环扩增, 扩增条件: 94℃预变性2 min, 94℃变性30 s, 退火30 s(survivin为51℃, β-actin为59℃, Mcl-1、Bcl-2均为61℃), 72℃延伸90 s, 32个循环后, 72℃延伸5 min. 经过变性后进入循环. PCR产物5 µL在20 g/L琼脂糖上电泳(含0.5 mg/L溴化乙锭), 经凝胶图像分析仪分析结果, 将survivin, Bcl-2和Mcl-1 PCR产物的电泳值分别与β-actin的比值做为各基因相对定量值, 来反映celecoxib作用后各个凋亡相关基因的变化. 实验进行3次, 取未处理的BxPC-3细胞做对照.
统计学处理 采用SPSS11.0进行作图和统计分析, 均数比较用t检验.
ASODN对细胞增殖的影响 24 h时, 单独应用celecoxib的细胞相对存活率为71.0%±2.2%, 单独应用survivin ASODN为63.3%±4.5%, 二者联合为41.0%±0.4%. 48 h时, 单独应用celecoxib的细胞相对存活率为61.6%±1.7%, 单独应用survivin ASODN为55.0%±3%, 二者联合为: 34.2%±1.1%. 在24 h和48 h, 与单独应用组相比, 联合组能明显降低细胞的存活率, 差异均有显著性(P<0.01).
作用24 h, 4组细胞凋亡率分别为0.26%±0.06%, 11.93%±1.17%, 22.07%±0.93%和30.33%±3.49%. 联合组凋亡率与单独组相比, 差异显著(P<0.01, 图1)
各实验组作用24 h, 4组caspase-3相对活性(A), 分别为0.007±0.0001, 0.04867±0.0021, 0.02967±0.0021和0.08767±0.0042, 联合组caspase-3相对活性与单独组相比, 差异显著(P<0.01, 图2).
100 μmol/L celecoxib作用BxPC-3细胞24 h, survivin, Mcl-1的表达明显低于对照组, 而Bcl-2的表达与对照组相比无明显变化. 经凝胶图像分析仪分析结果显示, 实验组和对照组survivin/β-actin分别为0.57±0.04和0.88±0.03, 两者之间差异具有显著性(P<0.01); Bcl-2/β-actin分别为0.99±0.02和1.07±0.06两者之间无显著性差异(P>0.05); Mcl-1/β-actin分别为0.68±0.05和1.05±0.06, 两者之间差异具有显著性(P<0.01)(图3).
survivin是凋亡抑制蛋白家族的新成员, 可能成为肿瘤治疗的"理想靶点"[8]. COX-2在各种肿瘤中高表达, 与促进肿瘤细胞的生长密切相关. COX-2选择性抑制剂celecoxib已被FDA批准用于家族性腺瘤性息肉的辅助治疗, 其在肿瘤的预防和治疗中的作用已引起学者的广泛关注[9]. 我们先前的研究发现, COX-2和survivin在胰腺癌组织中高表达, 而在相邻正常组织中不表达, 二者的高表达均与胰腺癌细胞增殖、血管生成、抗凋亡有关, 说明COX-2的表达和survivin密切相关[1-6]. Krysan et al[10]研究发现, COX-2 的表达限制survivin的泛化, 保护survivin免受降解, 说明COX-2依赖的survivin表达在非小细胞肺癌的抗凋亡过程起关键作用. 最近Barnes et al[11]发现, survivin在乳腺原位导管腺癌(DCIS)中的高表达与COX-2的表达密切相关, 二者的高表达与DCIS的复发密切相关. 根据这些研究及我们先前的研究, 我们推测以此基因为联合靶点的基因治疗可能是治疗胰腺癌的有效途径. 本实验在先前研究的基础上[2,4], 联合应用80 μmol/L celecoxib和300 nmol/L survivin反义寡核苷酸单独和联合应用作用于胰腺癌细胞24 h和48 h, 均能明显降低细胞的存活率, 差异具有显著性(P<0.01). 我们应用Annexin V试剂盒在流式细胞仪检测细胞凋亡率发现, 二者联合作用24 h, 细胞的凋亡率为30.33%±3.49%, 明显高于单独应用celecoxib(凋亡率11.93%±1.17%)和survivin ASODN(22.07%±0.93%), 差异具有显著性(P<0.01). 因而我们的研究表明, COX-2抑制剂和survivin反义寡核苷酸联合应用能够明显抑制细胞的增殖和诱导细胞凋亡.
目前研究认为, survivin主要通过直接作用于凋亡蛋白酶级联通路的终末效应因子caspase-3和caspase-7而发挥抗凋亡作用[12]. caspase-3是凋亡级联通路上的一个关键酶, 可被 caspase-8和caspase-9通过死亡受体(Fas/Fas配体系统)或线粒体信号系统激活, 因此所有的凋亡是通过激活caspase-3实现的[13]. Zhang et al[14]研究表明, celecoxib抑制细胞增生伴随着cyclin D1、cyclin E和p-Rb表达的下调, P16(INK4a)和P27(KIP)表达的上调以及G1-S细胞周期捕获, celecoxib的促凋亡效应由caspase-3的活性介导. 我们发现, celecoxib和survivin反义寡核苷酸作用于胰腺癌细胞后均可使caspase-3的活性明显增加, 二者联合应用caspase-3的活性明显高于二者单独应用, 差异具有显著性(P<0.01). 因而我们认为, COX-2抑制剂和survivin反义寡核苷酸诱导胰腺癌细胞凋亡, 可能在一定程度上通过激活caspase-3的活性实现的. 二者联合应用时细胞凋亡率明显增加, 可能是其共同启动caspase-3的活性的结果.
COX-2发挥细胞保护作用的机制尚未阐明, 可能归因于促凋亡因子和抗凋亡因子表达失衡. Catalano et al[15]研究发现, celecoxib以剂量和时间依从性方式诱导恶性间皮瘤细胞凋亡, 其过程包括Akt(又称蛋白激酶B)磷酸化减少, Bcl-2和survivin蛋白表达的缺失和caspase-3活性的增加. Wun et al[16]研究揭示, celecoxib不影响B细胞淋巴瘤的Bcl-2、Bcl-xl和Bax的水平. 然而Akt, Mcl-1和磷酸化的SAP-激酶的水平降低. 在人类膀胱癌细胞, COX-2抑制细胞凋亡通过激活PI-3K/Akt途径并且可能通过增加Mcl-1的表达来实现[17]. Mcl-1是Bcl-2家族的抗凋亡成员, Mcl-1的过表达可保护肿瘤细胞免受药物诱导的细胞凋亡[18]. 我们的研究发现, celecoxib作用于胰腺癌BxPC-3后, survivin和Mcl-1的表达明显降低, 而Bcl-2的表达无明显变化, 说明COX-2抑制剂诱导胰腺癌细胞凋亡的机制可能主要通过抑制survivin和Mcl-1来实现的.
总之, 我们的研究表明, COX-2抑制剂和survivin反义寡核苷酸联合应用可在抑制细胞增殖和诱导细胞凋亡过程中起协同作用, COX-2抑制剂诱导胰腺癌细胞凋亡的可能机制主要是通过抑制survivin和Mcl-1以及提高caspase-3的活性来实现的.
还氧化酶-2(COX-2)在各种肿瘤中高表达, 与促进肿瘤细胞的生长密切相关. COX-2选择性抑制剂 celecoxib已被FDA批准用于家族性腺瘤性息肉的辅助治疗, 其在肿瘤的预防和治疗中的作用已引起学者的广泛关注.
胰腺癌组织中COX-2的表达与survivin的表达密切相关. 作者先前的研究用COX-2抑制剂塞来昔布(celecoxib)或survivin 反义寡核苷酸(ASODN)分别作用于胰腺癌BxPC-3细胞可抑制细胞增殖, 诱导细胞凋亡, 并增加胰腺癌细胞对化疗的敏感性.
COX-2抑制剂和survivin反义寡核苷酸联合应用可在抑制细胞增殖和诱导细胞凋亡过程中起协同作用, 从而发挥更大的抗肿瘤效应, 并且可以减少细胞毒作用, 可能是胰腺癌治疗的有效途径.
survivin是凋亡抑制蛋白家族的新成员, 是目前发现的最强的凋亡抑制因子, 因其在肿瘤组织表达具有特异性, 可能成为肿瘤治疗的"理想靶点", 此二者为目前肿瘤研究领域的"热点".
本文立意新颖, 课题设计合理, 严谨, 所用方法较先进, 实验结果可靠, 并且有一定的临床指导意义.
编辑: 程剑侠 电编:李军亮
| 1. | 刘 江伟, 张 永久, 皇甫 清风, 李 开宗, 张 东, 雷 涛. Survivin反义寡核苷酸对胰腺癌荷瘤裸鼠的治疗作用. 世界华人消化杂志. 2006;14:2838-2843. [DOI] |
| 2. | 刘 江伟, 李 开宗, 窦 科峰, 苏 明权, 于 文彬, 张 福琴. Survivin反义寡核苷酸诱导胰腺癌细胞凋亡并增加吉西他滨的化疗敏感性. 中华普通外科杂志. 2004;19:401-403. |
| 4. | 刘 江伟, 李 开宗, 窦 科峰, 宋 振顺, 苏 明权, 于 文彬. COX-2抑制剂联合顺铂对胰腺癌细胞增殖和凋亡的影响. 世界华人消化杂志. 2004;12:1139-1143. [DOI] |
| 7. | Olie RA, Simoes-Wust AP, Baumann B, Leech SH, Fabbro D, Stahel RA, Zangemeister-Wittke U. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy. Cancer Res. 2000;60:2805-2809. [PubMed] |
| 8. | Dai DJ, Lu CD, Lai RY, Guo JM, Meng H, Chen WS, Gu J. Survivin antisense compound inhibits proliferation and promotes apoptosis in liver cancer cells. World J Gastroenterol. 2005;11:193-199. [PubMed] |
| 9. | Williams LJ, Guernsey DL, Casson AG. Biomarkers in the molecular pathogenesis of esophageal (Barrett) adenocarcinoma. Curr Oncol. 2006;13:33-43. [PubMed] |
| 10. | Krysan K, Dalwadi H, Sharma S, Pold M, Dubinett S. Cyclooxygenase 2-dependent expression of survivin is critical for apoptosis resistance in non-small cell lung cancer. Cancer Res. 2004;64:6359-6362. [PubMed] |
| 11. | Barnes N, Haywood P, Flint P, Knox WF, Bundred NJ. Survivin expression in in situ and invasive breast cancer relates to COX-2 expression and DCIS recurrence. Br J Cancer. 2006;94:253-286. [PubMed] |
| 12. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and -7. Biochemistry. 2001;40:1117-1123. [PubMed] |
| 13. | Janicke RU, Sprengart ML, Wati MR, Porter AG. Caspase-3 is required for DNA fragmentation and morphological changes associated with apoptosis. J Biol Chem. 1998;273:9357-9360. [PubMed] |
| 14. | Zhang GS, Liu DS, Dai CW, Li RJ. Antitumor effects of celecoxib on K562 leukemia cells are mediated by cell-cycle arrest, caspase-3 activation, and downregulation of Cox-2 expression and are synergistic with hydroxyurea or imatinib. Am J Hematol. 2006;81:242-255. [PubMed] |
| 15. | Catalano A, Graciotti L, Rinaldi L, Raffaelli G, Rodilossi S, Betta P, Gianni W, Amoroso S, Procopio A. Preclinical evaluation of the nonsteroidal anti-inflammatory agent celecoxib on malignant mesothelioma chemoprevention. Int J Cancer. 2004;109:322-328. [PubMed] |
| 16. | Wun T, McKnight H, Tuscano JM. Increased cyclooxygenase-2 (COX-2): a potential role in the pathogenesis of lymphoma. Leuk Res. 2004;28:179-190. [PubMed] |
| 17. | Choi EM, Kwak SJ, Kim YM, Ha KS, Kim JI, Lee SW, Han JA. COX-2 inhibits anoikis by activation of the PI-3K/Akt pathway in human bladder cancer cells. Exp Mol Med. 2005;37:199-203. [PubMed] |