修回日期: 2007-09-29
接受日期: 2007-09-28
在线出版日期: 2007-10-28
目的: 研究胃肠舒对胃肠平滑肌细胞动能的影响.
方法: 胃肠平滑肌细胞离体培养, 分为5组: 空白对照组、西沙必利组(0.51 g/L)、胃肠舒Ⅰ组(25 g/L)、胃肠舒Ⅱ组(50 g/L)、胃肠舒Ⅲ组(75 g/L), 采用Celltiter-GloTM法和Rhodamine fluorescence法分别检测胃肠舒对胃肠平滑肌细胞ATP和线粒体跨膜电位的的影响.
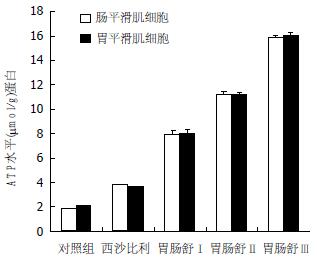
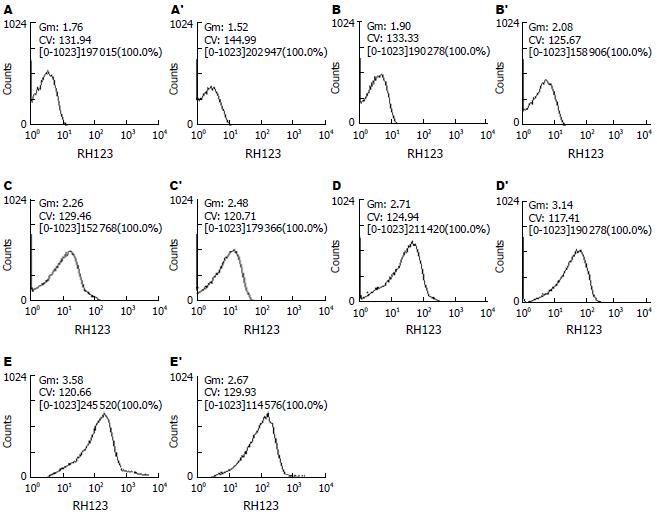
结果: 胃肠舒作用24 h后与对照组和西沙必利组相比能显著增高平滑肌细胞ATP的含量. 随着胃肠舒用药浓度的增加改变ATP的含量也加大(P<0.05). 流式细胞仪结果表明, 胃肠舒明显加大了胃肠平滑肌细胞的线粒体跨膜电位, 并且随着胃肠舒用药浓度的增加, 跨膜电位的增加也越大.
结论: 胃肠舒可能通过改变胃肠平滑肌细胞的动能促进胃肠运动.
引文著录: 宋晓冬, 刘孟安, 孙丰润, 刘颖, 张丽霞, 牛新华, 闫苗苗, 王晓江. 中药胃肠舒对胃肠平滑肌细胞ATP生成的影响. 世界华人消化杂志 2007; 15(30): 3159-3162
Revised: September 29, 2007
Accepted: September 28, 2007
Published online: October 28, 2007
AIM: To study the effect of Weichangshu on the kinetic energy of gastrointestinal smooth muscle cells.
METHODS: Gastrointestinal smooth muscle cells were divided into five groups: control, cultured in normal medium; cisapride, cultured in normal medium with 0.51 g/L cisapride; Weichangshu Ⅰ, cultured in normal medium with 25 g/L Weichangshu; Weichangshu Ⅱ, cultured in normal medium with 50 g/L Weichangshu; and Weichangshu Ⅲ, cultured in normal medium with 75 g/L Weichangshu. Celltiter-Glo was used to detect ATP. The relative changes in mitochondrial potential were tested with the rhodamine fluorescence (R-123) technique.
RESULTS: After exposure to Weichangshu for 24 hours, the change in ATP content was more significant (P < 0.05) and the intensity of R-123 fluorescence in gastrointestinal smooth muscle cells was significantly increased compared with those in the control and cisapride groups. As the Weichangshu concentration increased, so did the content of ATP and mitochondrial potential.
CONCLUSION: Weichangshu may change the kinetic energy of gastrointestinal smooth muscle cells, leading to an improvement in gastrointestinal motility.
- Citation: Song XD, Liu MA, Sun FR, Liu Y, Zhang LX, Niu XH, Yan MM, Wang XJ. Effect of traditional Chinese medicine Weichangshu on ATP in gastrointestinal smooth muscle cells. Shijie Huaren Xiaohua Zazhi 2007; 15(30): 3159-3162
- URL: https://www.wjgnet.com/1009-3079/full/v15/i30/3159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i30.3159
胃肠运动障碍型疾病是临床常见病, 据国内统计约占胃肠专科门诊患者1/3以上, 西方国家患病率高达20%-40%. 现临床最常用的促胃肠动力药有胃复安、吗丁啉、西沙必利等化学药. 化学药促进胃肠蠕动虽然有较好疗效, 但其副作用如药理作用受限、催乳素增加、焦虑、激动、运动性不安、共济失调、腹泻、腹痛等不可忽视[1-2], 且易于复发. 而中药制剂具有治疗与调理双层作用, 受到广大胃病患者的欢迎. 但目前国内外有关中药胃肠动力药的研究少见报道, 因此开发中药治疗该类疾病具有重要意义[3]. 纯中药制剂胃肠舒是根据《伤寒论》大承气汤、小承气汤、调胃承气汤三方化裁, 取大黄、枳壳、甘草组方, 经临床反复药物筛选研制而成, 具有完全知识产权. 预实验[4-7]显示, 胃肠舒对胃轻瘫综合征的疗效优于吗丁啉, 对小鼠子宫切除术后肠道推进作用优于西沙必利, 能显著加快小鼠胃肠推进运动, 兴奋兔离体肠平滑肌, 并且无明显副作用, 比单味中药更切合临床实际, 比汤剂更方便. 因此我们在离体胃肠平滑肌细胞模型上进一步探讨胃肠舒的促胃肠动力的作用及其机制.
胃肠舒由滨州医学院附属医院制剂室提供, 西沙必利浙江京新药业股份有限公司生产, 标准SD大白鼠由烟台绿叶实验动物中心提供, DMEM培养基购自GiBco公司, 胎牛血清购自杭州四季青生物工程材料公司, Rhodamine123购自Sigma公司, CellTiter-GloTM 试剂盒购自Promega公司, Labsystems Multiskan MS酶标仪和HERA CO2培养箱及CK×41倒置显微镜购自Olympus, EPICS XL流式细胞仪购自美国贝克曼库尔特公司, IX71荧光倒置显微镜购自日本奥雷帕斯公司.
选择标准SD大白鼠, 体质量为180-200 g, 雌雄各半, 乙醚麻醉, 剖腹后迅速剪取胃体、空肠组织, PBS清洗后剪碎, 去除上清液, 重复清洗2-3次. 将盛有组织碎片的容器置于冰上, 去除残留的上清液, 加入2.5 g/L胰蛋白酶, 在4℃孵育6-18 h. 移弃组织碎片中的胰蛋白酶, 在37℃孵育包含残留胰蛋白酶的组织碎片20-30 min. 待小块组织完全消化溶解后, 过200目网, 1000 r/min离心7 min. 弃上清液, 向细胞沉淀中加入新鲜配制的200 mL/L胎牛血清DMEM培养液, 轻轻吹打, 后按每瓶(25 mL)3×104活细胞接种在培养瓶里, 放入37℃孵箱里静置培养待测, CK×41倒置相差显微镜观察. 将处理好的盖玻片, 放入6孔板使之与孔底贴和紧密, 进行细胞培养. 细胞生长5 d后吸去培养液, 先用PBS洗涤已贴壁盖玻片2-3次. 950 mL/L乙醇室温固定20 min, PBS洗2-3次. 1 mL/L TritonX-100室温孵育20-30 min增强细胞通透性. 正常羊血清于37℃封闭20 min. 滴加一抗兔抗鼠α-actin mAb(1:200, 购自Sigma公司)室温过夜, 滴加二抗羊抗兔FITC-IgG(1:100), 37℃孵育2 h, 倒置荧光显微镜(波长500 nm)观察.
实验分为5组, 分别为空白对照组、胃肠舒小剂量组Ⅰ组(25 g/L)、胃肠舒中剂量组Ⅱ组(50 g/L)、胃肠舒大剂量组Ⅲ组(75 g/L)、西沙必利组(0.51 g/L). 每组6个复孔, 各组药物作用24 h, Celltiter-GloTM试剂盒A液和B液混合, 室温下静置1 h. 向96孔板的各孔细胞中每孔加入100 μL Celltiter-GloTM混合液, 5 min后酶标仪波长562 nm检测胃肠平滑肌细胞ATP含量. 另将待测胃肠平滑肌细胞离心1000 r/min收集, PBS清洗2次, 加入1 mL的终浓度为1 mg/L的Rhodamine123, 放入37℃孵箱里静置培养45 min. PBS清洗2次, 倾去原有液体, 250 μL PBS重悬, 缓慢加入-20℃乙醇750 μL, 流式细胞仪激发波长488 nm、发射波长525 nm检测胃肠平滑肌细胞线粒体跨膜电位.
统计学处理 组间比较用方差检验, P<0.05为差异有统计学意义.
倒置显微镜下观察可见细胞形状椭圆形, 束状排列, 密集与稀疏处相互交错呈"峰谷"状. 峰处为多层细胞, 谷处为单层或双层细胞, 培养4 d后细胞铺满培养瓶瓶底. 为确定胃肠平滑肌细胞离体分离培养成功, 用兔抗鼠α-actin mAb进行鉴定, 细胞经漂洗后置于荧光显微镜下观察. 负载了FITC的细胞经500 nm的波长激发下产生荧光, 可见95%以上的细胞显示阳性荧光标记, 说明离体培养的平滑肌细胞成功.
胃肠舒片作用24 h后能显著增高平滑肌细胞ATP的含量. 随着胃肠舒用药浓度的增加改变ATP的含量也加大, ATP的改变量与正常对照组和西沙比利组进行t检验(P<0.05)(图1).
胃肠舒组细胞荧光分析图与对照组相比右移, 表示线粒体跨膜电位上升. 胃肠舒实验组明显比空白对照组增大线粒体的跨膜电位, 比西沙必利组改变线粒体跨膜电位的幅度也大, 并且随着胃肠舒用药浓度的增加, 胃肠平滑肌细胞线粒体跨膜电位随之增加(图2).
从中医学观点看, 胃肠运动障碍型疾病多由于脾胃功能失调, 升降失司, 气机不畅所致. 治疗重在调理脾胃功能, 协调升降, 舒畅气机. 本研究的对象胃肠舒片方中大黄通胃肠腑气, 泻胃肠积滞为君药; 枳实行气消胀, 破积除满为臣药; 甘草健脾益气, 甘缓和中, 调和诸药, 防大黄攻下伤正为佐使. 故诸药相互配伍, 具有调和脾胃升降, 疏通胃肠气机的功效, 使肠胃升降功能得以恢复而达到治疗目的. 从现代医学观点看, 胃肠运动障碍型疾病多由胃肠运动功能失调, 能量供应不足导致胃排空时间延长所致. 线粒体是真核细胞能量转换的主要场所, 是细胞生成ATP的主要地点[8]. 线粒体基质的三羧酸循环酶系通过底物脱氢氧化生成NADH, NADH通过线粒体内膜呼吸链氧化. 与此同时, 导致跨膜质子移位形成跨膜质子梯度和/或跨膜电位. 线粒体内膜上的ATP合成酶利用跨膜电位合成ATP. 合成的ATP, 通过线粒体内膜ADP/ATP载体与细胞质中ADP交换进入细胞质, 参与细胞的各种需能过程[9-12]. 因此线粒体跨膜电位和ATP的变化直接影响细胞的动能, 继而会影响相应组织的运动能力. 通常线粒体跨膜电位和ATP水平的升高表明线粒体功能增强, 能量供应充足, 动能增加, 细胞/组织运动能力加强. 本实验流式细胞仪检测结果显示, 中药胃肠舒实验组与空白对照组和西沙必利组相比, 其荧光分析折线图明显右移, 线粒体跨膜电位大大增加, 与此同时, 其ATP的含量也明显增加, 并且线粒体跨膜电位和ATP增加的幅度与胃肠舒的用药浓度成正比关系. 当然, 胃肠道神经系统对胃肠运动功能的调节支配较为复杂, 目前已知胃肠道神经系统中最主要的兴奋性神经递质是乙酰胆碱(acetylcholine, Ach)[13-16], 最主要的抑制性神经递质是一氧化氮(NO). 有研究表明, Ach和NO之间在调节胃肠动能时存在着精细的平衡[17-18], 当失去平衡尤其是NO增加而Ach减少时, 能引起线粒体跨膜电位和ATP的变化, 导致胃肠运动功能障碍. 本实验中胃肠舒对这两类神经递质是否有影响以及如何影响将在进一步的实验中确认. 本项目对于阐释中药促进胃肠动力的作用机制提供了科学的实验数据, 为开发胃肠动力中药新药开辟了新的思路, 奠定了坚实的实验理论基础, 意义重大.
胃肠运动障碍型疾病是临床多发病, 其主要病理生理基础为胃排空延迟及小肠传输功能障碍, 现临床最常用的促胃肠动力药促进胃肠蠕动虽然有较好疗效, 但其副作用如药理作用受限、催乳素增加、焦虑、激动、运动性不安、共济失调、腹泻和腹痛等不可忽视. 目前胃肠运动障碍型疾病由于发病机制尚不清楚, 其药物的研发受到限制, 因此研究该类疾病的调控机制, 为开发新药提供科学的数据是非常重要的.
本文的前期预实验结果显示胃肠运动障碍型疾病模型鼠与正常鼠比较其平滑肌细胞跨膜电位和ATP有明显的变化, Ach的表达也相应发生变化, 在大量前期预实验的结果上推测Ca2+信号传导途径在其中可能起到很重要的调控作用, 而对于Ca2+信号传导途径在胃肠运动障碍型疾病中的作用及其调控国内外尚未见相关报道, 本项目的完成将填补胃肠运动障碍型疾病中Ca2+信号传导途径的调控作用的研究空白.
本文拟以乙酰胆碱和一氧化氮为主要研究出发点, 建立胃肠功能障碍动物实验模型和细胞实验模型, 深入研究胃肠舒片的作用及其作用机制, 为胃肠舒片的推广应用奠定坚实的实验理论基础, 提供科学的实验数据.
本文采用的方法较先进, 具有一定的创新性, 对临床具有一定的应用价值.
编辑: 何燕 电编:李军亮
| 8. | Huang M, Camara AK, Stowe DF, Qi F, Beard DA. Mitochondrial inner membrane electrophysiology assessed by rhodamine-123 transport and fluorescence. Ann Biomed Eng. 2007;35:1276-1285. [PubMed] |
| 9. | von Kleist-Retzow JC, Hornig-Do HT, Schauen M, Eckertz S, Dinh TA, Stassen F, Lottmann N, Bust M, Galunska B, Wielckens K. Impaired mitochondrial Ca2+ homeostasis in respiratory chain-deficient cells but efficient compensation of energetic disadvantage by enhanced anaerobic glycolysis due to low ATP steady state levels. Exp Cell Res. 2007;313:3076-3089. [PubMed] |
| 10. | Mironova GD, Kachaeva EV, Kopylov AT. Mitochondrial ATP-dependent potassium channel. 1. The structure of the channel, the mechanisms of its functioning and regulation. Vestn Ross Akad Med Nauk. 2007;34-43. [PubMed] |
| 11. | Liang H, Van Remmen H, Frohlich V, Lechleiter J, Richardson A, Ran Q. Gpx4 protects mitochondrial ATP generation against oxidative damage. Biochem Biophys Res Commun. 2007;356:893-898. [PubMed] |
| 12. | Comelli M, Metelli G, Mavelli I. Downmodulation of mitochondrial F0F1 ATP synthase by diazoxide in cardiac myoblasts: a dual effect of the drug. Am J Physiol Heart Circ Physiol. 2007;292:H820-H829. [PubMed] |
| 13. | Phillis JW. Acetylcholine release from the central nervous system: a 50-year retrospective. Crit Rev Neurobiol. 2005;17:161-217. [PubMed] |
| 14. | Alcayaga C, Varas R, Valdes V, Cerpa V, Arroyo J, Iturriaga R, Alcayaga J. ATP- and ACh-induced responses in isolated cat petrosal ganglion neurons. Brain Res. 2007;1131:60-67. [PubMed] |
| 15. | Reyes EP, Alcayaga J, Zapata P. Are there interactions between acetylcholine- and ATP-induced responses at the level of a visceral sensory ganglion? Brain Res. 2006;1107:97-103. [PubMed] |
| 17. | Clementi E, Nisoli E. Nitric oxide and mitochondrial biogenesis: a key to long-term regulation of cellular metabolism. Comp Biochem Physiol A Mol Integr Physiol. 2005;142:102-110. [PubMed] |