修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-01-28
目的: 建立一个成功率高、简单、易行、价廉、短期成功的结肠炎相关的结肠癌模型.
方法: 5周龄ICR♂小鼠320只, 随机分为实验组(1-7)和阴性(8)对照组. 实验1-3组分别ip 10, 15, 20 mg/kg的1, 2-二甲肼(DMH) 1wk后, 再给予小鼠饮用含20 g/L的右旋葡聚糖苷钠(DSS)饮用水1 wk. 实验4-6组的小鼠仅通过ip给予10, 15, 20 mg/kg的DMH. 实验7组小鼠则只饮用含20 g/L DSS的饮用水, 第8组小鼠不给予任何处理. 每周记录小鼠体质量及进食量, 在4, 9, 13 wk分别处死部分小鼠以观察小鼠的结肠炎癌变情况, 并于20 wk处死剩余小鼠.
结果: ip DMH(10, 15, 20 mg/kg) 1 wk后, 再饮用含20 g/L DSS的饮用水1 wk. 4 wk可见40%小鼠便血. 1 wk后, 便血消失. 至9 wk时, 约有30%的小鼠再次出现便血体征. 13 wk时, 约10%的小鼠出现脱肛现象. 20 wk时, 40%左右的小鼠出现脱肛现象. 在20 wk 100% ♂ ICR小鼠出现结肠腺癌, 称取脾脏、胸腺以及结肠质量, 结果发现, 脾脏、结肠质量显著增加, 胸腺质量明显减少, 与对照组小鼠相比有显著性差异(脾脏质量: 0.64±0.03, 0.75±0.03, 0.78±0.01 g vs 0.16±0.05 g, P<0.01; 结肠质量: 0.93±0.06, 0.96±0.02, 0.01±0.06 g vs 0.31±0.06 g, P<0.01; 胸腺质量: 0.027±0.001 g vs 0.045±0.004 g, P<0.05; 0.026±0.002 g vs 0.045±0.004 g, P<0.05; 0.016±0.003 g vs 0.045±0.004 g, P<0.01).
结论: 致癌剂DMH和致炎剂DSS可诱导ICR小鼠结肠腺癌的形成, 较好的模拟了结肠炎癌变过程, 方法价廉、简便、易行.
引文著录: 李宇华, 刘莉, 冯娟, 王庆伟, 孙阳, 曹蔚, 王志鹏, 张蓉, 刘振国, 梅其炳. 一种结肠炎相关的结肠癌模型的复制. 世界华人消化杂志 2007; 15(3): 234-239
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: January 28, 2007
AIM: To duplicate a colitis-related colorectal cancer model that is cheap, simple and accessible.
METHODS: A total of 320 male ICR mice were randomly divided into 7 experimental groups (group A-G) and 1 control group. Groups A, B and C were given a single intraperitoneal injection of 1, 2-dimethylhydrazine (DMH) at the dose of 10, 15 and 20 mg/kg body weight, respectively. one week after injection, the animals in group A, B and C were treated with 20 g/L dextran sodium sulfate (DSS) in drinking water for consecutive 7 days. Group D, E and F were administered with DMH 10, 15 and 20 mg/kg body weight only, respectively. Group G was given 20 g/L DSS only. The weight and food intake of mice in each group were recorded every week. Several mice were killed to observed the progression to carcinoma of colitis in week 4, 9 and 13. All the mice were executed for observation in week 20.
RESULTS: After administered with DMH and DSS, the bloody stools appeared in 40% mice in week 4, 30% in week 9, and rectal prolapse was observed in 10% mice in week 13, 40% in week 20. Within 20 weeks, all the mice, which had been given DMH and DSS, developed colonic adenocarcinoma. The weights of spleen and colon were increased significantly, while the weight of thymus was decreased obviously in group A, B, C in comparison with those in the control group (spleen: 0.64 ± 0.03, 0.75 ± 0.03, 0.78 ± 0.01 g vs 0.16 ± 0.05 g, P < 0.01; colon: 0.93 ± 0.06, 0.96 ± 0.02, 0.01 ± 0.06 g vs 0.31 ± 0.06 g, P < 0.01; thymus: 0.027 ± 0.001 g vs 0.045 ± 0.004 g, P < 0.05; 0.026 ± 0.002 g vs 0.045 ± 0.004 g, P < 0.05; 0.016 ± 0.003 g vs 0.045 ± 0.004 g, P < 0.01).
CONCLUSION: DMH and DSS can effectively induce the formation of colonic cancer in ICR mice, which can well simulate the progression of colitis to carcinoma. The method used in this study is a cheap, simple and accessible.
- Citation: Li YH, Liu L, Feng J, Wang QW, Sun Y, Cao W, Wang ZP, Zhang R, Liu ZG, Mei QB. A novel model of colitis-related colorectal cancer. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 234-239
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/234.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.234
人类癌症的流行病学研究和许多实验室癌症动物模型研究表明, 化学致癌剂是诱导人类癌症发生的重要因素之一. 目前, 由于国人饮食结构的日渐西化: 摄入高热量、高蛋白, 低纤维的食品, 使得周围环境以及食物中所含的潜在性化学致癌剂更易诱导结肠肿瘤发生. 据报道, 上海市的结肠癌发病率、病死率均明显升高. 在众多恶性肿瘤中, 其病死率已跃居第2位. 流行病学实验表明, 结肠癌的发生、发展与结肠炎症的反复发作密切相关. 结肠炎癌变主要决定于结肠炎的发生程度、发生部位及病程长短[1-9]. 实验表明, 20年以上的结肠炎患者癌变率可达40%. 然而结肠炎发展为结肠癌的病理机制尚不清楚, 结肠炎相关的结肠癌动物模型尚不成熟. 2004年我国学者Wang et al[10], 2005年日本学者Kohno et al[11-12]采用致癌剂联合致炎剂复制了与人类的癌症发生过程相类似的结肠炎相关的结肠癌模型, 但是作者对于模型复制的发展过程尚无详细报道. 本实验室对日本学者报道的复制结肠癌模型方法进行改良, 并对结肠癌的发生时间、发展过程作报道. 以期为结肠癌相关药物的开发评价提供相应的动物模型.
♂5周龄CD-1(ICR)小鼠320只, 购于上海斯莱克实验动物中心. 小鼠购回后饲养在第四军医大学实验动物中心. 5只一组, 饲养于代谢笼内, 给予自由饮水、饲以普通的颗粒饲料. 饲养环境: 湿度(50%±10%), 光照(12 h照明, 12 h黑暗交替), 温度(23±2℃). 适应饲养7 d后, 按照体质量被随机分为给药组和对照组. 每周记录动物摄食量及动物体质量, 观察动物的尿液. 1, 2-二甲肼(DMH)购于Sigma公司, 右旋葡聚糖苷钠(DSS), 相对分子质量为36 000-50 000, 购于美国ICN公司.
1.2.1 小鼠结肠癌模型复制: 320只ICR小鼠被随机分为7个给药组和1个对照组(每组40只), 实验重复3次(每次分组情况相同), 实验时间为20 wk. 其中第1次实验小鼠为80只, 后两次均为120只. 将DMH溶于生理盐水中, 使其终浓度分别为10, 15, 20 mg/kg, 用0.25 mol/L NaOH调整pH值至6.5. 实验组1, 2和3的小鼠通过ip分别给予10, 15, 20 mg/kg DMH. 1 wk后, 在这3组小鼠的饮水中添加DSS(浓度为20 g/L), 给予小鼠连续饮用7 d. 实验组4, 5, 6分别给予10, 15, 20 mg/kg剂量的DMH. 实验组7的小鼠, 仅在其饮水中添加DSS. 第8组为对照组, 不作任何处理.
1.2.2 小鼠结肠癌模型指标评价: 所有小鼠按常规饲养. 分别在小鼠出现便血(给予DMH后的第4, 9周)、脱肛(第13周)体征的时间点, 于每组中随机抽取4只, 以乙醚麻醉处死. 第20周时处死全部剩余小鼠. 剪开小鼠腹腔, 在冰浴中, 截取其大肠(从肛门处到回盲部), 用生理盐水冲洗后, 测量其长度. 然后, 截取从肛门向上约3 cm处的结肠, 长度约1 cm, 浸泡于40 g/L的福尔马林固定液中24 h. 组织包蜡后切片, 以备做HE染色, 摘取所有的脏器称质量.
给予DMH后小鼠的摄食量无明显变化、动物自主活动及毛色正常, 接着给予DSS后, 小鼠的摄食量有所下降、动物自主活动正常. 在注射完DMH后, 约有10%的20 mg/kg DMH剂量组的小鼠(第3组2只、第4组1只)4-5 d死于肝坏死. 约有40%给予20 g/L DSS的小鼠在饮用DSS的过程中或3-4 d后(第14-24天)出现便血, 同时体质量有所下降但无显著性差异, 1 wk后(第28-32天时), 血便消失. 至给药造模第9周(第63-70天), 约有30%的小鼠(主要是第2, 3组小鼠)再次出现血便体征. 第13周(91-96 d), 约10%的小鼠出现脱肛现象. 第20周, 40%左右的小鼠出现脱肛现象(表1).
| 分组 | 阳性体征(发生率) | |||
| 血便 (3-4 wk) | 血便 (9-10 wk) | 脱肛 (13-14 wk) | 脱肛 (20 wk) | |
| 1 | 21(52.5%) | 12(34.3%) | 4(13.3%) | 20(100%) |
| 2 | 25(62.5%) | 21(60%) | 11(36.6%) | 21(100%) |
| 3 | 31(77.5%) | 24(68.6%) | 20(66.7%) | 28(100%) |
| 4 | 1(2.5%) | 2(5.26%) | 0(0) | 0(0) |
| 5 | 2(5%) | 6(15.6%) | 0(0) | 1(7.1%) |
| 6 | 3(7.5%) | 4(10.5%) | 0(0) | 2(12.5%) |
| 7 | 13(32.5%) | 8(21.6%) | 0(0) | 0(0) |
| 8 | 0(0) | 0(0) | 0(0) | 0(0) |
给药后, 每只小鼠的进食量和体质量与给药前以及正常小鼠相比, 并无显著性变化. 从第13周开始, 1-3组小鼠, 其平均进食量、体质量有所下降. 但与其他组相比, 无显著性差异. 这与我们所设想的炎症、癌症将导致小鼠进食量和体质量有显著性下降并不一致. 造模全过程中, 实验组小鼠尿量与对照组相比, 无明显差异, 尿液颜色正常, 无特殊气味. 尿液中白细胞、红细胞及蛋白含量等指标也无显著性改变.
在不同时间点处死小鼠, 称取脾脏、胸腺以及结肠质量. 结果表明: 大约30%的小鼠肠道呈现炎症反应, 脾脏、结肠质量显著增加、胸腺质量明显减小, 与对照组小鼠相比有显著性差异(P<0.05). 而有肠道肿瘤的小鼠(约占95%), 其脾脏和结肠重量增加更加明显(P<0.01)、而胸腺重量显著减小(P<0.01, 表2).
| 分组 | 药物处理(n) | 体质量(g) | 脾脏质量(g) | 胸腺质量(g) | 大肠质量(g) |
| 1 | DMH 10 mg/kg→20 g/L DSS(18) | 42.3±2.5a | 0.64±0.03b | 0.027±0.001a | 0.932±0.06b |
| 2 | DMH 15 mg/kg→20 g/L DSS(14) | 43.1±2.8 | 0.75±0.03b | 0.026±0.002a | 0.956±0.02b |
| 3 | DMH 20 mg/kg→20 g/L DSS(12) | 44.1±3.9 | 0.78±0.01b | 0.016±0.003b | 1.008±0.06b |
| 4 | DMH 10 mg/kg(14) | 43.9±2.8 | 0.44±0.03a | 0.030±0.002 | 0.342±0.07 |
| 5 | DMH 15 mg/kg(16) | 45.6±3.5 | 0.42±0.02a | 0.033±0.005 | 0.331±0.04 |
| 6 | DMH 20 mg/kg(16) | 43.0±1.7 | 0.55±0.07a | 0.029±0.001a | 0.342±0.03 |
| 7 | 20 g/L DSS(16) | 41.9±5.4a | 0.38±0.02a | 0.038±0.002 | 0.460±0.06a |
| 8 | 对照(12) | 44.8±3.0 | 0.16±0.05 | 0.045±0.004 | 0.310±0.07 |
在第20周时, 给予DMH/DSS处理的小鼠100%发生了结肠腺癌, 且一半以上的小鼠其肠道HE切片同时可以观察到结肠腺瘤的出现(第3组尤为明显), 其他实验组没有或仅少量形成癌症(表3).
| 分组 | 药物处理 | n | 总成癌率(%) | 腺癌率(%) | 腺瘤率(%) |
| 1 | DMH 10 mg/kg→20 g/L DSS | 18 | 100 | 100 | 55.6 |
| 2 | DMH 15 mg/kg→20 g/L DSS | 14 | 100 | 100 | 71.4 |
| 3 | DMH 20 mg/kg→20 g/L DSS | 12 | 100 | 100 | 91.7 |
| 4 | DMH 10 mg/kg | 14 | 0 | 0 | 0 |
| 5 | DMH 15 mg/kg | 16 | 6.25 | 6.25 | 0 |
| 6 | DMH 20 mg/kg | 16 | 12.5 | 12.5 | 0 |
| 7 | 20 g/L DSS | 16 | 0 | 0 | 0 |
| 8 | 对照组 | 12 | 0 | 0 | 0 |
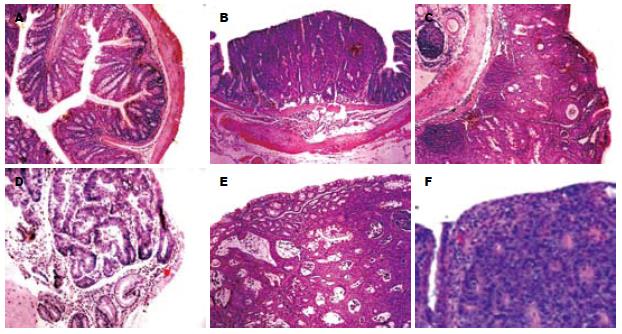
在实验的第4, 9周, 用乙醚将小鼠麻醉致死后, 打开其腹腔, 肉眼观察出现便血的小鼠肠道. 结果发现, 小鼠大肠肠壁有不同程度的充血, 水肿. 小肠无明显改变. 没有出现便血体征的小鼠, 肉眼观察无明显异常. 在实验进行的第13周, 及实验结束的第20周, 处死出现脱肛体征的小鼠. 结果表明, 大肠肠壁出现小结节, 肠道皱褶减少或消失, 肠道质地坚硬. 小肠无明显改变. 未出现脱肛的小鼠, 其肠道局部也能观察得小硬结. HE切片观察, 便血小鼠肠道有不同程度的炎症表现: 渗出、白细胞浸润、黏膜溃疡或坏死等, 但在肠道并未观察到像用2, 4, 6-三硝基苯磺酸造结肠炎模型时出现的大片黏膜溃疡、坏死. 且第9周小鼠的肠道炎症表现比第4周小鼠明显, 程度也较重. 无便血的小鼠, 部分也能看到局部肠道黏膜白细胞渗出. 脱肛小鼠肠道则表现为分化较好的管状腺癌或管状腺瘤. 从处死小鼠的观察结果来看, 便血小鼠的肠道100%出现了不同程度的炎症. 脱肛小鼠的肠道100%生成了肿瘤. 给DMH/DSS造模的小鼠(第1-3组)在第20周时, 成癌率为100%(图1).
人类肿瘤的发生、发展与很多因素有关, 其中炎症反复发作是肿瘤形成的重要因素之一, 强有力的证据表明, 肠道炎症的反复发作明显地增加了腺癌的发生率, 但是机制却不明确, 从炎症向癌症的转变是一个复杂的过程, 炎症向癌症的的转变, 其病理性变化与分子生物学变化的阐明将为结肠癌的治疗提供很有希望的靶点. 为此, 各国研究者先后建立了结肠炎、结肠癌动物模型. 尽管相关的结肠炎模型中不少易被复制, 但无论是化学诱导的或是结肠炎症相关的遗传模型都不能有效模拟人体内所发生的溃疡性结肠炎. 最常用的模型是将DSS添加到饮食或饮水中[13-18], 在啮齿动物身上复制结肠炎相关临床症状、体征及病理学改变与模拟人类结肠炎的类似模型[19-21]. 但是单独使用DSS, 不仅耗费时间长, 而且模型成功的比例并不高[22]. 同样, 单独使用化学试剂(如: 1, 2-二甲肼, 氧化偶氮甲烷)[22-27]或者通过移植肿瘤细胞株[28-29]的方法复制动物结肠癌时, 也经常会遇到各种问题: 前者造模时间非常长, 通常要1年左右的时间, 成癌率不高. 而后者则由于肿瘤细胞的移植, 使动物迅速发生结肠癌, 炎症向癌症转变这一重要过程不能被有效观察, 难以进行机制研究. 最令人遗憾的是, 一直缺少一个能观察到结肠炎癌变过程的动物模型. 本文中, 通过联合使用DMH和DSS复制一种结肠炎相关的结肠癌模型. DMH是一种能在啮齿动物肠道内诱导出在体征、病理变化方面与人类结肠癌相类似的致癌剂. 而DSS则是一种能刺激结肠癌发生的炎症诱导剂. 实验证明, ip DMH(10, 15, 20 mg/kg) 1 wk后, 在饮水中添加20 g/L DSS连续7 d可于20 wk内, 在♂ICR小鼠体内诱导出100%结肠腺癌. 这比单独使用DMH诱发形成结肠癌的时间缩短将近一半. 在造模的第4, 第9周, 我们通过肉眼和病理切片观察发现第1-6组小鼠肠道出现不同程度的炎症变化, 并且, 第9周炎症更加明显; 造模的第13周, 可见部分小鼠约10%(主要是第3组)发生结肠癌. 而在第20周时, 第1, 2, 3组小鼠100%发生结肠癌. 在体征与病理变化的关联上, 我们通过HE切片观察到, 便血小鼠肠道有不同程度的炎症表现: 渗出、白细胞浸润、黏膜溃疡或坏死等. 无便血的小鼠, 也有部分(60%)可见局部黏膜白细胞渗出. 脱肛小鼠的肠道则表现为分化较好的管状腺癌或管状腺瘤. 从处死小鼠的观察结果来看, 便血小鼠的肠道100%出现了不同程度的炎症. 脱肛小鼠的肠道100%生成了肿瘤. 尽管3个剂量的DMH与DSS合用均能诱发结肠癌的发生. 但是由于10 mg/kg DMH剂量相对较小, 癌症程度较轻. 而大剂量DMH 20 mg/kg在注射后1 wk内可见小鼠死于药物的肝脏毒性. 因此本实验的结果表明, 15 mg/kg的DMH辅以20 g/L DSS能成功诱导出炎症相关性结肠癌. 炎症相关的结肠癌模型的初步建立将给未来的结肠癌发生、发展机制研究, 结肠癌药物的研发, 结肠癌的预防带来重要影响.
结肠炎的反复发作是结肠癌形成的重要诱因之一, 结肠炎相关的结肠癌模型复制对于结肠癌机制研究以及结肠癌药物研制至关重要.
本实验旨在改进并观察联合应用癌症诱导剂1, 2-二甲肼及炎症促进剂右旋葡聚糖苷钠诱发的小鼠 结肠癌模型, 从而建立一个成功率高、简单、易行、价廉、短期成功的结肠炎相关的结肠癌模型.
本文探讨了一种结肠炎相关的结肠癌动物模型的制作方法, 有一定的新颖性和科学性, 实验方法可靠, 结果可信, 具有一定的参考价值.
电编: 张敏 编辑:王晓瑜
| 1. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] |
| 2. | Minami Y, Nishino Y, Tsubono Y, Tsuji I, Hisamichi S. Increase of colon and rectal cancer incidence rates in Japan: trends in incidence rates in Miyagi Prefecture, 1959-1997. J Epidemiol. 2006;16:240-248. [PubMed] |
| 3. | Lindberg J, Stenling R, Palmqvist R, Rutegard J. Efficiency of colorectal cancer surveillance in patients with ulcerative colitis: 26 years' experience in a patient cohort from a defined population area. Scand J Gastroenterol. 2005;40:1076-1080. [PubMed] |
| 9. | Ojima T, Iwahashi M, Nakamura M, Matsuda K, Nakamori M, Ueda K, Naka T, Ishida K, Primus FJ, Yamaue H. Successful cancer vaccine therapy for carcinoembryonic antigen (CEA)-expressing colon cancer using genetically modified dendritic cells that express CEA and T helper-type 1 cytokines in CEA transgenic mice. Int J Cancer. 2007;120:585-593. [PubMed] |
| 10. | Wang JG, Wang DF, Lv BJ, Si JM. A novel mouse model for colitis-associated colon carcinogenesis induced by 1, 2-dimethylhydrazine and dextran sulfate sodium. World J Gastroenterol. 2004;10:2958-2962. |
| 11. | Tanaka T, Kohno H, Suzuki R, Yamada Y, Sugie S, Mori H. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci. 2003;94:965-973. [PubMed] |
| 12. | Kohno H, Suzuki R, Sugie S, Tanaka T. Beta-Catenin mutations in a mouse model of inflammation-related colon carcinogenesis induced by 1, 2-dimethylhydrazine and dextran sodium sulfate. Cancer Sci. 2005;96:69-76. [PubMed] |
| 13. | Weitzman SA, Gordon LI. Inflammation and cancer: role of phagocyte-generated oxidants in carcinogenesis. Blood. 1990;76:655-663. [PubMed] |
| 14. | Yeo M, Kim DK, Park HJ, Oh TY, Kim JH, Cho SW, Paik YK, Hahm KB. Loss of transgelin in repeated bouts of ulcerative colitis-induced colon carcinogenesis. Proteomics. 2006;6:1158-1165. [PubMed] |
| 15. | Tanaka T, Suzuki R, Kohno H, Sugie S, Takahashi M, Wakabayashi K. Colonic adenocarcinomas rapidly induced by the combined treatment with 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine and dextran sodium sulfate in male ICR mice possess beta-catenin gene mutations and increases immunoreactivity for beta-catenin, cyclooxygenase-2 and inducible nitric oxide synthase. Carcinogenesis. 2005;26:229-238. [PubMed] |
| 16. | Fujii S, Fujimori T, Kawamata H, Takeda J, Kitajima K, Omotehara F, Kaihara T, Kusaka T, Ichikawa K, Ohkura Y. Development of colonic neoplasia in p53 deficient mice with experimental colitis induced by dextran sulphate sodium. Gut. 2004;53:710-716. [PubMed] |
| 17. | Liu ES, Ye YN, Shin VY, Yuen ST, Leung SY, Wong BC, Cho CH. Cigarette smoke exposure increases ulcerative colitis-associated colonic adenoma formation in mice. Carcinogenesis. 2003;24:1407-1413. [PubMed] |
| 18. | Cooper HS, Murthy S, Kido K, Yoshitake H, Flanigan A. Dysplasia and cancer in the dextran sulfate sodium mouse colitis model. Relevance to colitis-associated neoplasia in the human: a study of histopathology, B-catenin and p53 expression and the role of inflammation. Carcinogenesis. 2000;21:757-768. [PubMed] |
| 19. | Clapper ML, Adrian RH, Pfeiffer GR, Kido K, Everley L, Cooper HS, Murthy S. Depletion of colonic detoxication enzyme activity in mice with dextran sulphate sodium-induced colitis. Aliment Pharmacol Ther. 1999;13:389-396. [PubMed] |
| 20. | Korenaga D, Takesue F, Kido K, Yasuda M, Inutsuka S, Honda M, Nagahama S. Impaired antioxidant defense system of colonic tissue and cancer development in dextran sulfate sodium-induced colitis in mice. J Surg Res. 2002;102:144-149. [PubMed] |
| 21. | Tardieu D, Jaeg JP, Deloly A, Corpet DE, Cadet J, Petit CR. The COX-2 inhibitor nimesulide suppre-sses superoxide and 8-hydroxy-deoxyguanosine formation, and stimulates apoptosis in mucosa during early colonic inflammation in rats. Carcinogenesis. 2000;21:973-976. [PubMed] |
| 22. | Okayasu I, Yamada M, Mikami T, Yoshida T, Kanno J, Ohkusa T. Dysplasia and carcinoma development in a repeated dextran sulfate sodium-induced colitis model. J Gastroenterol Hepatol. 2002;17:1078-1083. [PubMed] |
| 23. | Kinjo T, Suzui M, Morioka T, Nabandith V, Inamine M, Kaneshiro T, Arakaki J, Nishimaki T, Yoshimi N. Distribution of preneoplastic lesions and tumors, and beta-catenin gene mutations in colon carcinomas induced by 1,2-dimethylhydrazine plus dextran sulfate sodium. J Exp Clin Cancer Res. 2006;25:89-95. [PubMed] |
| 24. | Onose J, Imai T, Hasumura M, Ueda M, Hirose M. Rapid induction of colorectal tumors in rats initiated with 1,2-dimethylhydrazine followed by dextran sodium sulfate treatment. Cancer Lett. 2003;198:145-152. [PubMed] |
| 25. | Karlin DA, O'Donnell RT, Jensen WE. Effect of dioctyl sodium sulfosuccinate feeding on rat colorectal 1,2-dimethylhydrazine carcinogenesis. J Natl Cancer Inst. 1980;64:791-793. [PubMed] |
| 26. | Rogers AE, Nauss KM. Rodent models for carcino-ma of the colon. Dig Dis Sci. 1985;30:87S-102S. [PubMed] |
| 27. | Nangia-Makker P, Hogan V, Honjo Y, Baccarini S, Tait L, Bresalier R, Raz A. Inhibition of human cancer cell growth and metastasis in nude mice by oral intake of modified citrus pectin. J Natl Cancer Inst. 2002;94:1854-1862. [PubMed] |
| 28. | Ran YL, Zhong X, Hu H, Yu L, Lou JN, Yang ZH. Establishment and application of engrafted tumor models with humanized tumor blood vessel. Ai Zheng. 2006;25:1323-1328. [PubMed] |
| 29. | van der Wilt CL, Smid K, Aherne GW, Noordhuis P, Peters GJ. Biochemical mechanisms of interferon modulation of 5-fluorouracil activity in colon cancer cells. Eur J Cancer. 1997;33:471-478. [PubMed] |