修回日期: 2006-11-01
接受日期: 2006-11-28
在线出版日期: 2007-01-28
目的: 研究高胆固醇血症(hypercholesterolemia, HC)兔胆管Oddi括约肌(SO)收缩反应及钾离子通道活性的变化情况, 并探讨其机制.
方法: 将24只新西兰雌兔随机分成两组, HC模型组和对照组各12只, 分别取两组SO组织制备成离体肌环, 观察SO肌环对KCl及钾离子通道阻断剂盐酸四乙铵(TEA)和4-氨基吡啶 (4-AP)的收缩反应, 并采用Western blot技术, 检测两组兔SO组织中钾离子通道的表达情况.
结果: 60 mmol/L KCl所诱发的HC组和对照组SO肌环的收缩力分别为1.23±0.08 g和1.52±0.11 g, HC组的收缩反应明显高于对照组(t = 5.89, P<0.05). 以1 mmol/L为浓度梯度累积加入TEA, 从3 mmol/L至8 mmol/L, HC组SO肌环对TEA的相对收缩反应在各个浓度点均明显低于对照组(t = 2.72, P<0.05). 以2 mmol/L为浓度梯度累积加入4-AP, 从8至18 mmol/L, HC组SO肌环对4-AP的相对收缩反应在各个浓度点均较对照组显著降低(t = 4.71, P<0.05). 蛋白免疫印迹半定量分析显示HC组SO组织BKCa通道相对光密度为0.36±0.06, 对照组为0.84±0.03, HC组BKCa通道蛋白表达量明显降低(t = 3.18, P<0.05).
结论: HC兔SO肌环的收缩反应增强, SO细胞BKCa及KV通道活性降低, BKCa通道蛋白表达量降低, 这可能是导致HC兔发生SO功能紊乱的原因之一.
引文著录: 张孝勇, 马进, 杜滂, 马克军, 王亚蓉, 魏经国. 高胆固醇血症兔Oddi括约肌细胞钾离子通道活性的改变. 世界华人消化杂志 2007; 15(3): 216-220
Revised: November 1, 2006
Accepted: November 28, 2006
Published online: January 28, 2007
AIM: To study the changes of the contractile responses and potassium ion channel activity in sphincter of Oddi (SO) from rabbits with hypercholesterolemia (HC), and elucidate the underlying mechanisms responsible for these changes.
METHODS: A total of 24 New Zealand female rabbits were divided randomly into control group (n = 12) and HC group (n = 12). SO muscle rings were dissociated from the rabbits in both groups in vitro. The contractile responses of SO to potassium chloride (KCl) was observed firstly. Then the contractile responses evoked by tetraethylammonium (TEA) and 4-aminopyridine (4-AP) were measured. Western blot was employed to examine the expression of potassium ion channels in tissues of HC and control group.
RESULTS: The contractile forces (induced by 60 mmol/L KCl) of SO tissues from HC and control group were 1.23 ± 0.08 and 1.52 ± 0.11 g, respectively. HC group showed a markedly increased contractile response (t = 5.89, P < 0.05). Compared with that in control group, the ratio of contractile responses induced by TEA (3-8 mmol/L) or 4-AP (8-18 mmol/L) to those induced by 60 mmol/L KCl was decreased significantly in HC group (t = 2.72, P < 0.05; t = 4.71, P < 0.05). Western blot indicated that the protein expression of potassium ion channels of SO tissue was significantly reduced in HC group in comparison with that in control group (0.36 ± 0.06 vs 0.84 ± 0.03, t = 3.18, P < 0.05).
CONCLUSION: The contractile response of SO to KCl increases while the activities of BKCa and KV in SO cells decrease in HC rabbits, which might be one of the reasons why SO dysfunction is caused in the condition of HC.
- Citation: Zhang XY, Ma J, Du P, Ma KJ, Wang YR, Wei JG. Changes in potassium ion channel activity of the Oddi's sphincter smooth muscle cells from hypercholesterolemic rabbits. Shijie Huaren Xiaohua Zazhi 2007; 15(3): 216-220
- URL: https://www.wjgnet.com/1009-3079/full/v15/i3/216.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i3.216
Oddi括约肌包绕于胰胆管汇合进入十二指肠处, 是独立于十二指肠壁平滑肌、具有精细分工的肌性结构, 在神经与激素的共同作用下, 产生协调的舒缩运动, 对调节胆囊充盈、控制胆汁排出及维持胆道系统正常压力具有重要作用. 已经证实胆囊切除术后可诱发Oddi括约肌功能紊乱(sphincter of Oddi dysfunction, SOD), 进一步研究发现, 胆囊切除术前可能已经存在sphincter of Oddi(SO)肌动力异常[1]. SOD是胆道疾病、胰腺疾病及胃肠道疾病发生的重要诱因[2-4]之一. Wei et al[5]研究发现, 高胆固醇血症(HC)可导致兔SOD, 但发生机制尚不清楚[6]. 本研究通过喂饲胆固醇(Ch)制作高胆固醇血症兔模型, 用灌流法在离体条件下研究了HC对SO肌环张力的影响, 并利用通道阻断剂研究了高胆固醇血症兔SO细胞钾离子通道的活性的变化, 并采用Western blot技术检测两组兔SO组织钾离子通道的表达情况的差异, 对其机制进行了初步探讨.
NaCl, KCl, NaHCO3, MgCl2, NaH2PO4, 葡萄糖, 二甲基亚砜(DMSO)购自西安化学试剂厂; 盐酸四乙铵(tetraethylammonium, TEA), 4-氨基吡啶(4-aminopyridine, 4-AP), BSA, DAB购自美国Sigma公司; Ch分析纯购自上海化学试剂公司; 张力换能器JZ-BK型购自中国贝科公司; 台式自动平衡记录仪XWTD464型购自上海大华仪表厂; 电子天平ACA-100型购自美国Denver公司; 解剖显微镜PM-6型购自日本Olympus公司. 新西兰♀兔24只(第四军医大学实验动物中心提供), 2-3 mo, 体质量1.8-2.2 kg, 随机分为2组, 每组12只. 对照组(Con)饲以标准饲料, 实验组(HC)饲以标准饲料+Ch, 每日1 g, 每周6 d, 停喂1 d, 共8 wk. 高Ch血症模型判定标准: 兔血清总Ch浓度<3.0 mmol/L为正常, >10 mmol/L为达到高Ch血症标准. 实验开始前将血清总Ch>3.0 mmol/L兔剔除.
1.2.1 SO肌环的制备: 经耳缘静脉注入约10 mL空气处死兔, 迅速分离SO段, 置于氧合Krebs液中, 在解剖显微镜下小心去除SO周围脂肪与结缔组织, 取其近心段并修剪成横径为4 mm的肌环. 肌环一端藉不锈钢丝挂钩固定于肌槽底部的挂钩上, 另一端通过挂钩与肌肉张力换能器(JZ-BK型, 中国贝科公司)相连. 肌槽内盛37℃ Krebs液, 并持续充以50 mL/L CO2+950 mL/L O2混合气. Krebs液组成(mmol/L): NaCl 115.0, KCl 5.9, NaHCO3 22.8, MgCl2 1.2, NaH2PO4 1.2, CaCl2 2.5, 葡萄糖10.0, pH = 7.4.
1.2.2 SO最适静息张力的调节: 将肌环置于Krebs液中温育, 首先给予0.6 g初始前负荷, 在平衡的过程中, 通过旋钮不断调节张力, 使其稳定在初始前负荷水平, 每隔20 min换一次Krebs液. 平衡60 min后以60 mmol/L KCl为激动剂, 以0.2 g为步幅逐步提高前负荷值至其产生最大收缩反应, 此时的静息张力即为最适静息张力, 随后实验均在各肌环最适静息张力下进行.
1.2.3 SO细胞钾离子通道功能的测定: 首先测试肌环对60 mmol/L KCl的最大收缩反应. 达到最大收缩后洗脱肌环, 再向浴槽内累积加入不同浓度(0.1-10 mmol/L)的氯化四乙铵(TEA), 记录每个累积浓度下肌环收缩产生的最大张力. 再次洗脱后, 按照同样方法测试肌环对不同累积浓度(0.5-20 mmol/L)4-氨基吡啶(4-AP)的收缩反应. 我们以肌环对不同累积浓度的4-AP或TEA的收缩反应与同一肌环对60 mmol/L KCl的收缩反应性的比值作为反映SO钾离子通道功能的指标[7]. 由所得数据绘制累积浓度-效应曲线.
1.2.4 蛋白免疫印迹分析: 以β-actin水平作为等量蛋白上样对照, HC组及对照组SO组织以三去污裂解液提取组织细胞总蛋白, Bradford法进行蛋白定量. 每孔加样120 g/L SDS-PAGE凝胶电泳分离, 将蛋白质电转移至硝酸纤维膜(NC膜), 以50 g/L的BSA室温封闭过夜后, 用小鼠抗兔BKCa pAb[8]孵育膜3 h, TBST洗膜3×10 min, 再以1:1000稀释的HRP标记羊抗小鼠IgG室温孵育3 h, TBST洗膜3次, 用DAB显色液显色5-10 min, 观察结果.
统计学处理 检测结果均采用统计软件SPSS12.0进行数据的统计学分析. 实验数据以mean±SD表示, 两组间数据比较采用t检验, P<0.05为差异显著.
实验时HC组和对照组SO肌环湿质量分别为2.31±0.09 mg与2.28±0.06 mg, 两组间无明显差异(n = 12).
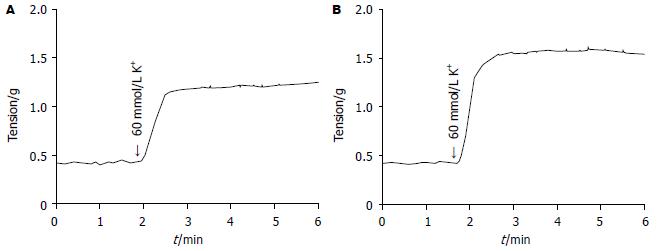
60 mmol/L KCl诱发的两组收缩反应曲线(图1). 对照组SO肌环的平均收缩力为1.23±0.08 g, HC组为1.52±0.11 g, 所诱发的收缩力HC组较对照组显著提高(t = 5.89, P<0.05).
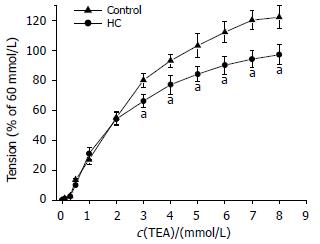
当两组SO肌环加入TEA时, 其引发的收缩力在两组间无明显差别. 但经与60 mmol/L KCl的收缩反应的比值做归一化处理后, HC组SO肌环对TEA的相对收缩反应较对照组发生了明显的变化. 在3 mmol/L时为65.2%±8.1%, 较对照组下调13.9%; 在4 mmol/L时为77.1%±6.2%, 较对照组下调16.7%; 在5 mmol/L时为84.4%±10.0%, 较对照组下调19.2%; 在6 mmol/L时为90.9%±12.6%, 较对照组下调16.6%; 在7 mmol/L时为94.3%±11.3%, 较对照组下调18.8%; 在8 mmol/L时为96.0%±9.7%, 较对照组下调14.5%. 可见HC组SO肌环对TEA的相对收缩反应在上述各个浓度点均较对照组明显降低(t = 2.72, P<0.05, 图2).
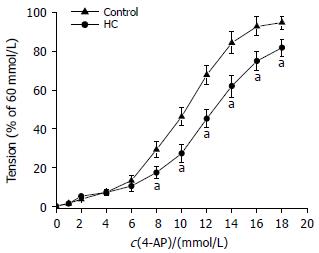
SO肌环在4-AP作用下产生的张力在两组间未见显著差异. 但通过两组张力与60 mmol/L KCl引发的收缩反应的比值做归一化处理后, HC组对4-AP的相对收缩反应在8 mmol/L时为17.3%±2.1%, 较对照降低6.8%; 在10 mmol/L时为27.3%±3.2%, 较对照降低18.2%; 在12 mmol/L时为45.9%±2.6%, 较对照降低22.1%; 在14 mmol/L时为62.5%±7.8%, 较对照降低20.8%; 在16 mmol/L时为75.1%±8.7%, 较对照降低18.5%. 在18 mmol/L时为82.0%±10.6%, 较对照降低13.3%. 可见HC组肌环对4-AP的相对收缩反应在上述各个浓度点均较对照组显著降低(t = 4.71, P<0.05, 图3).
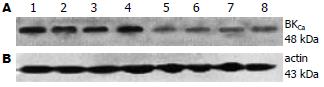
采用Western blot方法观察两组SO组织BKCa通道的表达情况, 结果显示HC组BKCa通道表达量明显降低(图4). 半定量分析显示对照组相对光密度为0.84±0.03, HC组为0.36±0.06, 两组间存在统计学差异(t = 3.18, P<0.05).
在SO平滑肌细胞膜上至少有4种钾离子通道, 其中电压依赖型钾离子通道(KV)和钙依赖型钾离子通道(BKCa)在数量上占有绝对优势, 在决定细胞极化状态、调节细胞膜静息电位以及调节平滑肌张力等方面起着重要作用[9]. TEA和4-AP分别是BKCa和KV通道的特异性阻断剂[10]. 如果SO平滑肌细胞钾通道功能增强, 那么同样浓度的钾通道阻断剂对该通道的阻断作用就越强, 在收缩装置等其他因素近似相同的条件下就能引起该动脉更强的收缩反应. 相反, 如果钾通道活性降低, 同样浓度的钾通道阻断剂对该通道的阻断作用就越弱, 诱发的收缩反应就会减小. 因此本实验分别采用这两种阻断剂观察HC兔SO平滑肌细胞BKCa和KV功能的变化. 本实验采用TEA及4-AP激发的收缩反应与KCl激发的收缩反应的比值作为指标, 可排除SO平滑肌细胞数量及单个SMC内收缩蛋白数量等其他因素的影响. 因此该比值反映了高胆固醇血症兔SO细胞 BKCa及KV活性的变化[7].
BKCa通道的主要生理作用是调节平滑肌细胞膜电位和肌张力, 即当细胞膜去极化时, 细胞外Ca2+内流增加, 当细胞[Ca2+]i到达一定阈值时激活BKCa, 引起K+外流增加, 进而降低膜去极化程度, 平滑肌收缩作用减弱. 早在1989年, Wilde et al[11]在研究平滑肌细胞BKCa功能时就发现BKCa能直接对抗[Ca2+]i升高所致的膜去极化程度, 提示此通道在调控细胞膜电位及肌张力过程中对质膜的极化状态起着负反馈调节作用. 本组实验发现HC组SO肌环对TEA的相对收缩反应在各个浓度点均较对照组明显降低, 说明在HC条件下, 兔SO平滑肌细胞BKCa的活性降低. 本文的收缩反应试验结果证实HC组肌环对高浓度K+的收缩反应较对照组明显提高, 这一现象可能是由于HC组SO肌环细胞BKCa通道对[Ca2+]i的敏感性降低所致[12]. 本实验中半定量蛋白免疫印迹分析显示HC组BKCa通道蛋白表达下调. 我们认为, 由于高胆固醇导致BKCa蛋白表达量的下降导致了通道门控特点的变化[13], 包括细胞内[Ca2+]i敏感性下降的异常变化. 当细胞内[Ca2+]i上升时通道不能及时开放; 或者伴有开放频率的减少、对膜电位不敏感等, 致使细胞膜超极化障碍, 电压依赖性钙通道关闭不全或者不能关闭, 最后致使高胆固醇血症兔SOD模型SO细胞BKCa通道对[Ca2+]i的负反馈调节作用减弱, [Ca2+]i过载, 从而削弱了BKCa通道介导的SO细胞扩张的作用.
KV的重要生理功能之一就是通过细胞膜去极化提高细胞的兴奋性, 以及通过膜超极化降低细胞的兴奋性; 同时参与SMC静息电位的形成及血管平滑肌紧张度的调节. 也就是说, KV功能降低可引起细胞去极化, 导致细胞的兴奋性提高. Fike et al[14]观察到在高血压时, 兔肺动脉SMC的KV通道的活性下降, 通道电流减小, 收缩反应提高, 血管紧张度增加. 由于HC条件下平滑肌张力的变化与高血压时类似, 故我们推测HC导致SO细胞膜KV的功能变化可能也与高血压时类似. 本组实验发现, HC组SO肌环对4-AP的相对收缩反应在各浓度点均较对照组显著降低, 说明HC可致兔SO细胞KV通道活性降低. 由于KV通道功能降低, 使SMC处于更易去极化状态, 引起平滑肌收缩反应增强, SO应激性提高[15].
总之, 我们通过制作HC兔模型, 制备SO肌环, 在离体条件下发现高胆固醇血症兔SO肌环对KCl的兴奋性增加, BKCa和KV通道的活性降低, BKCa通道蛋白表达量降低, 从而从钾离子通道功能变化的角度进一步证实了Wei et al[5]观察到的HC兔SO处于高张力状态的现象, 并推测SOD的发生可能与高胆固醇血症条件下SO细胞BKCa和KV通道活性降低关系密切.
高胆固醇饮食已成为危害人类健康的十大危险因素之一. 临床资料和研究表明,胆固醇代谢紊乱是导致胆管Oddi括约肌功能紊乱(SOD) 的原因之一. 近年来有很多相关研究结果表明高胆固醇可引起SO痉挛, 进而引起胆囊淤胆,结石形成, 同时在高胆固醇SOD兔模型中SO细胞中Ca2+浓度升高, Ca 2+ 跨膜转运速度降低. 其原因尚不明确.
钾离子通道活性的变化将导致细胞膜电位的改变, 因此改变高胆固醇血症条件下SO 细胞膜的异常极化状态, 有望为 SOD的治疗提供新思路.
HSC活化: 是指肝脏损伤时, HSC受到各种致病因子的刺激, 从静息状态转化为具有增生性、纤维原性和可收缩性的肌成纤维细胞. 其中 α-SMA的表达为其激活的标志, 表达量的大小可用来衡量HSC的激活程度.
本文通过制作HC兔模型, 制备SO肌环, 在离体条件下发现高胆固醇血症兔SO肌环对KCl 的兴奋性增加, BKCa和KV通道的活性降低, BKCa通道蛋白表达量降低, 从而证实了HC 兔 SO 处于高张力状态的现象,并推测SOD的发生可能与高胆固醇血症条件下SO细胞BKCa和KV通道活性降低关系密切. 文章有较好的科学性、创新性和可读性, 有一定学术意义.
电编: 张敏 编辑:张焕兰
| 1. | Szilvassy Z, Nagy I, Madacsy L, Hajnal F, Velosy B, Takacs T, Lonovics J. Beneficial effect of lovastatin on sphincter of Oddi dyskinesia in hypercholesterolemia and hypertriglyceridemia. Am J Gastroenterol. 1997;92:900-902. [PubMed] |
| 2. | Menees S, Elta GH. Sphincter of Oddi Dysfunction. Curr Treat Options Gastroenterol. 2005;8:109-115. [PubMed] |
| 3. | Behar J, Corazziari E, Guelrud M, Hogan W, Sherman S, Toouli J. Functional gallbladder and sphincter of oddi disorders. Gastroenterology. 2006;130:1498-1509. [PubMed] |
| 4. | Bistritz L, Bain VG. Sphincter of Oddi dysfunction: managing the patient with chronic biliary pain. World J Gastroenterol. 2006;12:3793-3802. [PubMed] |
| 5. | Wei JG, Wang YC, Du F, Yu HJ. Dynamic and ultrastructural study of sphincter of Oddi in early-stage cholelithiasis in rabbits with hypercholes-terolemia. World J Gastroenterol. 2000;6:102-106. [PubMed] |
| 6. | Wang XJ, Wei JG, Wang CM, Wang YC, Wu QZ, Xu JK, Yang XX. Effect of cholesterol liposomes on calcium mobilization in muscle cells from the rabbit sphincter of Oddi. World J Gastroenterol. 2002;8:144-149. [PubMed] |
| 7. | Asano M, Matsunaga K, Miura M, Ito KM, Seto M, Sakurada K, Nagumo H, Sasaki Y, Ito K. Selectivity of action of staurosporine on Ca2+ movements and contractions in vascular smooth muscles. Eur J Pharmacol. 1995;294:693-701. [PubMed] |
| 8. | Wang YR, Wei JG, Sun O, Ma KJ, Zhang XY, Znang YX, Han H. Preparation of polyclonal antiserum against beta subunit of rabbit BK channel. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi. 2005;21:375-378. [PubMed] |
| 9. | Horiuchi T, Dietrich HH, Tsugane S, Dacey RG Jr. Role of potassium channels in regulation of brain arteriolar tone: comparison of cerebrum versus brain stem. Stroke. 2001;32:218-224. [PubMed] |
| 10. | Archer SL, Huang JM, Reeve HL, Hampl V, Tolarova S, Michelakis E, Weir EK. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and hypoxia. Circ Res. 1996;78:431-442. [PubMed] |
| 11. | Wilde DW, Lee KS. Outward potassium currents in freshly isolated smooth muscle cell of dog coronary arteries. Circ Res. 1989;65:1718-1734. [PubMed] |
| 12. | Kim N, Chung J, Kim E, Han J. Changes in the Ca2+-activated K+ channels of the coronary artery during left ventricular hypertrophy. Circ Res. 2003;93:541-547. [PubMed] |
| 13. | Fu ZJ, Xie MJ, Zhang LF, Cheng HW, Ma J. Differential activation of potassium channels in cerebral and hindquarter arteries of rats during simulated microgravity. Am J Physiol Heart Circ Physiol. 2004;287:H1505-1515. [PubMed] |
| 14. | Fike CD, Kaplowitz MR, Zhang Y, Madden JA. Voltage-gated K+ channels at an early stage of chronic hypoxia-induced pulmonary hypertension in newborn piglets. Am J Physiol Lung Cell Mol Physiol. 2006;291:L1169-1176. [PubMed] |