修回日期: 2007-09-29
接受日期: 2007-09-28
在线出版日期: 2007-10-18
目的: 通过对直肠癌直肠系膜中CK20表达的检测, 探讨直肠癌区域转移及微转移的规律, 为临床直肠癌术式的选择及实施提供依据.
方法: 应用RT-PCR方法对直肠癌TME术后50例患者的肿瘤组织、直肠系膜及盆筋膜壁层中CK20的表达进行检测, 同时分析CK20的表达与病理特征的关系.
结果: 正常对照组织中无阳性表达, 直肠癌组织中CK20高表达(78%), 肿瘤平面和直肠系膜近端可表达, 直肠系膜远端(20%)和盆筋膜壁层表达(6.38%)程度较低. CK20表达与肿瘤形态、TNM分期、浸润深度有关, 而与肿瘤直径、肿瘤分化程度、原发部位无关.
结论: 直肠癌患者外科治疗时常规行TME是必要的.
引文著录: 康悦, 蒋伟, 杨维良. 直肠癌直肠系膜中CK20的表达及临床意义. 世界华人消化杂志 2007; 15(29): 3143-3146
Revised: September 29, 2007
Accepted: September 28, 2007
Published online: October 18, 2007
AIM: To detect the expression of CK20 in the mesorectum of patients with rectal cancer to establish an anatomical and pathological basis for selecting the optimal surgical procedure for the management of rectal cancer.
METHODS: CK20 was detected by reverse-transcriptase polymerase chain reaction in tissue specimens of tumour and outer pelvic fascia in 50 patients with rectal cancer. The pathological data were retrospectively analyzed.
RESULTS: CK20 was highly expressed in tissues from rectal cancer and the proximal mesorectal margin, and was lowly expressed in tissue from the distal mesorectal and pots mesorectal fascia. CK20 expression was related to tumor morphology, TNM stage, depth of invasion, and tumor diameter and differentiation, unrelated to the original site.
CONCLUSION: It is necessary to routinely perform TME in the surgical management of rectal cancer.
- Citation: Kang Y, Jiang W, Yang WL. Expression of CK20 in mesorectum of patients with rectal cancer and its clinical significance. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3143-3146
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3143.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3143
直肠癌是人类最常见的恶性肿瘤之一, 约占大肠癌的60%, 发病率呈逐年上升趋势[1]. 1982年Heald et al[2-3]提出直肠癌术后局部复发是由于原发肿瘤远侧的直肠系膜内残留播散的癌组织, 而直肠系膜切除不足是盆腔复发的直接原因. 并由此提出了全直肠系膜切除术(total mesorectal excision, TME). 细胞角蛋白20(CK20)是由Moll et al[4]于1990年发现的一种多肽, 具有更为严格的上皮组织特异性[5-6]. CK20在大肠癌组织中高表达, 在侵袭转移到其他组织器官中仍稳定表达, 他的分布特点成为肿瘤分子领域的一个研究热点[7]. 我们通过RT-PCR方法检测直肠癌直肠系膜中CK20的表达情况, 分析其与肿瘤转移、微转移的临床病理关系, 为直肠癌根治术合理的切除范围提供依据.
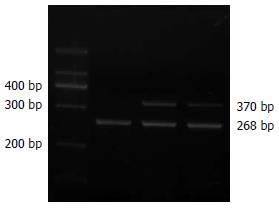
2004-07/2005-10期间在哈尔滨医科大学附属第二医院普外三科就诊, 并行TME的直肠癌患者标本50例. 所有病例术后均经病理诊断证实, 患者术前均未行放、化疗或针对肿瘤的其他治疗. 男24例, 女26例, 年龄24-78(中位年龄58.5), 其中肿块型15例, 溃疡型23例, 浸润型12例; 高-中分化31例, 低分化19例; TNM分期Ⅰ期7例, Ⅱ期13例, Ⅲ期28例, Ⅳ期2例; 肿瘤位置距肛门5 cm内15例, 5-10 cm的28例, 大于10 cm的7例; 无淋巴结转移20例, 有淋巴结转移30例. 引物由山东省医科院肿瘤免疫与基因工程重点实验室设计并提供, CK20: 5'-CAGACACACGGTGAACTATGG-3'(上游), 5'-GATCAGCTTCCACTGTTAGACG-3'(下游), 扩增长度370 bp; 内参照β-actin: 5'-GTCCATCCTGGCCTCGCTGT-3'(上游), 5'-GCTGTCACCTTCACCGTTCC-3'(下游), 扩增长度268 bp. TRIzol及RT-PCR试剂盒(invitrogen公司生产).
1.2.1 标本的采集: 术中在手术平面和距肿瘤下缘2 cm处盆筋膜壁层取组织(约1.0 cm×1.0 cm). 手术结束时, 立即将新鲜的手术标本平铺在无菌单上, 沿直肠切缘游离直肠系膜至肿瘤下缘, 无张力下测量系膜长度. 在肿瘤下缘2 cm和直肠系膜远端分别截取1.0 cm宽的直肠系膜. 尽量避开缺血及坏死区, 在肿瘤实质取1.0 cm×1.0 cm大小的组织两块. 将上述标本分成两份, 1份液氮速冻, -80℃冰箱保存待测. 另一部分40 g/L甲醛溶液中固定. 观察大体分型及行常规病理检查, 记录患者的临床资料. 取因直肠良性病变行直肠部分切除的直肠系膜标本20例, 作为正常对照.
1.2.2 逆转录聚合酶链式反应的方法检测CK20的表达: 按TRIzol试剂盒说明提取总RNA, 按RT-PCR试剂盒说明书操作. 取一无菌的500 µL的Eppendorf管按下列顺序加样: dDTPs(10 mmol/L) 1 µL, 寡聚dT(0.5 mg/L) 1 µL, 用DEPC处理的水加至10 µL, 65℃下恒温5 min, 慢慢冷却至室温. 另一只微量离心管按下述加样: 10×RT-PCR缓冲液2 µL, MgCl2(25 mmol/L) 4 µL, 0.1 mol/L DTT 2 µL, RNA酶抑制剂1 µL将此混合物加入第一步中的RNA/dDTPs/寡聚dT混合物中, 42℃下恒温2 min. 加1 µL(50单位)SuperscriptⅡ聚合酶, 42℃下恒温50 min, 70℃下恒温15 min(使SuperscriptⅡ聚合酶失活), 然后冰水冷却, 脉冲自旋. 加入1 µL RNA酶抑制剂, 37℃恒温20 min. 取一只薄壁管按下列顺序加样: MgCl2(25 mmol/L) 3 µL, 10×RT-PCR缓冲液(不含MgCl2) 5 µL, 反转录产物(cDNA)2 µL, 5'引物或正向引物(300 mmol/L) 1 µL, 3'引物或反向引物(300 mol/L) 1 µL, dNDP混合物(最终浓度800 µmol/L). 将样品加入预先设置好程序的PCR仪, 具体参数如下: 第一次变性94℃ 3 min, 循环扩增, 变性94℃ 30 s, 退火60℃ 30 s, 45次循环, 延伸72℃ 30 s, 最后延伸72℃ 5 min. 将琼脂糖溶解于电泳缓冲液中, 加热熔化后加入 EB摇匀, 配制成含EB(0.5 mg/L) 20 g/L琼脂糖凝胶, 倒入电泳槽中水平板, 冷却后倒入电泳缓冲液. 从反应管和对照管中分别取5-10 µL样品, 将样本与溴酚蓝混匀后进行点样, 电泳并进行拍照.
统计学处理 应用SPSS13.0统计软件对数据进行χ2检验或Fisher精确检验, P<0.05有统计学意义.
正常对照组织中无阳性表达, 阳性率为0%(0/20), 50例肿瘤组织的中阳性表达率为78%(39/50), 两者具有显著性差异(P<0.01), 说明CK20在直肠癌组织中高度表达. 近端直肠系膜阳性表达率为42.85%(21/50), 与正常对照组有显著差异(P<0.05). 远端直肠系膜阳性表达率为20%(10/50), 与正常对照组无显著差异(P>0.05). 盆筋膜壁层的阳性表达率为6.38%(3/50), 与正常对照组差异无显著性(P>0.05)(图1).
各种组织阳性率: 肿块型为13.3%(2/15), 溃疡型30.4%(7/23), 浸润型50%(6/12), 三者有显著差异(P<0.05). 高、中分化组6.4%(2/31), 低分化组26.3%(5/19), 二者无显著差异(P>0.05). TNM分期Ⅰ+Ⅱ期为0, Ⅲ+Ⅳ期36.0%(11/30), 二者差异有显著性(P<0.01). 浸润深度T1+T2为54.3%(19/35), T3+T4为73.3%(11/15), 二者有显著差异(P<0.01). 肿瘤距肛缘距离<5 cm为25%(3/15), 5-10 cm为7.14%(2/28), >10 cm为14.3%(1/7), 三者无显著差异(P>0.05). 肿瘤直径≤5 cm为48.6%(17/35), >5 cm为33.4%(5/15), 二者差异无显著性(P>0.05). CK20表达与肿瘤形态、TNM分期、浸润深度有关, 而与肿瘤直径、肿瘤分化程度、原发部位无关(表1).
| 临床病理特征 | n | CK20的表达 | P | |
| 阳性 | 阴性 | |||
| 肿瘤形态 | ||||
| 肿块型 | 15 | 2 | 13 | <0.05 |
| 溃疡型 | 23 | 7 | 16 | (χ2 = 5.442) |
| 浸润型 | 12 | 6 | 6 | |
| 分化程度 | ||||
| 高中分化 | 31 | 2 | 29 | >0.05 |
| 低分化 | 19 | 5 | 14 | (χ2 = 7.386) |
| TNM分期 | ||||
| Ⅰ+Ⅱ | 20 | 0 | 20 | <0.01 |
| Ⅲ+Ⅳ | 30 | 11 | 19 | (χ2 = 9.514) |
| 浸润深度 | ||||
| T1+T2 | 35 | 19 | 16 | <0.01 |
| T3+T4 | 15 | 11 | 4 | (χ2 = 0.984) |
| 肿瘤距肛缘 | ||||
| <5 cm | 15 | 3 | 12 | >0.05 |
| 5-10 cm | 28 | 2 | 26 | (χ2 = 2.387) |
| >10 cm | 7 | 1 | 6 | |
| 肿瘤直径 | ||||
| ≤5 cm | 35 | 17 | 18 | >0.05 |
| >5 cm | 15 | 5 | 10 | (χ2 = 1.185) |
手术治疗是直肠癌综合治疗的基础. 近20年的TME应用使直肠癌手术的效果得到了很大的改善, 局部复发率由25%降到3%-7%[8-10], 并作为直肠癌外科治疗的金标准在全球范围推广. Heald et al[11-12]和Wang et al[13]认为, TME应在盆筋膜脏壁两层之间锐性切除, 直肠系膜(盆筋膜脏层)完整切除无撕脱, 并保证肉眼及镜下无切缘累及. 但是, 肉眼及镜下的观察毕竟在一定程度上对发现微转移灶有相当的局限性[14-15], 因为肿瘤的浸润和转移是肿瘤细胞与细胞外基质ECM相互作用的结果[16-17], 此过程远远早于肉眼及常规病理切片检查所见[18-19]. 因此, 应对肿瘤的微转移进行检测, 以提高手术疗效和判断预后.
细胞角蛋白20(CK20)是一种多肽, 具有更为严格的上皮组织特异性. 在正常组织中, CK20分布于肠黏膜细胞、胃黏膜及幽门腺体细胞、十二指肠黏膜、泌尿系伞状细胞、表皮Merkel细胞, 而其他正常组织如乳腺、平滑肌、造血细胞等均为阴性. 当细胞发生化生、恶变、肿瘤转移、体外培养等改变时, CK20的表达仍持续表达阳性. 因此作为检测直肠癌的肿瘤标志物, CK20具有一定的组织特异性.
本研究中, 20例良性疾病的直肠系膜中无1例阳性表达, 在直肠癌肿瘤组织中表达率为78%, 显著高于正常直肠系膜, 说明CK20在直肠癌组织中高表达, 可以作为直肠癌微转移的一个生物学指标. 近端直肠系膜表达率为42.85%, 高于正常直肠系膜, 说明肿瘤可能在近端直肠系膜中播散, 手术切除不全, 微小的转移灶残留, 可引起复发. 远端直肠系膜及盆筋膜壁层表达率分别为20%和6.38%, 二者与正常直肠系膜比较, 无显著性差异, 说明远端直肠系膜超过了肿瘤可能播散的平面, 而盆筋膜壁层对限制肿瘤的播散有一定的作用. 这符合TME手术原则, 即肿瘤远端直肠系膜切除长度至少比肿瘤平面多5 cm. 传统的手术方式, 虽然可以保证断端肠管的血供, 减少吻合口漏的发生, 但远端系膜内却可留有微小的转移病灶, 引起局部复发. 因此, TME手术可以在技术上最大限度的避免术后局部复发.
本研究还发现, CK20的表达与肿瘤的大体形态, TNM分期、浸润深度有关, 原因是肿块型主要为膨胀性生长, 周围的纤维组织增生可阻挡癌细胞浸润. 溃疡型和浸润型因侵犯黏膜下, 而黏膜组织疏松, 淋巴组织丰富, 更利于直接蔓延和淋巴浸润, 因此, 浸润程度越深, 越晚期的患者其直肠系膜中CK20表达越高. 应用RT-PCR检测直肠癌患者直肠系膜中CK20可以对患者从分子水平进行病理分期, 为合理的手术范围提供切实可行的依据, 有助于综合判断疾病的恶性程度及预后, 可成为指导术后辅助治疗的基础.
直肠癌是消化道最常见的恶性肿瘤之一, TME手术是主要的治疗方法. 目前国内外对TME的研究主要是临床观察及病理组织检查, 缺乏分子水平的理论依据. 本文通过RT-PCR方法检测直肠癌直肠系膜中CK20的表达情况, 分析其与肿瘤转移、微转移及临床病理的关系, 从分子角度证实TME的科学性.
细胞角蛋白20(CK20)是由Moll et al于1990年发现的一种多肽, 在所有大肠癌几乎都明显的表达, 且在侵袭、转移、扩散到其他组织器官时始终保持稳定, 是检测肿瘤微转移的良好指标, 他的分布特点成为肿瘤分子领域的一个研究热点.
CK20在肿瘤中的表达与预测微转移的实验研究已有很多报道, 结论也多一致. 在对直肠癌的研究中, 也有报道直肠系膜静脉血、外周血等CK20表达意义的研究, 但直肠系膜内转移和微转移的规律无人涉及.
本文首次研究了直肠癌直肠系膜内CK20的表达情况, 从分子水平研究直肠系膜与肿瘤转移、微转移的关系, 为直肠癌术式提供科学依据.
检测直肠癌患者直肠系膜中CK20可以对患者从分子水平进行病理分期, 有助于综合判断疾病的恶性程度和预后.
本文对于CK20与直肠癌之间的关系研究是一个补充, 具有一定的理论和临床参考价值.
编辑: 何燕 电编:郭海丽
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] |
| 2. | Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery--the clue to pelvic recurrence? Br J Surg. 1982;69:613-616. [PubMed] |
| 3. | Heald RJ, Karanjia ND. Results of radical surgery for rectal cancer. World J Surg. 1992;16:848-857. [PubMed] |
| 4. | Moll R, Schiller DL, Franke WW. Identification of protein IT of the intestinal cytoskeleton as a novel type I cytokeratin with unusual properties and expression patterns. J Cell Biol. 1990;111:567-580. [PubMed] |
| 5. | Burchill SA, Bradbury MF, Pittman K, Southgate J, Smith B, Selby P. Detection of epithelial cancer cells in peripheral blood by reverse transcriptase-polymerase chain reaction. Br J Cancer. 1995;71:278-281. [PubMed] |
| 6. | Lassmann S, Bauer M, Soong R, Schreglmann J, Tabiti K, Nahrig J, Ruger R, Hofler H, Werner M. Quantification of CK20 gene and protein expression in colorectal cancer by RT-PCR and immunohistochemistry reveals inter- and intratumour heterogeneity. J Pathol. 2002;198:198-206. [PubMed] |
| 8. | Mahteme H, Pahlman L. Good colorectal cancer surgery. Tech Coloproctol. 2005;9:1-7. [PubMed] |
| 9. | Ho K, Seow-Choen F. Surgical results of total mesorectal excision for rectal cancer in a specialised colorectal unit. Recent Results Cancer Res. 2005;165:105-111. [PubMed] |
| 10. | Grotowski M. Rectal cancer--review of methods and treatment results. Pol Merkur Lekarski. 2004;16:289-292. [PubMed] |
| 11. | Heald RJ. Total mesorectal exsicion (TME). Acta Chir Iugosl. 2000;47:17-18. [PubMed] |
| 12. | Heald RJ. Sphincter and nerve preserving total mesorectal excision. Acta Chir Iugosl. 2002;49:7-8. [PubMed] |
| 13. | Wang Z, Zhou ZG, Wang C, Zhao GP, Chen YD, Gao HK, Zheng XL, Wang R, Chen DY, Liu WP. Microscopic spread of low rectal cancer in regions of mesorectum: pathologic assessment with whole-mount sections. World J Gastroenterol. 2004;10:2949-2953. [PubMed] |
| 14. | Sargent DJ, Conley BA, Allegra C, Collette L. Clinical trial designs for predictive marker validation in cancer treatment trials. J Clin Oncol. 2005;23:2020-2027. [PubMed] |
| 15. | Guzinska-Ustymowicz K, Kemona A. Transforming growth factor beta can be a parameter of aggressiveness of pT1 colorectal cancer. World J Gastroenterol. 2005;11:1193-1195. [PubMed] |
| 16. | Li Z, Ren Y, Wu QC, Lin SX, Liang YJ, Liang HZ. Macrophage migration inhibitory factor enhances neoplastic cell invasion by inducing the expression of matrix metalloproteinase 9 and interleukin-8 in nasopharyngeal carcinoma cell lines. Chin Med J (Engl). 2004;117:107-114. [PubMed] |
| 17. | Das A, Tan WL, Smith DR. Expression of extra-cellular matrix markers in benign meningiomas. Neuropathology. 2003;23:275-281. [PubMed] |
| 18. | Wang Y, Jatkoe T, Zhang Y, Mutch MG, Talantov D, Jiang J, McLeod HL, Atkins D. Gene expression profiles and molecular markers to predict recurrence of Dukes' B colon cancer. J Clin Oncol. 2004;22:1564-1571. [PubMed] |
| 19. | Takayama S, Ishii S, Ikeda T, Masamura S, Doi M, Kitajima M. The relationship between bone metastasis from human breast cancer and integrin alpha(v)beta3 expression. Anticancer Res. 2005;25:79-83. [PubMed] |