修回日期: 2007-09-30
接受日期: 2007-09-28
在线出版日期: 2007-10-18
目的: 探讨谷氨酰胺对TLR2、4表达的调节与肠组织损伤的关系.
方法: 将24只10日龄Wistar幼鼠随机分为对照组(n = 8),ip生理盐水, 1 mL/kg; LPS组(n = 8), ip LPS, 5 mg/kg; 谷氨酰胺组(n = 8),ip LPS 5 mg/kg+谷氨酰胺10 mL/kg, 3 h后取肠组织, HE染色观察病理改变, RT-PCR检测肠组织TLR2、4 mRNA的表达. Western blot检测TLR蛋白表达.
结果: 对照组TLR2、4 mRNA均较LPS组弱(TLR2 mRNA: 1.386±0.04 vs 4.093±0.90, TLR4 mRNA: 9.872±0.36 vs 16.706±1.28, TLR2 蛋白: 22.28±0.96 vs 79.27±3.16, TLR4 蛋白: 35.07±0.17 vs 65.18±0.46); 与LPS组相比, 谷氨酰胺组TLR2、4mRNA和蛋白表达明显下调(TLR2 mRNA: 3.055±0.51, TLR4 mRNA: 3.920±0.5, TLR2蛋白: 51.15±1.84, TLR4蛋白: 43.25±0.27), 肠组织损伤明显减轻.
结论: 谷氨酰胺通过抑制TLR2、4 mRNA的表达, 减轻肠组织的损伤.
引文著录: 荆科, 孙梅. 谷氨酰胺对内毒素血症肠组织TLR2、4表达的影响. 世界华人消化杂志 2007; 15(29): 3122-3126
Revised: September 30, 2007
Accepted: September 28, 2007
Published online: October 18, 2007
AIM: To determine the effect of glutamine (Gln) on Toll-like receptor (TLR) 2 and 4 expression in rats with intestinal endotoxemia.
METHODS: Twenty-four Wistar rat pups aged 10 d were randomly divided into three groups: control (normal saline 1 mL/kg ip, n = 8), lipopolysaccharide (LPS) (LPS 5 mg/kg ip, n = 8), and Gln group (LPS 5 mg/kg + Gln 10 mL/kg ip, n = 8). The rats were sacrificed at 3 h after treatment. The small intestine was dissected for histological analysis, and expression of TLR2 and TLR4 mRNA was detected by reverse transcription-polymerase chain reaction. TLR2 and TLR4 protein expression was measured by Western blotting.
RESULTS: TLR2 and TLR4 mRNA and protein were detected at a low level in the intestine of the control group (TLR2 mRNA 1.386 ± 0.04, TLR4 mRNA 9.872 ± 0.36, TLR2 protein 22.28 ± 0.96, TLR4 protein 35.07 ± 0.17), but they were markedly increased at 3 h in the LPS group (TLR2 mRNA 4.093 ± 0.90, TLR4 mRNA 16.706 ± 1.28, TLR2 protein 79.27 ± 3.16, TLR4 protein 65.18 ± 0.46). In the Gln group, TLR2 and TLR4 mRNA and protein expressions were significantly decreased (TLR2 mRNA 3.055 ± 0.51, TLR4 mRNA 3.920 ± 0.5, TLR2 protein 51.15 ± 1.84, TLR4 protein 43.25 ± 0.27). The intestinal injury was obviously relieved.
CONCLUSION: TLR2 and TLR4 mRNA and protein expressions in the intestine of rats with endotoxemia are markedly inhibited by Gln, which led to relief of intestinal damage.
- Citation: Jing K, Sun M. Effects of glutamine on Toll-like receptor 2 and 4 expression in rats with intestinal endotoxemia. Shijie Huaren Xiaohua Zazhi 2007; 15(29): 3122-3126
- URL: https://www.wjgnet.com/1009-3079/full/v15/i29/3122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i29.3122
TLR(Toll-like receptor, TLR)是近年发现的一种免疫受体, 是一种跨膜蛋白, 能识别病原微生物或细胞壁成分, 通过信号转导激发天然免疫反应[1-4], 引起细胞因子和炎症介质的释放, 导致组织损伤. 谷氨酰胺(Glutamine, Gln)是肠道重要的能源物质, 许多研究证实Gln能减轻病理状态下肠黏膜的损伤和改善肠黏膜屏障的功能[5-6], 但Gln对肠黏膜保护作用的机制并不十分清楚. 本研究旨在探讨Gln对肠组织的保护作用是否可以通过抑制TLR的表达而实现.
清洁级Wistar幼鼠24只, 日龄10 d, 雌雄不限, 体质量为15-25 g, 由中国医科大学附属二院医学实验动物中心提供. 许可证号: SCXK(辽)2003-0009. 实验试剂脂多糖(LPS)(Escherichia coli O55: B5)购于Sigma公司, TRIzol总RNA提取试剂购自美国Promega公司, RT-PCR试剂盒、反转录和PCR扩增所需要的酶及其他试剂购于大连宝生物工程公司(日本TaKaRa公司), Western blot试剂TLR2兔抗鼠IgG(一抗)购于日本Santa Cruz公司, TLR4兔抗鼠IgG(一抗)购于武汉博士德生物工程有限公司, 即用型SABC试剂盒及DAB显色剂均购于武汉博士德生物工程有限公司. PCR引物根据Medline数据库自行设计, 由上海英骏生物公司合成.
1.2.1 分组和模型: 将24只幼鼠随机分为对照组(A组, n = 8只), 给予生理盐水1 mL/kg ip; LPS组(B组, n = 8只), LPS(5 mg/mL)5 mg/kg ip; 谷氨酰胺组(C组, n = 8只), Gln 10 mL/kg(含谷氨酰胺13.46 mg/100 mL)+LPS 5 mg/kg ip. 于ip后3 h处死, 留取距回盲端0.5-1 cm左右回肠组织, 于液氮速冻, 并转-70℃保存. 另取肠组织40 g/L甲醛固定, HE染色, 观察肠组织病理改变.
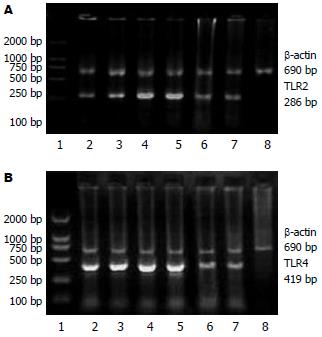
1.2.2 应用RT-PCR检测TLR2、4 mRNA的表达: TLR2、4引物序列(表1). 按TRIzol总RNA提取试剂说明书进行操作提取总RNA, 并经紫外分光光度计测定, 计算提取物RNA浓度. 并经反转录扩增cDNA. RT-PCR检测TLR2、4 mRNA表达, 取cDNA 3 μL(1 μg), 10×Buffer 2 μL, MgCl2 4 μL, 10 mmmol/L dNTPs 2 μL, 引物100 ng, TagDNA多聚酶1 μL, 总体系20 μL. 循环条件: 94℃预变性3 min, 94℃变性46 s, 退火1 min(TLR2 51.5℃, TLR4 53.5℃, β-actin 55℃), 72℃延伸80 s, 共35个循环, 72℃共延伸10 min. 取PCR扩增产物20 g/L琼脂糖凝胶电泳, 用凝胶成像系统及分析系统进行条带分析, β-actin作为内参照, 标化各组TLR mRNA含量.
| 引物名称 | 引物序列 | 扩增片段(bp) |
| TLR2 | F: 5'-CGC TTC CTG AAC TTG TCC-3' | 286 |
| R: 5'-GGT TGT CAC CTG CTT CCA-3' | ||
| TLR4 | F: 5'-CCA GAG CCG TTG GTG TAT-3' | 419 |
| R: 5'-GCC CTG TGA GGT CGT TGA-3' | ||
| β-actin | F: 5'-CAC CCT GTG CTG CTC ACC GAG | |
| GCC-3' | ||
| R: 5'-CCA CAC AGA TGA CTT GCG CTC | 690 | |
| AGG-3' |
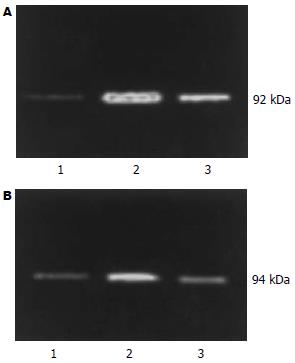
1.2.3 Western blot测定TLR2、4蛋白表达: 液氮速冻肠组织解冻, 裂解液裂解, 提取总蛋白, 并按改良Lowry法测定蛋白含量. 取总蛋白40 μL, 加5×样品缓冲液, 100℃煮沸4 min, SDS-PAGE电泳, 100 V电压转印至NC膜上, 将NC膜浸泡在1×TBS中10 min, 用50 g/L牛血清白蛋白封闭1 h, 1×TTBS冲洗膜两次, 加入TLR2、4兔抗大鼠IgG抗体, 4℃过夜, 次日1×TBS洗膜1次, 1×TTBS冲洗膜2次, 将NC膜浸泡于碱性磷酸酶标记的羊抗兔抗体溶液中2 h, 1×TBS冲洗膜两次, 显色液显色. 用GIS-2020型数码凝胶图像分析系统进行吸光度扫描分析, 测定样品灰度值.
统计学处理 数据均以mean±SD表示, 采用SPSS10.0数据分析软件系统进行方差分析, 组间比较采用LSD法检验, P<0.05为差异有显著性.
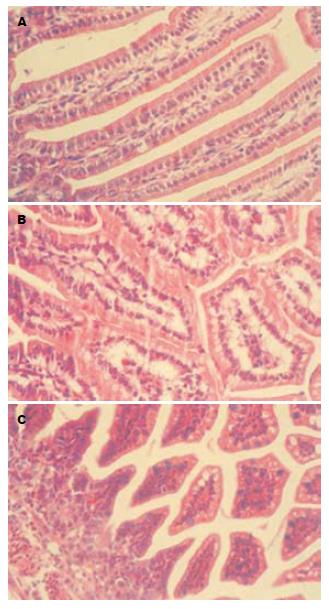
对照组肠绒毛完整, 上皮细胞排列整齐, 杯状细胞少见, 无明显异常改变(图1A). LPS组3 h后肠组织可见明显异常, 绒毛间质可见有充血, 少许炎性细胞浸润, 水肿明显, 肠上皮细胞排列紊乱, 细胞水肿, 未见杯状细胞(图1B). Gln组见绒毛间质轻度充血, 无明显水肿, 细胞轻度水肿, 杯状细胞明显增加(图1C).
对照组TLR2 mRNA表达较弱, LPS组TLR2 mRNA表达较对照组明显增强(P<0.01), 谷氨酰胺组TLR2 mRNA表达明显弱于LPS组(P<0.05, 表2, 图2A). TLR4 mRNA在对照组有较弱的表达, LPS组TLR4 mRNA表达较对照组显著上调(P<0.01), 谷氨酰胺组TLR4 mRNA表达较LPS组明显下调(P<0.01, 表2, 图2B).
感染常伴发胃肠功能障碍, 提示病情加重和预后不良. 胃肠功能障碍常常被认为是多器官功能衰竭的始发因子[7], 发病机制与内毒素和肠黏膜屏障功能密切相关, 近年来倍受人们的关注. 当肠黏膜的屏障功能破坏, 肠道内细菌及毒素大量入血及组织, 引起内毒素血症. 内毒素血症又促进细胞因子和炎性介质的释放, 加重肠黏膜屏障的损坏, 加速危重症的发展过程. 因此胃肠功能障碍是导致全身炎症反应综合征(SIRS)和多器官功能衰竭(MOF)的重要因素之一[8-9]. 谷氨酰胺被认为是一种条件必需氨基酸, 是体内含量最为丰富的氨基酸, 是快速分裂细胞如黏膜上皮细胞、淋巴细胞等的主要能源物质, 是许多生物活性物质如核苷酸等的前质. 有资料表明, 对于重症感染患者, 在TPN中给予谷氨酰胺营养支持后, 可减轻肠黏膜的损伤和改善肠黏膜的屏障功能, 肠源性细菌易位的发生率明显下降, 使多脏器功能障碍综合症得到明显改善[7-10]. 以往的实验对谷氨酰胺的作用多集中在营养支持方面, 对谷氨酰胺能减轻肠损伤的机制并没有清楚的认识. 本研究显示, 对内毒素血症幼鼠给予谷氨酰胺能明显下调TLR2、4 mRNA和蛋白的表达, 减轻肠黏膜损伤. LPS的识别和信号转导是宿主发生防御反应的关键, LPS介导的细胞激活需细胞表面能够与内毒素结合的蛋白参与, 这些蛋白包括LPS结合蛋白(LPS binding protein, LBP)和CD14, 并没有跨膜转导信号的功能[11-12]. 研究表明[13], TLR4和CD14在与LPS的反应中是紧密相连的, 也与他们在肠道的分布密切相关, 在肠道的表达有相似的模式. TLR既是免疫识别受体, 又是跨膜信号转导分子, TLR2、4均可识别LPS, 而TLR4是主要的识别受体[14-16]. 研究表明[17-20], TLR4与单独LPS的亲和力实际上相当低. 在体内LPS形成LPS-LBP-CD14复合物后与TLR4结合的亲和力明显增强, 并使TLR4激活, 通过信号转导作用, 激活NF-κB并使其向核内移位, 促进促炎介质合成和释放, 如TNF-α释放明显增加, 导致肠组织损伤, 使肠黏膜结构破坏和屏障功能降低, 导致细菌移位, 可导致肠源性内毒素血症, 诱发MOF. 本研究表明, 谷氨酰胺对TLR2、4的表达对LPS有明显的下调作用, 其机制可能是多方面的. 其中谷氨酰胺可能作为单体阻抑TLR与LPS的结合, 使信号转导不能传导到细胞内, NF-κB不能被激活, 因而炎症介质的合成释放受到抑制, 使肠黏膜免遭损伤. 因此, 我们认为谷氨酰胺能阻抑TLR与LPS的结合, 减少炎症介质的释放, 可能是其减轻肠黏膜损伤, 保护肠屏障功能的主要机制之一.
TLR是能识别病原微生物的免疫受体, 通过信号转导激发天然免疫反应, 导致组织损伤. 谷氨酰胺是肠道重要的能源物质, 能减轻病理状态下肠黏膜的损伤和改善肠黏膜屏障的功能, 但谷氨酰胺对肠黏膜的保护作用与TLR的关系尚未见报道.
TLR是一种免疫受体, 通过信号转导介导免疫反应, 引起细胞因子和炎症介质的释放, 导致组织损伤, 在免疫反应中有明显的高表达. 因此, 探讨保护剂在重症感染和SIRS时(如谷氨酰胺等)对TLR的作用是研究减轻脏器损伤, 避免MOF发生发展的重点.
有研究报道TLR能引起炎症介质释放, 导致肠黏膜损伤; 另有研究证实谷氨酰胺对肠黏膜有保护作用. 本文首次探讨谷氨酰胺对内毒素血症时TLR mRNA和蛋白的表达具有抑制作用, 证实谷氨酰胺可以通过抑制TLR的表达对肠黏膜起保护作用.
谷氨酰胺是重要的能源物质, 已应用于临床治疗中. 其在重症感染和SIRS时, 对脏器的保护和预防MOF具有重要作用. 进一步了解其作用机制, 有利于谷氨酰胺更有效合理的应用, 使其成为良好的脏器保护剂.
1 Toll样受体: 是能识别病原微生物的免疫受体, 是一种跨膜蛋白, 具有信号转导功能, 介导免疫反应.
2 谷氨酰胺: 是一种条件必需氨基酸, 是体内含量最为丰富的氨基酸, 是快速分裂细胞如肠黏膜上皮细胞、淋巴细胞等的主要能源物质.
本文实验目的明确, 方法先进, 内容新颖, 对临床工作具有一定的指导意义.
编辑: 程剑侠 电编:郭海丽
| 1. | Medzhitov R, Preston-Hurlburt P, Janeway CA Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 1997;388:394-397. [PubMed] |
| 2. | Medzhitov R, Janeway C Jr. The Toll receptor family and microbial recognition. Trends Microbiol. 2000;8:452-456. [PubMed] |
| 3. | Akira S, Takeda K. Toll-like receptor signalling. Nat Rev Immunol. 2004;4:499-511. [PubMed] |
| 4. | Beutler B. Inferences, questions and possibilities in Toll-like receptor signalling. Nature. 2004;430:257-263. [PubMed] |
| 5. | 秦 环龙, 高 奇, 苏 振东. 谷氨酰胺对内毒素血症大鼠小肠粘膜抗氧化损伤的保护作用. 中国普外基础与临床杂志. 2001;8:5-7. |
| 7. | Deitch EA. The role of intestinal barrier failure and bacterial translocation in the development of systemic infection and multiple organ failure. Arch Surg. 1990;125:403-404. [PubMed] |
| 8. | Soderholm JD, Perdue MH. Stress and gastroi-ntestinal tract. II. Stress and intestinal barrier function. Am J Physiol Gastrointest Liver Physiol. 2001;280:G7-G13. [PubMed] |
| 10. | Haque SM, Chen K, Usui N, Iiboshi Y, Okuyama H, Masunari A, Cui L, Nezu R, Takagi Y, Okada A. Alanyl-glutamine dipeptide-supplemented paren-teral nutrition improves intestinal metabolism and prevents increased permeability in rats. Ann Surg. 1996;223:334-341. [PubMed] |
| 11. | Ardawi MS. Effects of epidermal growth factor and glutamine-supplemented parenteral nutrition on the small bowel of septic rats. Clin Sci (Lond). 1992;82:573-580. [PubMed] |
| 12. | Ardawi MS, Jamal YS, Ashy AA, Nasr H, New-sholme EA. Glucose and glutamine metabolism in the small intestine of septic rats. J Lab Clin Med. 1990;115:660-668. [PubMed] |
| 13. | Noguchi Y, James JH, Fischer JE, Hasselgren PO. Increased glutamine consumption in small intestine epithelial cells during sepsis in rats. Am J Surg. 1997;173:199-205. [PubMed] |
| 14. | Wright SD, Ramos RA, Tobias PS, Ulevitch RJ, Mathison JC. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein. Science. 1990;249:1431-1433. [PubMed] |
| 15. | Ulevitch RJ, Tobias PS. Receptor-dependent mechanisms of cell stimulation by bacterial endotoxin. Annu Rev Immunol. 1995;13:437-457. [PubMed] |
| 16. | Ortega-Cava CF, Ishihara S, Rumi MA, Kawashima K, Ishimura N, Kazumori H, Udagawa J, Kadowaki Y, Kinoshita Y. Strategic compartmentalization of Toll-like receptor 4 in the mouse gut. J Immunol. 2003;170:3977-3985. [PubMed] |
| 17. | Chow JC, Young DW, Golenbock DT, Christ WJ, Gusovsky F. Toll-like receptor-4 mediates lipopolysaccharide-induced signal transduction. J Biol Chem. 1999;274:10689-10692. [PubMed] |
| 18. | Shimazu R, Akashi S, Ogata H, Nagai Y, Fukudome K, Miyake K, Kimoto M. MD-2, a molecule that confers lipopolysaccharide responsiveness on Toll-like receptor 4. J Exp Med. 1999;189:1777-1782. [PubMed] |
| 19. | Heumann D, Roger T. Initial responses to endotoxins and Gram-negative bacteria. Clin Chim Acta. 2002;323:59-72. [PubMed] |
| 20. | da Silva Correia J, Soldau K, Christen U, Tobias PS, Ulevitch RJ. Lipopolysaccharide is in close proximity to each of the proteins in its membrane receptor complex. transfer from CD14 to TLR4 and MD-2. J Biol Chem. 2001;276:21129-21135. [PubMed] |